
- •2. Перемещение. Скорость равномерного прямолинейного движения.
- •3. Уравнение равномерного прямолинейного движения точки, его графическое представление. Av-physics.Narod.Ru/mechanics/constant-motion.Htm
- •4. Мгновенная скорость. Сложение скоростей.
- •5. Ускорение.
- •6. Движение с постоянным ускорением. Единица ускорения.
- •7. Скорость при движении с постоянным ускорением
- •8. Уравнения движения с постоянным ускорением.
- •9. Свободное падение тел. Движение с постоянным ускорением свободного падения.
- •10. Движение тел. Поступательное движение твердого тела
- •11. Вращательное движение твердого тела.
- •12. Материальная точка. Первый закон Ньютона.
- •13. Сила
- •14. Связь между ускорением и силой. Второй закон Ньютона.
- •15. Третий закон Ньютона. Единицы массы и силы.
- •16. Понятие о системе единиц.
- •17. Инерциальные системы отсчета.
- •18. Принцип относительности в механике.
- •19. Гравитационные силы. 20. Закон всемирного тяготения.
- •21. Сила тяжести, вес и невесомость.
- •22. Деформация и силы упругости. 23. Закон Гука.
- •24. Силы трения.
- •25. Импульс материальной точки. 26. Закон сохранения импульса.
- •27. Работа ,мощность, энергия в механике (формулы, единицы измерения)
- •28. Кинетическая энергия. 29. Потенциальная энергия.
- •30. Закон сохранения энергии в механике.
- •31. Основные положения молекулярно-кинетической теории и их обоснование.
- •32. Масса молекул, относительная молекулярная масса молекул. 33. Молярная масса молекул. 34. Количество вещества. 35. Постоянная Авогадро.
- •36. Броуновское движение.
- •37. Силы взаимодействия молекул. 38. Строение газообразных веществ. 39. Строение жидких веществ. 40. Строение твердых тел.
- •41. Идеальный газ в молекулярно-кинетической теории.
- •42. Давление газа в молекулярно-кинетической теории.
- •43. Среднее значение квадрата скорости молекул идеального газа.
- •44. Вывод основного уравнения молекулярно-кинетической теории газа. 45. Вывод формулы, связывающей давление и среднюю кинетическую энергию молекул газа.
- •46. Тепловое равновесие. 47. Температура. Изменение температуры. 48. Приборы для измерения температуры.
- •49. Средняя кинетическая энергия молекул газа при тепловом равновесии.
- •50. Газы в состоянии теплового равновесия (описать опыт).
- •51. Абсолютная температура. 52. Абсолютная шкала температур. 53. Температура- мера средней кинетической энергии молекул.
- •54. Зависимость давления газа от концентрации его молекул и температуры.
- •55. Измерение скоростей молекул газа. 56. Опыт Штерна.
- •57. Вывод уравнения состояния идеального газа (уравнение Менделеева-Клайперона)
- •58. Изотермический процесс.
- •59. Изобарный процесс.
- •60. Изохорный процесс.
- •61. Испарение и конденсация.
- •62. Насыщенный пар. Давление насыщенного пара.
- •63. Зависимость давления насыщенного пара от температуры.
- •64. Кипение.
- •65. Критическая температура.
- •66. Парциальное давление. Относительная влажность. 67. Приборы для измерения относительной влажности воздуха.
- •68. Поверхностное натяжение.
- •69. Смачивание.
- •70. Капиллярные явления.
- •71. Кристаллические тела и их свойства.
- •72. Аморфные тела и их свойства.
- •73. Виды деформации твердых тел.
- •74. Диаграмма растяжения.
- •75. Пластичность и хрупкость.
50. Газы в состоянии теплового равновесия (описать опыт).
??????
51. Абсолютная температура. 52. Абсолютная шкала температур. 53. Температура- мера средней кинетической энергии молекул.
Зависимость средней кинетической энергии молекул газа от его температуры можно получить из закона открытого французским физиком Ж. Шарлем в 1787 году.
Согласно
закону Шарля, если объём данной массы
газа не меняется, его давление pt линейно
зависит от температуры t:
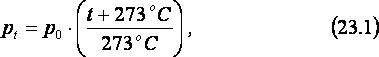
где
t – температура газа, измеренная в оС,
а p0
– давление газа при температуре 0 оС
(см. рис. 23б). Таким образом, из закона
Шарля следует, что давление газа,
занимающего неизменный объём,
пропорционально сумме (t+273 оС).
С другой стороны, из (22.4) вытекает, что,
если концентрация молекул постоянна,
т.е. объём, занимаемый газом, не изменяется,
то давление газа должно быть пропорционально
средней кинетической энергии молекул.
Значит, средняя кинетическая энергия,
ЕСР
молекул газа, просто, пропорциональна
величине (t+273 оС):
![]()
где b – постоянный коэффициент, значение которого мы позже определим. Из (23.2) следует, что средняя кинетическая энергия молекул станет равной нулю при -273 оС. Исходя из этого, английский учёный У. Кельвин в 1848 г. предложил использовать абсолютную температурную шкалу, нулевая температура в которой соответствовала бы -273 оС, а каждый градус температуры был бы равен градусу шкалы Цельсия. Таким образом, абсолютная температура, T связана с температурой t, измеренной по шкале Цельсия, следующим образом:
![]()
За единицу абсолютной температуры в СИ принят Кельвин (К).
Учитывая
(23.3), уравнение (23.2) преобразуется в:
![]()
подставляя
которое в (22.4), получаем следующее:
![]()
Чтобы
избавиться от дроби в (23.5), заменим 2b/3
на k, и получим вместо (23.4) и (23.5) два очень
важных уравнения:

где k – постоянная Больцмана, названная в честь Л. Больцмана. Эксперименты показали, что k=1,38.10-23 Дж/К. Таким образом, давление газа и средняя кинетическая энергия его молекул пропорциональны его абсолютной температуре.
54. Зависимость давления газа от концентрации его молекул и температуры.
В большинстве случаев при переходе газа из одного состояния в другое меняются все его параметры – температура, объём и давление. Так происходит, когда газ сжимается под поршнем в цилиндре двигателя внутреннего сгорания, в результате чего температура газа и его давление растут, а объём уменьшается. Однако в некоторых случаях изменения одного из параметров газа относительно малы или вообще отсутствуют. Такие процессы, где один из трёх параметров – температура, давление или объём остаются неизменными, называют изопроцессами, а законы, которые их описывают – газовыми законами.
Изотермическим процессом называют изменение состояния газа, при котором его температура остаётся постоянной. Примером такого процесса может служить накачивание воздухом автомобильных шин. Однако изотермическим такой процесс можно считать, если сравнивать состояние воздуха перед тем, как он оказался в насосе, с его состоянием в шине после того, как температура шины и окружающего воздуха стали равными. Любые медленные процессы, происходящие с малым объёмом газа, окружённым большой массой газа, жидкости или твёрдого тела, имеющей постоянную температуру, можно считать изотермическими.
При
изотермическом процессе произведение
давления данной массы газа на его объём
есть величина постоянная. Этот закон,
называемый законом Бойля-Мариотта, был
открыт английским учёным Р. Бойлем и
французским физиком Э. Мариоттом и
записывается в следующем виде:
![]()
Изобарным процессом называют изменение состояния газа, происходящее при постоянном давлении.
При изобарном процессе отношение объёма данной массы газа к его температуре постоянно. Этот вывод, который называют законом Гей-Люссака в честь французского учёного Ж. Гей-Люссака, можно записать в виде:
![]()
Одним из примеров изобарного процесса является расширение маленьких пузырьков воздуха и углекислого газа, содержащихся в тесте, когда его ставят в духовку. Давление воздуха внутри духовки и снаружи одинаково, а температура внутри приблизительно на 50% больше, чем снаружи. Согласно закону Гей-Люссака объём газовых пузырьков в тесте вырастает тоже на 50% , что и делает пирог воздушным.
Процесс,
при котором изменяется состояние газа,
а его объём остаётся неизменным, называют
изохорным.
Из уравнения Менделеева - Клапейрона
следует, что у газа, занимающего постоянный
объём, отношение его давления к температуре
тоже должно быть постоянным:
![]()
