2. Принципы получения белок-содержащих систем для применения в биотехнологии и медицине.
Способы иммобилизации чрезвычайно разнообразны, что позволяет подобрать наиболее оптимальный метод включения биомолекул с учетом специфики их последуещего применения.
Иммобилизацию биомолекул можно проводить методом адсорбции или «ковалентной пришивки» ферментов к поверхности природных или синтетических носителей; включением ферментов в полимерные гели, поперечной сшивкой молекул фермента, включением в комплексы с полиэлектролитами; инкапсулированием; а также включение белков в липопротеидные комплексы, липосомы, обращенные мицеллы ПАВ.
В последние годы для получения белок-содержащих микро- и наносистем широко применяют комбинации различных методов иммобилизации и/или образования коньюгатов. Ярким примером комбинации нескольких методов иммобилизации относятся получение мультифункциональных многослойных полиэлектролитных капсул, где капсулы являются носителями биомолекул, и при этом капсулам можно придавать требуемые функциональные свойства путем введения специфицеских молекул или коллоидных частиц (например, флуоресцентных или магнитных).
Классические методы иммобилизации подробно рассмотрены в книге «Биотехнология» части 1 и 7.
? Студенты при сдаче коллоквиума должны уметь рассмотреть следующие аспекты:
-
Классификация носителей для иммобилизации ферментов и обсудить области их возможного применения (привести примеры);
-
Методы иммобилизации – их применение (привести примеры)
-
Ковалентная «пришивка» фермента к носителю.
Активация функциональных групп носителей (привести уравнения реакции)
-
Особенности (характеристики и свойства) иммобилизованных ферментов
Здесь мы рассмотрим наиболее часто употребляемые методы при получении белок-содержащих систем для применения в биотехнологии и медицине.:
-
образование интерполиэлектролитных и фермент-полиэлектролитных комплексов,
-
инкапсулирование биомолекул
-
включение в липосомы или обращенные мицеллы ПАВ,
-
образование коньюгатов с полиспиртами ПЭГ и блоксополимерами, плюрониками и проксанолами.
Интерполиэлектролитные и Белок-Полиэлектролитные комплексы
Метод образования интерполиэлектролитных комплексов широко применяется для получения белок-содержащих коллоидных частиц, а также при создании оболочки микрокапсул. Преимуществом данного метода является технологичность, мягкие условия получения и наоборот - деградации, а также возможность целенаправленного контроля свойств частиц: размера, который может варьироваться от 50-100 нм до микрометров; функциональных, гидродинамических, поверхностных свойств частиц. Белок-полиэлектролитные комплексы (БПЭК) спонтанно образуются, в основном, за счет электростатических взаимодействий противоположно заряженных групп полиэлектролитной пары или пары белок-полиэлектролит (рис. 4.).




Рис. 4. Образования белок-полиэлектролитных комплексов.
БПЭК устойчивы в широком интервале значений рН и ионной силы и отличаются высокой стабильностью благодаря кооперативному характеру взаимодействия. Состав и свойства БПЭК зависят от таких параметров как рН, ионная сила, количество зарядов на поверхности белка, его изоэлектрическая точка и степень полимеризации полиэлектролита. При изменении рН меняется количество зарядов на поверхности белковой глобулы (рис. 5.), что приводит к изменению числа межмолекулярных контактов между белком и полиэлектролитом, в результате чего меняется состав комплекса, его структура и общий размер частицы. Например, если комплекс состоит из белка и поликатиона, то снижение рН приводит к увеличению "емкости" поликатиона по молекулам белка при неизменной длине поликатиона. При этом уменьшается число межмолекулярных контактов в комплексе в расчете на одну глобулу белка.
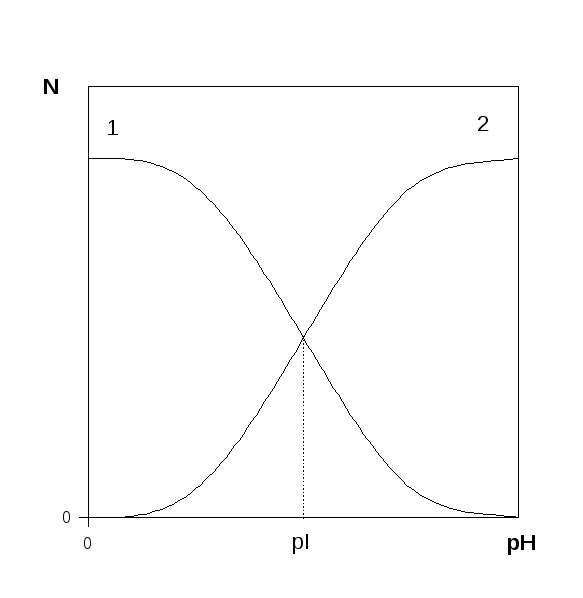
Рис. 5. Зависимость количества положительных (1) и отрицательных (2) зарядов на поверхности белка от рН среды. рI - изоэлектрическая точка белка.
Наличие в системе низкомолекулярного электролита оказывает влияние на характеристический состав БПЭК. При увеличении ионной силы низкомолекулярный электролит начинает конкурировать с полиэлектролитом за солевые связи с белком, что приводит к уменьшению "емкости" полиэлектролита по белку.
При низкой ионной силе для БПЭК наблюдается образование неравновесного комплекса. Для того, чтобы образовался равновесный БПЭК необходимо добавлять небольшое (5-10 мМ) количество соли в растворы полиэлектролита и белка. При высокой концентрации соли (свыше 0,5 М) происходит полное разрушение комплекса белка с полиэлектролитом, а сильное обессоливание (методом диализа) системы приводит к электростатической дестабилизации частиц БПЭК. При этом увеличивается вязкость среды, что связано с образованием крупных агрегатов, которые при добавлении соли восстанавливают свойства БПЭК.
Каталитическая активность ферментов в комплексе с ПЭ
Образование комплекса с ПЭ, как правило, не приводит к изменению каталитических параметров ферментов. Катализ ферментами в комплексе с полиэлектролитами как правило описывается схемой Михаэлиса-Ментен. В ряде случаев наблюдаеются увеличение каталитической активности ферментов за счет эффектов микросреды, образуемой полиэлектролитной оболочкой, может наблюдаться также уменьшение константы Михаэлиса в 2-5 раз для низкомолекулярных субстратов, но чаще всего кинетические константы остаются практически неизменными.
Для ферментов, включенных в комплекс с полиэлектролитом наблюдается: сохранение каталитических свойств; повышение устойчивости к действию протеолитических ферментов; повышение термостабильности, и стабильности при хранении, часто наблюдается изменение рН профиля зависимости каталитической активности.
Студенты при сдаче коллоквиума по данной теме должны уметь объяснить:
а) за счет чего может увеличиваться стабильность ферментов?
б) за счет чего может меняться рН профиль зависимости каталитической активности ферментов при образовании комплексов с полиэлектролитами?
в) Какие свойства обуславливают применимость ИПЭК и фермент-ПЭ комплексов в биотехнологии и медицине?
Для получения нерастворимых в воде комплексов применяют метод образования тройных комплексов белок-полианион-поликатион, в которых белок связан с обоими ПЭ и в которых регулируется число нескомпенсированных зарядов на полиэлектролитах путем подбора условий. Данный принцип образования комплексов применяют, например, при синтезе белок-содержащих многослойных полиэлектролитных капсул.
Многослойные полиэлектролитные капсулы
Многослойные полиэлектролитные капсулы – можно расматриватиь как универсальные мультифункциональные носители.
Полиэлектролитные нанокапсулы состоят из следующих блоков: (1) Полиэлектролитные оболочка капсул; (2) Включаемые целевые биомолекулы; (3) Дополнительные функциональные агенты (магнитные, флуоресцентные молекулы или частицы, коллоидные частицы драгоценных металлов, золота или серебра) (рис. 6.).
М
 ногофункциональные
полиэлектролитные капсулы
ногофункциональные
полиэлектролитные капсулы
Дополнительные
функциональные молекулы/частицы
Включаемые
вещества: Биомакромолекулы, лекарства
Полиэлектролитная
оболочка капсулы
Белки,
антитела, ферменты
ферромагнитные
частицы
локальный
перегрев капсул, коллоидные частицы
Au,
Ag
Искусственные
ПЭ
Д
 НК,
лекарства
НК,
лекарства
Природные
ПЭ: полисахариды
флуоресцентные
молекулы, частицы квантовые
точки
Рис. 6. Структура многослойных полиэлектролитных капсул
Синтез многослойных полиэлектролитных капсул проводят послойной адсорбцией полиэлектролитов (поочередно, поликатионов и полианионов) на противоположных по заряду сферических частицах (рис. 7). Частицы могут быть полистиреновые, силикагельные, карбонатные, (MnCO3, CaCO3, CdCO3), а также это могут быть биологические клетки. После окончания процесса послойной адсорбции сферическая частица, служившая в качестве матрицы при синтезе полиэлектролитных капсул удаляется (например, методом растворения) без повреждения структуры полиэлектролитной оболочки.
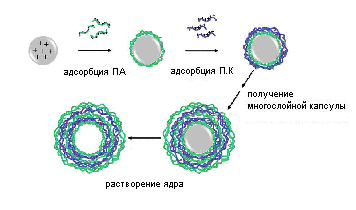
Рис. 7. Синтез многослойных полиэлектролитных капсул.
Для растворения ядра полиэлектролитных капсул используют растворы соляной кислоты, раствор ЕДТА и др. в зависимости от химической природы материала. Размер внутренней полости капсул регулируется размером используемой в качестве матрицы частицы, размер которой и соответственно размер внутренней полости капсул может варьироваться от 20 до нескольких сотен нанометров. Отметим, что для использования в медицинских целях при синтезе многослойных полиэлектролитных нанокапсул используют биосовместимые материалы природные полисахариды и белки (подробное описание материалов приведено выше).
Споcобы инкапсулирования целевых функциональных биомолекул. Существует несколько способов включения биомолекул в полимерные капсулы. Одна из стратегий основана на использовании ферментов в кристаллическом состоянии или клеток в качестве ядра (матрицы) капсул, на которые послойно адсорбируют полиэлектролитные оболочки. Активность инкапсулированного фермента при этом польностью сохраняется, сохраняются также нативные функциональные свойства клеток. Недостатком такого способа является невозможность получения монодисперстных частиц и невозможность четкого контроля формы, размеров и других параметров частиц.
Другой метод основан на возможности включать биомолекулы в полиэлектролитные нанокапсулы незамедлительно после растворения матрицы (ядра) капсулы. Например, существует возможность регулировать проницаемость полиэлектролитной оболочки капсул изменением условий, например, изменяя значение рН и полярность растворителя, переводя капсулы из «закрытого» состояния в «открытое» и обратно. Так, при понижении рН и в присутствии этанола структура полиэлектролитного комплекса становится более рыхлой и полиэлектролитная оболочка становится проницаемой и доступной для включения белков. После включения целевых биомолекул, полиэлектролитная капсула переводится в «закрытое состояние» путем изменения условий среды (рис. 8.). Преимуществом данного метода является возможность синтезировать монодисперстные нанокапсулы заданного размера внутренней полости, используя в качестве матрицы при синтезе полиэлектролитных капсул комерчески доступные полимерные наночастицы.
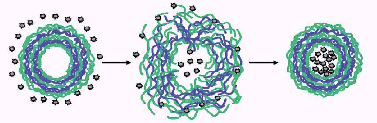
Рис. 8. Включение функциональных биомолекул методом регулирования проницаемости полиэлектролитной микрокапсулы
Альтернативным методом включения целевых функциональных биомолекул является предварительная адсорбция целевых биомолекул на порах наночастиц (например, карбонатных кристаллов), используемых в качестве матрицы при синтезе полиэлектролитных капсул с последующим растворением матрицы в мягких условиях, низких рН или в присутствии ЕДТА. Недостатком подхода является методические трудности при получении монодисперстных карбонатных наночастиц.
Помимо включения целевых биомолекул, полиэлектролитным нанокапсулам можно придавать дополнительные функциональные свойства. Например при включении полупроводниковых коллоидных наночастиц CdSe или CdTe (квантовых точек) капсуле придают флуоресцентные свойства и тем самым, возможность детекции наночастиц (рис. 6.).
Путем включения магнитных наночастиц, Fe3О4, капсулам придают контролируемую подвижность в требуемом направлении с заданной скоростью, которую регулируют, применяя внешний градиент магнитного поля.
Включение коллоидных частиц благородных металлов, золота или серебра в полиэлектролитные слои позволяет регулировать проницаемость полиэлектролитных капсул или инициировать их разрушение. Метод основан на том, что поглощении света частицами золота или серебра приводит к локальному перегреву полиэлектролитных капсул, что ведет к разрушению капсулы и выбросу целевых молекул (лекарства) (рис. 10).
Физико-химические методы контроля свойств частиц
Для контроля свойств полиэлектролитных капсул и/или роста полиэлектролитных слоев на сферической матрице при синтезе частиц используют ряд физико-химических методов, светорассеяние, электрофоретическая подвижность, за структурой частиц обычно следят методом атомно-силовой микроскопии.
Метод лазерной сканирующей микроскопии (или флуоресцентной микроскопии) используется для наблюдения в реальном времени и в условиях in vivo за свойствами нанокапсул, их подвижностью, проникающей способности, поглощения клеткой, и доставкой инкапсулированных материалов.
Контролируемая доставка и выброс лекарства. Механизм контролируемого выброса лекарства основан на разрушении или регуляции проницаемости оболочки нанокапсул с применением физических методов (свет, ультразвук, радиоволны).
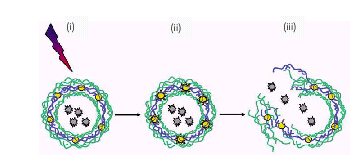
Рис. 9. Контролируемый выброс лекарства путем разрушения нанокапсулы под воздействием лазерного света. (i) Направленный лазерный луч вызывает локальный нагрев частиц коллоидного золота (содержащихся в нанокапсуле), что приводит к светоразрушению капсулы и высвобождению инкапсулированного материала.
Таким образом, многослойные полиэлектролитные капсулы являют собой мультифункциональные наносистемы, с четко регулируемыми свойствами.
Инкапсулирование альгинат-хитозан. Основная область применения - для доставки лекарств, инкапсулирование обеспечивает устойчивость лекарств (в том числе, белков) к био- и кислотной деградации в желудочно-кишечном тракте, а также пролонгированое действие лекарств.
Одним из наиболее широко применяемых методов для придания требуемых свойств лекарственным средствам на основе белков является инкапсулирование биоактивных молекул с использованием альгината, каррагинана, коллагена, желатины, целлюлозы, а также некоторых синтетических полимеров. Белки включенные в такие частицы характеризуются высокой биологической и термостабильностью, устойчивостью к изменению рН, улучшенным (в том числе, более пролонгированным) лечебным эффектом и возможностью направленной доставки.
Существует два принципиально различных способа инкапсулирования биомолекул. Первый способ – метод внешнего гелеобразования. Раствор альгината, содержащий инкапсулируемый материал (белок) с помощью специального «микроразбрызгивателя» вносят в раствор хлорида кальция. «Микроразбрызгиватель» - (или пульверизатор) позволяет получать однородные капли заданного размера. При контакте альгината с ионами кальция немедленно образуются сферические полимерные белок-содержащие частицы. Гелеобразование происходит в направлении от поверхности к центру частиц. Поэтому рассматриваемый метод называют способ внешнего гелеобразования.
Рассмотрим метод внутреннего гелеобразования при инкапсулировании биомолекул с использованием альгината (рис. 10). Иммобилизацию биомолекул на частицах альгината проводят следующим образом: к раствору альгината добавляют твердый измельченный карбонат кальция. Полученную смесь эмульгируют в растительном масле, содержащем ПАВ (SPAN 80). Гелеобразование инициируют понижением рН системы (добавлением 0.2% уксусной кислоты). Частицы геля промывают от масла. На полученных сферических частицах адсорбируют фермент, после чего покрывают пленкой хитозана по механизму электростатического комплексообразования.
Вопросы студентам:
1) при каких значениях рН (интервал) следует проводить адсорбцию фермента? наносить на фермент-содержащие частицы хитозановое покрытие?
2) Как можно определить эффективность (выход) инкапсулирования (по ферменту?)
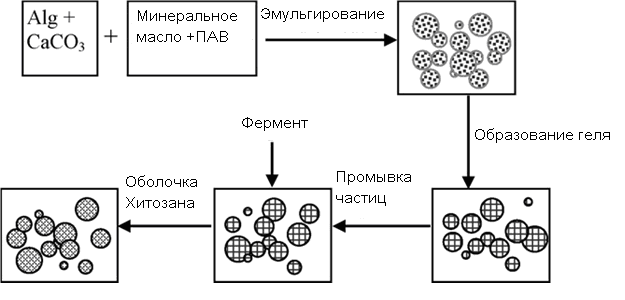
Рис. 10. Инкапсулирование ферментов на альгинат-хитозановых частицах.
В заключении отметим, преимуществом инкапсулирования методом внутреннего гелеобразования путем эмульгирования является возможность получения частиц заданного размера, варьированием условий (содержания воды, ПАВ в системе).
Включение ферментов и других биологически активных молекул в липосомы
Искусственные липопротеидные комплексы, липосомы, обращенные мицеллы, часто применяются в биологии для изучения мембраноактивных белков и моделирования различных ферментативных, транспортных и рецепторных функций клеточных мембран. Липосомы часто используют в медицине и косметике, поскольку такие системы по своим свойствам близки к природным мембранам. Основное применение липосом в области медицины – создание биосовместимых носителей для направленной доставки биоактивных молекул, лекарств.
Липосомы представляют собой частицы, которые образованы одним или несколькими концентрическими замкнутыми липидными бислoями, внутренний объем которых изолирован от внешней среды. В зависимости от размера частиц и числа образующих их липидных слоев различают следующие липосомы: 1) малые моноламеллярные, образованные одиночным липидным бислоем (диаметр 20-50 нм); 2) крупные моноламеллярные (макровезикулярные), образованные также одиночным бислоем (диаметр 50-200 нм и выше); 3) многослойные (мультиламеллярные), насчитывающие до неск. десятков и даже сотен липидных бислоев (диаметр до 5000-10000 нм) (рис. 11).
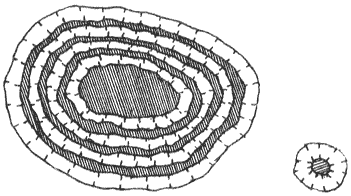
Рис. 11. Липосомы могут быть однослойными (диаметр 20- 50 нм) и многослойными (5 -50 микрометров). Заштрихованные зоны – место нахождения воды, светлые – бимолекулярный липидный слой, «хвосты» составляющих его молекул обращены внутрь слоя.
Один из способов получения фермент-содержащих липосом заключается в том, что раствор липида в органическом растворителе впрыскивают с помощью микро-шприца в воду или водный солевой раствор при температуре, несколько превышающей точку кипения растворителя. После испарения растворителя в токе инертного газа происходит самопроизвольное образование (самосборка) бислойных пузырьков, липосом, содержащих включенный фермент.
В другом варианте раствор липида (например, лецитина) в органическом растворителе (например, в хлороформе) упаривается в вакууме. Липид остается на стенках колбы в виде тонкой пленки. Затем в колбу вносят раствор фермента, встряхивают и выдерживают в течении некоторого времени. В полученной системе происходит самосборка мультиламеллярных липосом, содержащих включенный фермент. Для удаления невключившегося фермента липосомы отделяют центрифугированием и ресуспендируют в водном буферном растворе.
Моноламеллярные липосомы получают из мультиламеллярных ультразвуковой обработкой. Недостатком таких систем являются их недостаточная устойчивость, что сужает область их практического применения в медицине.
В последние годы применяют способ получения фермент-содержащих липосом путем включения ферментов в полимерные липосомы. Для получения липосом в этом случае используются липиды, модифицированные путем введения в их молекулу кратной связи. После включения фермента в липосомы, приготовленные из модифицированных молекул липидов, проводят полимеризацию липидных молекул (например путем облучения ультрафиолетовым светом в присутствии инициатора). Образуются ковалентно сшитые замкнутые липидные бислойные мембраны. Полимерные липосомы обладают гораздо более высокой стабильностью по сравнению с обычными.
Липосомы часто применяются в биологии для изучения мембраноактивных белков и моделирования различных ферментативных, транспортных и рецепторных функций клеточных мембран. Липосомы очень хорошо зарекомендовали себя в качестве модельной системы при изучении свойств биомембран. Липосомы позволяют воссоздавать элементы биологических структур непосредственно из материала биологических мембран. Было обнаружено, что отделенные от биомембран мембранные ферменты после включения в липосомы обнаруживают сходные со связанным на биомембране ферментом физические и каталитические свойства.
В настоящее время липосомы применяются в экспериментальной медицине и косметике как одно из основных средств доставки биоактивных молекул и лекарственных средств. Многие липосомальные препараты дошли до клинических испытаний и некоторые из них лицензированы и применяются. Применение липосом имеет ряд существенных преимуществ перед другими носителями лекарств. Прежде всего, это биосовместимость, что обусловлено сходством с природными мембранами клеток по химическому составу: мембрана липосом состоит из природных фосфолипидов. И при правильном подборе компонентов липосом их введение в организм не вызывает негативных реакций.
Второе важное свойство липосом – это универсальность. Благодаря полусинтетической природе можно широко варьировать их размеры, характеристики, состав поверхности. Кроме того, вещество, заключенное в липосомы, защищено от воздействия ферментов, что увеличивает эффективность препаратов, подверженных биодеструкции в биологических жидкостях. Это позволяет использовать липосомы в качестве носителей для широкого круга фармакологически активных веществ: противоопухолевые и противомикробные препараты, гормоны, ферменты, вакцины, а также дополнительные источники энергии для клетки, генетический материал.
В-третьих, липосомы сравнительно легко разрушаются в организме (они биодеградируемы), высвобождая доставленные вещества. В процессе доставки лекарств липосомы, сами лишенные свойств антигена, экранируют включенные в них биоактивные молекулы от контакта с иммунной системой, не вызывая защитных и аллергических реакций организма. Еще одно важное преимущество липосом как лекарственной формы - постепенное высвобождение лекарственного вещества, инкорпорированного в них, что увеличивает время его действия.
Особую роль играет характер взаимодействия липосом с клетками, который может принимать различные формы: самая простая – липосомы адсорбируются на клеточной поверхности. При определенных условиях липосомы могут поглощаться клетками, их мембрана может сливаться с клеточной мембраной, что приводит к внутриклеточной доставке их содержимого (рис. 12).
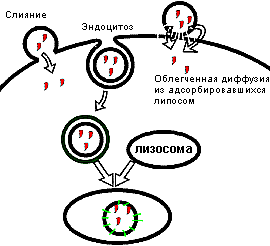
Рисунок 12. Способы проникновения содержимого липосом в клетку (из работы А.П. Каплун, Ле Банг Шон, Ю.М. Краснопольский, В.И. Швец. Вопросы медицинской химии. 1999. Том 45. выпуск 1).
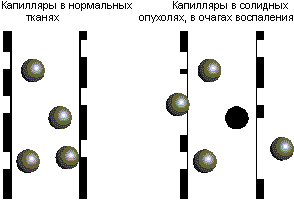
Как носители лекарств липосомы наиболее широкое применение получили в экспериментальной онкологии. Суть в том, что существует ряд препаратов, весьма эффективно разрушающих злокачественные клетки или тормозящих их рост. Однако применить их в терапевтических целях не всегда возможно из-за их большой токсичности или плохой растворимости в воде. С помощью липосом эти трудности могут быть преодолены. Так, одно из свойств липосом, регулируемость их размеров в нанодиапазоне стало основой для конструирования эффективных антираковых препаратов. Речь идет о соотношении размеров частиц и диаметра пор капилляров. В случае когда размер липосом больше диаметра пор капилляров, их объем распределения ограничивается компартаментом введения. Например, при внутривенном введении они не выходят за пределы кровотока, т.е. должны плохо проникать в органы и ткани. Следовательно, резко понижается токсическое действие субстанции, включенной в липосому. С другой стороны, это свойство может служить основой для направленной доставки терапевтических препаратов в опухоли и очаги воспаления, так как капилляры, снабжающие эти области кровью, как правило, сильно перфорированы (рис. 13). Следовательно, частицы, содержащие лекарство будут накапливаться в опухоли. Это явление получило название пассивное нацеливание. Таким образом, существует две причины, вследствие которых липосомальные препараты антиканцерогенных субстанций очень эффективны: уменьшение токсичности и пассивное нацеливание.
|
|
|
|
Следствия: |
|
|
- Уменьшение токсичности - Уменьшение объема распределения и, след. - Увеличения концентрации в кровотоке |
- Пассивное нацеливание в "горячие" области |
Рис. 13. Пассивное нацеливание
Использование липосом для точной, целенаправленной доставки лекарственных веществ имеет, однако, и определенные сложности. Дело в том, что после попадания в организм большая часть липосом поглощается клетками ретикулоэндотелиальной системы (РЭС). Для увеличение времени циркуляции липосомальных препаратов было предложено их поверхность модифицировать полимерами с гибкой гидрофильной цепью, например полиэтиленгликолем (ПЭГ). Для этого используются модифицированные липиды, например, фосфатидилэтаноламин (ФЭ), конъюгированный с ПЭГ. На рис. 14 представлена схема такой "стерически стабилизированной" липосомы. Гибкие молекулы ПЭГ создают в примембранной области избыточное осмотическое давление. Липосомы как бы становятся невидимыми для РЭС (отсюда и название "stealth liposomes").
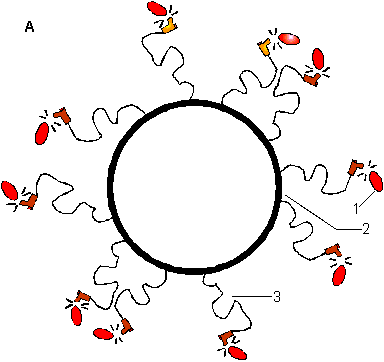
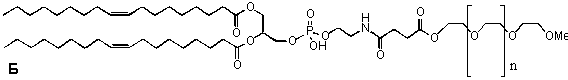
Рисунок 14. А. Стерически стабилизированные липосомы (Stealth liposomes). Белки (1) не могут достичь поверхности липосом (2) из-за избыточного осмотического давления в примембранном пространстве, создаваемом гибкими цепями (3) иммобилизованных полимеров (например, ПЭГ). Б. Фосфатидилэтаноламин, конъюгированный с ПЭГ, используемый для получения стерически стабилизированных липосом.
Рис. 15. демонстрирует насколько увеличивается время циркуляции стерически стабилизированных липосом.
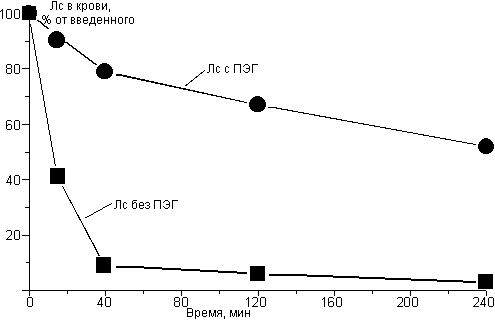
Рисунок 15. Время циркуляции липосом, модифицированных ПЭГ в сравнении с обычными липосомами (из работы Torchilin V.P. et al. (1994) BВА, 1195, 181-184).
Во многих случаях важна адресная доставка в нужный тип клеток. В качестве "молекулярного адреса" наиболее часто выбирают иммуноглобулины, имеющие соответствующие мишени на целевых клетках.
Таким образом, можно представить модель "идеальной" липосомы, как средства направленной доставки лекарственного вещества в клетку (рис. 17). Такая липосома содержит во внутреннем объеме лекарственное вещество, например, ДНК в случае генной терапии, на ее поверхности иммобилизованы гибкие цепи полимера для уменьшения поглощения клетками РЭС, молекулярный адрес, в мембрану инкорпорированы белки слияния. Кроме того, мембрана состоит не только из обычных фосфолипидов, образующих бислой (чаще фосфатидилхолина), но и липидов способствующих слиянию с мембраной клетки (например, диолеоилфосфатидилэтаноламина).
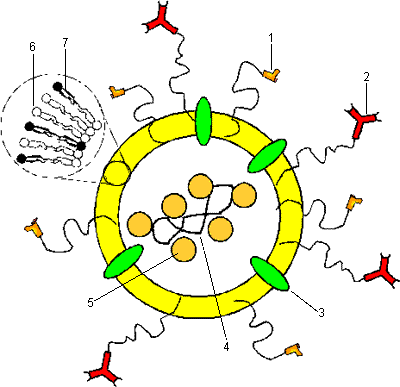
Рисунок 17. "Идеальная" конструкция липосомы для направленной доставки лекарственного вещества в клетку (из работы А.П. Каплун, Ле Банг Шон, Ю.М. Краснопольский, В.И. Швец. Вопросы медицинской химии. 1999. Том 45. выпуск 1).
1) Полимер для стерической защиты от РЭС (например, ПЭГ); 2) "Молекулярный адрес" на полимерной ножке (в основном иммуноглобулины); 3) Белки слияния (например, гемагглютинин); 4) Лекарственное вещество (например, ДНК); 5) Липидные положительно заряженные частицы для компактизации ДНК; 6) Мембранообразующие липиды (фосфатидилхолин); 7) Липиды, дестабилизирующие мембрану (например, ФЭ).
Основной недостаток липосом как лекарственной формы - относительная небольшая стабильность при хранении. Но, и эта проблема решается. Так, был найден способ сушки предварительно замороженных липосом. Такие высушенные липосомы, содержащие лекарственные вещества, способны храниться достаточно долго: месяцы и годы. Для их использования достаточно прилить к ним тот объем воды, который был удален при сушке.
Обращенные мицеллы - сферические частицы, образованные ассоциатами дифильных молекул ПАВ, в которых гидрофобные части молекул ПАВ направлены в сторону неполярного растворителя, а полярные группы – внутрь мицелл. Обращенные мицеллы самопроизвольно образуются в тройных системах ПАВ-вода-органический растворитель. В качестве мицеллообразующего материала используются разнообразные синтетические ПАВ, а также природные липиды. Мицеллы, построенные из анионных ПАВ, (в отличие от катионных), как правило, характеризуются узким распределением по размерам, размер мицелл не зависит от концентрации ПАВ. Благодаря способности образовывать монодисперсные системы, широкое применение нашли обращенные мицеллы на основе АОТ, натриевой соли ди-(2-этил)-гексилового эфира сульфоянтарной кислоты.
Ферменты могут включаться в обращенные мицеллы ПАВ в органических растворителях с сохранением их функциональной активности. При солюбилизации ферментов в системе обращенных мицеллы ПАВ молекула белка может «выбрать» оптимальное микроокружение, соответствующее ее природе. Как показано на рисунке 18, молекула гидрофильного белка избегает прямого контакта как с органическим растворителем, так и с поверхностью внутренней полости мицеллы, локализуясь в водном ядре гидратированной обращенной мицеллы. Поверхностно-активные белки, например липазы, имеют возможность взаимодействовать с поверхностным слоем обращенной мицеллы или даже частично в него погружаться. И наконец, типичные мембранные ферменты, если это термодинамически выгодно, могут вступать в контакты с органическим растворителем (рис. 18).
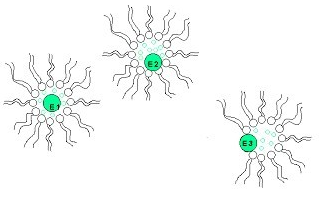
Рис 18. Схематическое изображение обращенной мицеллы, содержащей: гидрофильный (Е1), поверностно-активный (Е2) и гидрофобный (Е3) белок.
Одним из главных достоинств мицеллярных систем является возможность целенаправленного варьирования основных физико-химических параметров путем простого изменения соотношения компонентов системы (рис. 19.).
[Н2О] [ПАВ]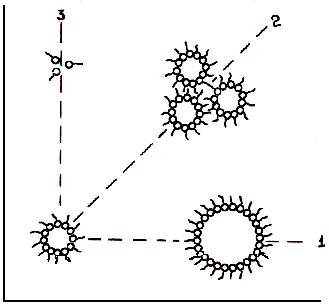
Рис. 19. Основные способы регуляции параметров системы обращенных мицелл. 1 - увеличение содержания воды при [ПАВ]=const: размеры мицелл растут, их число уменьшается; 2 – увеличение в одинаковой пропорции концентрации воды и [ПАВ]: размеры мицелл остаются неизменными, их число увеличивается; 3 – увеличение концентрации ПАВ при постоянной концентрации воды: размер мицелл уменьшается, их число растет.
Мицеллярный подход является в настоящее время классическим методом контроля олигомерного состава ферментов. Применение обращенных мицелл позволяет целенаправленным подбором размера мицеллярной матрицы (при варьировании степени гидратации системы) формировать желаемую надмолекулярную форму белка. Обращенные мицеллы можно рассматривать как своеобразный «наноконтейнер», позволяющий проводить как ассоциацию, так и диссоциацию белковых комплексов, получать надмолекулярные белковые структуры не реализующиеся в водных растворах. С точки зрения практического применения перспективным направлением является управляемая диссоциация «тел включения» и сворачивание ферментов в системе обращенных мицелл ПАВ. Проблема сворачивания рекомбинантных белков на сегодняшний день остается нерешенной для многих случаев. Особенно, эта проблема проявляется в случае больших, мульти-доменных и гидрофобных ферментов. Особенностью мицеллярного подхода является возможность изолировать молекулу фермента в отдельной мицелле, что с одной стороны, усиливает эффективность процесса сворачивания (подобно действию молекулярных шаперонов), а с другой стороны, защищает фермент от межмолекулярного взаимодействия, образования межмолекулярных S-S-связей и агрегации белка в процессе рефолдинга.
Образование конъюгатов биологически активных молекул с молекулями полиэтиленгликоля (ПЭГ). Применяется для стабилизации белок-содержащих лекарственных средств, увеличения времени циркуляции лекарств, транспорт лекарств, уменьшение иммунного ответа на введение чужеродных белков.
Лекарственные препараты белковой или пептидной структуры (интерфероны, гормоны, факторы роста, цитокины, тромболитики) все больше применяются в медицине. Как уже отмечалось, лечение нативными препаратами белковой природы имеет ряд существенных недостатков: белки быстро гидролизуются в гастроинтестинальном отделе пищеварительного тракта и поэтому используются, как правило, парентерально. Относительно короткий период "естественной" полужизни таких препаратов в организме пациента предусматривает их многократное использование для достижения требуемого терапевтического воздействия. Еще одним важным негативным фактором, ограничивающим применение нативных или рекомбинантных белковых препаратов, является их высокая иммуногенность и связанные с ней сенситивные реакции.
Одним из путей повышения эффективности лекарственных препаратов белковой структуры является "пегилирование" - химическая модификация белков полиспиртами, полиэтиленгликолем (ПЭГ) и блоксополимерами (пролиэтилен- и полипропиленгликоля), плюрониками и проксанолами.полиэтиленгликолем (ПЭГ). Подобная химическая модификация фармакологических препаратов белковой природы направлена на улучшение их переносимости, снижение иммуногенности, повышение периода их полужизни.
В настоящее время ПЭГ одобрен Управлением по питанию и лекарственным препаратам США (FDA) в качестве субстанции, разрешенной к использованию в медицине (производство лекарственных препаратов), продуктах питания и косметологии.
Для пегилирования белков применяется метод образования нековалентных аддуктов, образующихся в условиях инкубирования смеси белка и ПЭГ в условиях повышенного давления, а также ковалентная модификация по аминогруппам белка. При этом удобно использовать моноальдегидные производные полиспиртов, например:
ПЭГ (1) - СН3(ОСН2СН2)44ОСН2СНО;
ПЭГ (2) - СН3(ОСН2СН2)16ОСН2СНО;
Проксанол (1) - С4Н9[OCH(CH3)CH2]14(OCH2CH2)20OCH2CHO;
Проксанол (2) - С4Н9(OCH2CH2)20[OCH(CH3)CH2]14OCH(CH3)CHO.
Молекулы ПЭГ могут иметь различную молекулярную массу и стереохимическую структуру. Молекулярный вес молекул ПЭГ может колебаться в пределах 300 - 4000 Дальтон, а выстроенные в цепи макромолекулы ПЭГ могут формировать как разветвленную, так и линейную стереохимию. Именно масса ПЭГ и его стереохимическая структура, как правило, определяют принципиальные свойства будущего модифицированого белкового субстрата. В основном более длинные цепи ПЭГ обуславливают большую продолжительность периода полужизни коньюгата "ПЭГ - пептид" и его фармакологическую стабильность. Другим важным фактором, влияющим на фармакодинамику и фармакокинетику ПЭГ - модифицированных белков, является структура ПЭГ - цепочек: разветвленная молекула ПЭГ формирует замедление активного метаболизма препарата, что также влечет за собой удлинение времени активной циркуляции препарата. С разветвленной структурой цепочек ПЭГ связана также и значительно меньшая иммуногенность модифицированных препаратов при сохранении их основных фармакологических свойств. Подобные эффекты могут быть достигнуты и другим путем - связыванием пептида, например, не одной, а несколькими молекулами ПЭГ, имеющими при этом линейную структуру цепочек. Хорошо изученным примером в этой связи является молекула интерлейкина - 2 (ИЛ - 2). Так как молекула ИЛ - 2 очень мала, последняя свободно фильтруется через почки и имеет очень короткий период полужизни. Соединение ИЛ - 2 с ПЭГ, имеющей молекулярную массу менее 20 kDa, практически никак не влияет на фармакодинамику белка, но повышение молекулярной массы ПЭГ до 60 - 70 кДа уже значительно замедляет фильтрацию коньюгата "ПЭГ - ИЛ - 2" и увеличивает его время полужизни и биологическую доступность.
Одно из важнейших свойств модифицированных ПЭГ - молекул - высокая гидрофильность, формирующая принципиально новые физико-химические свойства модифицированного белка. При модификации белка молекулами ПЭГ происходит формирование "водного облака" вокруг модифицированной молекулы "ПЭГ - белок", за счет чего значительно повышается гидродинамический радиус коньюгата. Этот своеобразный "щит" воды вокруг модифицированной молекулы белка с одной стороны значительно повышает растворимость и биодоступность препарата, с другой - защищает молекулу от других белков (нейтрализующие антитела, комплемент). Таким образом ПЭГ - модифицированные пептиды значительно более защищены от опсонизации (взаимодействия с белками плазмы – опсонинами, которые "метят" чужеродные компоненты, делают их мишенями для клеток ретикулоэндотелиальной системы РЭС) и активного фаго- и эндоцитоза клеточных структур макроорганизма.
ПЭГ - модификация белковых препаратов, привнесла серьезные изменения в результаты лечения при таких заболеваниях, как ферментные дефициты, лейкемия, хронические воспалительные заболевания, онкология, хронические вирусные инфекции, кардиоваскулярная патология. Например Пегинтерферон альфа-2b применяется в противовирусной терапии, индуцирует подавление репликации вирусных ДНК или РНК, что и определило его широкое применение при лечении хронических вирусных гепатитов B и С. Данный препарат уже прошел все необходимые клинические испытания и зарегистрирован к применению во всех ведущих европейских странах (в том числе и России) и США под коммерческим названием ПегИнтрон. На рисунке 2. представлены профили фармакокинетики двух препаратов: нативного интерферна альфа-2b (Б) и пегилированного его коньюгата ПегИнтрона (А). Очевидно, что ПегИнтрон имеет значительно лучший биологический профиль, по сравнению со стандартным интерфероном альфа-2b; это выражается значительным повышением периода полужизни пегилированого аналога, снижением его иммуногенных свойств. Период "эффективной" полужизни препарата составляет в среднем около 40 часов! Для ПэгИнтрона характерен баланс между противовирусной активностью и длительным периодом полувыведения, позволяющим назначать препарат один раз в неделю, а также эффективно выводить метаболиты ПЭГ из организма.
А Б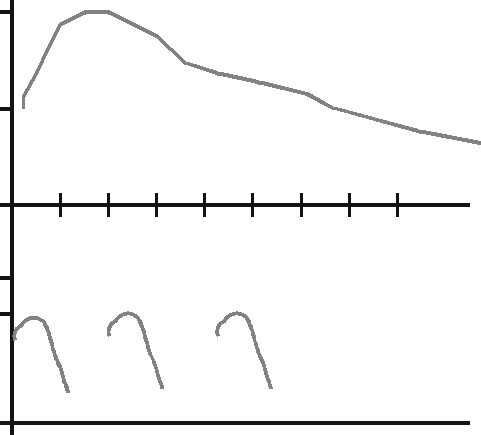
10 20 30 40 50 60 70 80 Время, часы
Рис. 19. Фармакокинетический профиль стандартного (Б) и пегилированного интерферона альфа-2b (А) (Из обзора И. Г. Никитин, Г.И. Сторожаков. 2001. Пегилированные лекарственные преапраты: современное состояние проблемы и перспективы. (www.hepatit.ru))
Таким образом, пегилирование лекарственных препаратов пептидной структуры имеет ряд весомых и несомненных преимуществ, которые ранее были просто невозможны при использовании нативных аналогов: усиление биологической активности, удлинение периода "эффективной" полужизни, замедление выведения, понижение токсичности и иммуногенности. К основным недостаткам ПЭГ - коньюгированных пептидов, используемых и в качестве уже разрешенных лекарственных форм, и в продолжающихся клинических испытаниях, можно отнести: возможное уменьшение активности белка, связанное с выбором "неправильного" размера или структуры ПЭГ; с этой же причиной может быть связано и возможное удлинение элиминации пептида. Так или иначе, полученные результаты уже проведенных и продолжающихся клинических испытаний с ПЭГ - модифицированными препаратами белковой структуры, а также экспериментальные данные свидетельствуют о явном преимуществе коньюгированных аналогов по сравнению с нативными белками.