1. Биосовместимые материалы для получения фермент-содержащих надмолекулярных систем, применяемых в биотехнологии и медицине.
Среди основных требований предъявляемых к носителям предназначенным для применения в биологии и медицине отметим следующие: (1) возможность синтезировать требуемые системы в мягких условиях; (2) возможность контролировать свойства синтезируемых систем (структуры, размера, гидродинамических свойств, прочности); (3) возможность включения целевых биомолекул в мягких условиях; (4) возможность придавать системам желаемые функциональные свойства (например, флуоресцентные или магнитные) путем включения в микро- (нано)капсулы или на их поверхность соответствующих компонентов (например, квантовых точек); (5) биосовместимость и биодеградируемость материалов; (6) стабильность.
Материалы, используемые в качестве носителей при иммобилизации биокатализаторов, чрезвычайно разнообразны. Это могут быть частицы на основе силикагеля, гидрооксида титана, циркония, железа и др., полимерные синтетические и природные материалы. Для синтеза оболочек при инкапсулировании биокатализаторов часто используются полиэлектролиты и полиэлектролитные пары поликатион-полианион. Химическая природа, молекулярный вес и структура полиэлектролитов входящих в состав оболочки капсул определяют свойства синтезируемых капсул, структуру, размер, проницаемость, прочность и др. Синтетические полимеры обладают рядом преимуществ: четко контролируемые свойства, высокая стабильность, химическая инертность.
Однако, при получении фермент-содержащих надмолекулярных систем предназначенных для применения в биологии и медицине в качестве носителей наиболее широко используются природные материалы: полиэлектролиты или полиэлектролитные пары природных полисахаридов, альгиновая кислота, каррагенан, пектин, хитозан; а также это могут быть белки, которые в силу своих амфотерных свойств в зависимости от рН могут являться как поликатионами, так и полианионами; для приготовления функциональных систем на основе липосом используются природные липиды – компоненты биомембран. Преимущество природных соединений перед синтетическими полимерами в том, что они биосовместимы, нетоксичны и биодеградируемы в физиологических условиях. Рассмотрим некоторые широко применяемые в биотехнологии и медицине полисахариды.
Альгинаты, соли альгиновой кислоты, широко используется для получения микро- и нанокапсул многих биоактивных молекул, ферментов, вакцин, инсулина и цитокинов. Альгинаты (соли альгиновых кислот) получают из бурых морских водорослей, они состоят из связанных 1.4-- связями остатков D-маннуроновой (рКа=3.38) и -L-гулуроновой (рКа=3.2) кислот. Альгинат образует гели с высокой степенью гидратации (высоким содержанием воды), высокой прочности, но относительно мягкой консистенции, что делает гидродинамические свойства геля близки по своим характеристикам к природным тканям. Гель на основе альгината образуется в мягких условиях при комнатной температуре без добавления органических растворителей, гель биодеградируем в физиологических условиях. Уникальные свойства альгината делают его одним из основных белковых носителей для доставки лекарств в организме.
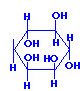
Пектин. Среди природных полисахаридов, содержащих отрицательно заряженные группы, помимо альгината широко распространенным является пектин, который используется в качестве гелеобразующего и влагоудерживающего агента, а также в качестве загустителя в пищевой и фармацевтической промышленности. Пектин выделяют из клеточных стенок растений, например, из лимонной кожуры. Пектин представляет собой линейный полимер α-галактуроновой кислоты, в котором часть карбоксильных групп находится в метоксилированном состоянии (рис. 1.). Молекулярный вес пектинов обычно находится в интервале 100-1000 кДа. Различают высоко-метоксилированный пектин, в котором степень метоксилирования более 50%, и низко-метоксилированный пектин, в котором степень метоксилирования соответственно меньше 50%.

Рис. 1. Структурная формула низкометоксилированного пектина.
Взаимодействие пектина с белками лежит в основе его многочисленных практических применениях, в основном для гелеобразования и стабилизации пен и эмульсий в производстве лекарственных средств, пищевых добавок и в пищевой промышленности. Классическим примером является использование пектина для стабилизации казеин-содержащих мицелл в кисломолочных напитках. Благодаря электростатическому взаимодействию отрицательно заряженных групп пектина с положительно заряженными аминогруппами казеина, молекулы пектина адсорбируются на казеиновых мицеллах, тем самым, предотвращая агрегацию в кислых средах.
Свойства комплексов белков с анионными полисахаридами (в частности, пектином), применяющихся для стабилизации пищевых коллоидных систем, пен и эмульсий, интенсивно изучаются в связи с открывающимися перспективами промышленного применения. Так, для смеси молочных белков, и некоторых других глобулярных белков было установлено, что в присутствие пектина система может находиться в четырех различных состояниях в зависимости от рН, ионной силы и соотношения компонентов. При нейтральных значениях рН пектин отрицательно заряжен, и хотя общий заряд белков также отрицателен, имеет место взаимодействие положительно заряженных аминогрупп групп белков с карбоксильными группами полисахарида. В таких условиях образуется гомогенная система, состоящая из расторимых белок-полисахаридных комплексов находящихся в равновесии со свободными компонентами (1). При снижении значения рН до изоэлектрической точки белка и ниже образуется растворимый белок-полисахаридный комплекс (2). В частности, в случае β-лактоглобулина растворимый комплекс с пектином образуется при значениях рН 4-5. Дальнейшее снижение значения рН приводит к снижению общего отрицательного заряда комплекса. Наблюдается образование двухфазной системы, состоящей из нерастворимого комплекса, в котором большая часть зарядов ПЭ компенсирована, за счет взаимодействия с белком (образуется белок-ПЭ комплекс «стехиометрического» состава) и водной фазы, в которой растворен избыток полисахарида (3). При значениях рН ниже рКа полисахарида происходит протонирование карбоксильных групп пектина и комплексообразования не наблюдается (4). Таким образом, в случае белок-полисахаридных комплексов, варьирование параметров среды позволяет в широких пределах изменять состояние системы, переходить от гомогенных водных растворов к гетерогенным системам, формировать комплексы различной структуры, и размеров. На этом основано все возрастающее применение пектина и других природных полисахаридов в пищевой и косметической промышленности, в производстве пищевых добавок и лекарственных средств.
Аравийская камедь. Аравийская камедь - натуральный гидроколлоидный полисахарид. В ее состав входят арабин (кальциевые, калиевые, магниевые соли арабиновой кислоты), глюкуроновая кислота, гиалуроновая кислота, ксилоза, галактоза растворяется в воде с образованием геля. Гуммиарабик отборный, белый, Gummi arabicum electum, albissimum, употребляется в медицине как средство для похудения, замедляет прохождение пищи по кишечнику, уменьшает всасывание холестерина и жиров, лекарства на основе аравийской камеди обладают смягчающим, болеутоляющим, заживляющим действием. Аравийская камедь - противоожоговое средство для кожи, слизистых дыхательных путей и ЖКТ. Может использоваться как основное лекарственное средство, а также как компонент для инкапсулирования и доставки лекарств.
Для иллюстрации практического применения аравийской камеди в пищевой промышленности приведем инкапсулирование капель подсолнечного масла, а также масел лимона и апельсина с использованием комплексов молочных белков с аравийской камедью. Полученные капсулы включались в сыр Гауда в качестве натуральных вкусовых добавок, а также использовались для изменения текстурных свойств сыра. Последние варьировали размером капель масла и составом капсул.
Хитозан. Одним из наиболее распространенных и широко используемым аминополисахаридом является хитозан. Хитозан является деацилированным (частично или полностью) производным хитина, линейного полисахарида, построенного из остатков N – ацетил - - D – глюкозамина с 14 – связями между ними (рис. 2).
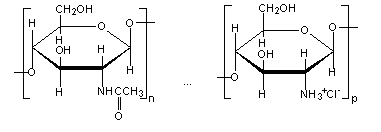
Рис. 2. Структурная формула хитозана.
Деацилированные производные хитина, хитозаны, существуют в природе, а также их получают путем химической обработки хитина. Молекулярная масса хитозана в зависимости от источника и способа выделения составляет 0.5 – 8*105 Да. Физико-химические свойства и микробиологическая активность хитозана определяются молекулярным весом и степенью деацилирования. Данные факторы влияют на растворимость полисахарида, вязкость полученных растворов и взаимодействие с клеточными стенками микроорганизмов. Хитозан нерастворим в воде при нейтральных значениях рН, но растворяется в разбавленных органических кислотах, например в водном растворе уксусной кислоты с образованием солей, дающих высоковязкие растворы. Некоторые N – ацилпроизводные хитозана – хорошие гелеобразователи; при ацилирование хитозана производными дикарбоновых кислот получают поперечносшитые гели, удобные для получения ферментсодержащих систем. На примере ряда ферментов: липазы, целлюлазы, щелочной протеазы, L–аспарагиназы и др. было установлено, что в результате их иммобилизации на хитозане существенно увеличивается термостабильность ферментов. В ряде случаев наблюдается увеличение каталитической активности ферментов. Ферменты могут быть иммобилизованы на хитозане, используя как амино- так и гидроксильные группы, такую иммобилизацию называют “двойной иммобилизацией”. Сначала образуется связь между аминогруппой и глутаровым альдегидом, а затем между гидроксильной группой и карбодиимидом (рис. 3.). “Двойная иммобилизация” приводит к дополнительной стабилизации фермента.
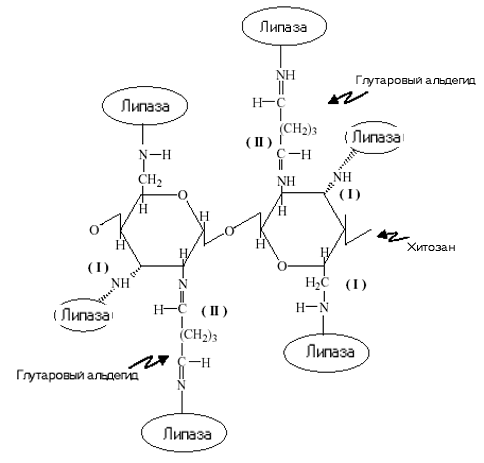
Рис. 3. Иммобилизация липазы на хитозане.
Важным свойством хитозана является его способность образовывать прочные нековалентные комплексы с белками, анионными полисахаридами, а также, хелатные комплексы с металлами, на чем основано его применение в качестве материала для инкапсулирования биомолекул при изготовлении медицинских препаратов; для удаления белка из сточных вод в производстве пищевых продуктов (мясная, рыбная, молочная промышленность, сыроделие), создания хелатирующих ионнонообмеников, иммобилизации живых клеток в биотехнологии, а также при изготовлении медицинских препаратов.
Липидные носители. Липосомы находят широкое применение в качестве наноносителей для ферментов и лекарственных препаратов, что обусловлено главным образом близостью свойств липидных носителей и природных биомембран.
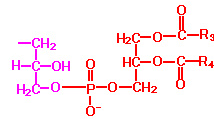
По своей природе входящие в состав биологических мембран липиды можно разделить на три класса: фосфолипиды, гликолипиды и нейтральные липиды, основным представителем которых является холестерин. Структурные формулы основных представителей каждого класса представлены в таблице 1.
Таблица 1. Структурные формулы основных липидов биомембран.
|
КЛАСС |
СТРУКТУРНАЯ ФОРМУЛА |
ОСНОВНЫЕ ПРЕДСТАВИТЕЛИ КЛАССА |
|
Фосфолипиды |
Х R1 и R2 – остатки жирных кислот |
|
|
X:
|
Фосфатидилхолин (ФХ) |
|
|
X:
|
Фосфатидилэтаноламин (ФЭ) |
|
|
X:
|
Фосфатидилсерин (ФС) |
|
|
X:
|
Фосфатидилинозит (ФИ) |
|
|
X:
|
Кардиолипин |
|
|
Гликолипиды |
|
|
|
Y: Н |
Цереброзиды |
|
|
Y: SO3H |
Сульфатиды |
|
|
Нейтральные липиды |
|
Холестерин |
Фосфолипиды составляют мажорную часть липидов биомембран. Фосфолипиды со сравнительно длинными углеводородными цепями (18-22 углеродных атома) и большим количеством ненасыщенных связей представляют собой “жидкие” липиды. Температура фазовых переходов таких липидов в биомембранах лежит значительно ниже температуры организма, что необходимо для осуществления в мембранах быстропротекающих процессов.
Фазовые переходы в мембранах играют важную роль в протекании не только транспортных процессов, но и функционировании мембранных ферментов и ферментных комплексов. Здесь идет речь о регуляции ферментативной активности при фазовом переходе, т.н. вязкотропной регуляции. Механизм вязкотропной регуляции рассматривает в качестве регулирующего фактора не только фазовое состояние, но и плотность упаковки липидов в мембране, которая определяется насыщенностью и длинной углеводородной цепи. Фосфолипидным составом определяется также проницаемость мембран.
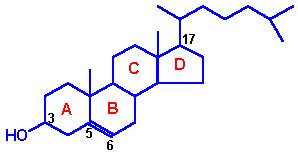
Важную роль в регуляции биопроцессов играет холестерин. Не будет большим преувеличением, если сказать, что любое нарушение функционального состояния организма сопровождается изменением уровня холестерина в крови.
Молекула холестерина отличается уникальным по сравнению с другими липидными компонентами мембран сочетанием структурных особенностей. Она имеет: жесткий углеводородный скелет, который, как правило, трудно разрушается ферментными системами организма; наличие в структуре в целом гидрофобной молекулы гидроксильной спиртовой группы, благодаря чему молекула холестерина легко может проникать в мембрану. Кроме того, холестерин обладает способностью образовывать многочисленные молекулярные соединения с белками, аминами, глюкозой и другими углеводами, желчными и жирными кислотами, неорганическими солями (CaCl2, MgCl2, ZnCl2 и др.). Холестерин образует молекулярные комплексы и с различными фосфолипидами мембран. Включаясь в мембраны, холестерин делает их структуру более жесткой, уменьшая подвижность как в модельных, так и в естественных мембранах. При включении холестерина в мембранах происходит повышение температуры и скорости фазовых переходов липидов. В присутствии холестерина значительно понижается проницаемость мембран для воды, катионов, различных неэлектролитов и других соединений.
Для приготовления липосом наиболее часто используются мембранные фосфолипиды: Фосфатидилхолин (ФХ), Фосфатидилэтаноламин (ФЭ), Фосфатидилсерин (ФС), Кардиолипин, а также часто используют смеси липидов. Размер, форма и биологические свойства липосом определяются и регулируются липидным составом, способом и условиями приготовления липосом.

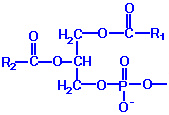
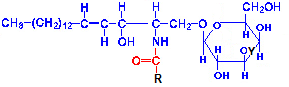 R
– остаток жирной кислоты
R
– остаток жирной кислоты