
- •Конспект лекций по физике
- •Раздел 2 Молекулярная физика и термодинамика
- •Основы молекулярно-кинетической теории. Термодинамика
- •Основы молекулярно-кинетической теории. Основные положения молекулярно-кинетической теории. Сила и энергия взаимодействия молекул. Шкалы измерения температуры
- •Сила и энергия взаимодействия молекул
- •Контрольные вопросы:
- •Идеальный газ. Давление газа. Основное уравнение молекулярно-кинетической теории идеального газа
- •Контрольные вопросы:
- •Зависимость давления газа от температуры при постоянном объеме. Температура как мера средней кинетической энергии движения молекул
- •Связь между абсолютной температурой и кинетической энергией поступательного движения молекул
- •Контрольные вопросы:
- •Уравнение Клапейрона - Менделеева. Закон Дальтона
- •Количество молекул в 1 моле любого вещества одинаково и называется числом Авогадро:
- •2. 1 Моль любого газа при нормальных условиях занимает объём 22,4 дм3. (закон Авогадро).
- •Контрольные вопросы:
- •Изопроцессы и их графики
- •Контрольные вопросы:
- •Выберете правильный ответ на поставленный вопрос
- •Закон Максвелла о распределении молекул идеального газа по скорости и энергии теплового движения
- •Контрольные вопросы:
- •Барометрическая формула. Распределение Больцмана
- •Контрольные вопросы:
- •Реальные газы. Уравнение Ван-дер-Ваальса
- •Изотермы Ван-дер-Ваальса и их анализ. Критическое состояние вещества
- •Контрольные вопросы:
- •Среднее число столкновений и средняя длина свободного пробега молекул
- •Контрольные вопросы:
- •Выберите правильный ответ на поставленный вопрос
- •Основы термодинамики Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы
- •Изменение внутренней энергии тела в процессе теплообмена и совершения работы. Уравнение теплового баланса
- •Уравнение теплового баланса
- •Контрольные вопросы:
- •Первое начало термодинамики. Адиабатный процесс
- •Контрольные вопросы:
- •Выберите правильный ответ на поставленный вопрос
- •Работа газа. Круговой процесс. Кпд кругового процесса Работа газа при изменении объема
- •Контрольные вопросы:
- •Принцип действия тепловой машины. Цикл Карно
- •Кпд тепловой машины
- •Контрольные вопросы:
- •Необратимые процессы. Понятие о втором начале термодинамики
- •Контрольные вопросы:
- •Явления переноса в термодинамически неравновесных системах
- •Контрольные вопросы:
- •Выберите правильный ответ на поставленные вопросы:
- •Агрегатные состояния вещества и фазовые переходы
- •Свойства паров. Влажность воздуха. Способы определения влажности воздуха. Парообразование
- •Влажность воздуха. Точка росы. Способы определения влажности
- •Приборы для определения влажности воздуха
- •Контрольные вопросы:
- •Кипение.
- •Контрольные вопросы:
- •Характеристика жидкого состояния вещества.
- •Молекулярное давление поверхностного слоя жидкости
- •Энергия поверхностного слоя жидкости.
- •Поверхностное натяжение
- •Смачивание
- •Капиллярность
- •Контрольные вопросы:
- •Кристаллическое состояние вещества. Типы связей в кристаллах, виды кристаллических структур
- •Полиморфизм
- •Применение кристаллов
- •Жидкие кристаллы
- •Контрольные вопросы:
- •Механические свойства твердых тел
- •Закон Гука. Модуль упругости
- •Диаграмма растяжения твердого тела
- •Контрольные вопросы:
- •Тепловое расширение твердых тел.
- •Плавление и кристаллизация. Диаграмма фазовых состояний
- •Контрольные вопросы:
Барометрическая формула. Распределение Больцмана
При выводе основного уравнения молекулярно-кинетической теории газов и распределения Максвелла молекул по скоростям предполагалось, что молекулы распределены равномерно по объему. Однако молекулы газа находятся в поле тяготения Земли, что приводит к убыванию давления с увеличением высоты.
Если атмосферное давление на высоте h
равно р (рисунок 9), то на высоте
![]() давление равно
давление равно
![]() (при dh0
и dh0).
(при dh0
и dh0).
Разность давлений р и р + dp равна весу
газа, заключенного в цилиндре высотой
dh с основанием 1м![]() :
:
p – (p - dp)=
g
dh, где
![]() - плотность газа на высоте h.
- плотность газа на высоте h.
![]() .
.
Из уравнения Клапейрона-Менделеева
![]() следует, что плотность газа
следует, что плотность газа
![]() :
:
![]()

![]() , или
, или
![]()
 или:
или:
![]() ,
,
Рисунок 9. Зависимость атмосферного
давления от высоты
![]()
где е=2,72 – основание натурального логарифма.
Это выражение называется барометрической
формулой. Она позволяет найти
атмосферное давление р на любой высоте
h:
![]() ,
где
,
где
![]() – атмосферное давление на уровне моря.
Прибор альтиметр (или высотомер)
использует последнюю формулу для
определения высоты.
– атмосферное давление на уровне моря.
Прибор альтиметр (или высотомер)
использует последнюю формулу для
определения высоты.
Используя выражения
![]() ;
;
![]() ,
где n – концентрация
молекул на высоте h, а
,
где n – концентрация
молекул на высоте h, а
![]() – масса одной молекулы и учитывая, что
– масса одной молекулы и учитывая, что
![]() - потенциальная энергия одной молекулы
в поле тяготения и
- потенциальная энергия одной молекулы
в поле тяготения и
![]() ,
получим:
,
получим:
 - распределение Больцмана для внешнего
потенциального поля.
- распределение Больцмана для внешнего
потенциального поля.
Здесь n - концентрация молекул на высоте h, n0 – концентрация молекул на высоте h = 0.
При постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул.
Контрольные вопросы:
-
Приведите барометрическую формулу и поясните, какие параметры определяют давление на высоте h.
-
Как вычислить концентрацию молекул на высоте h?
Реальные газы. Уравнение Ван-дер-Ваальса
Голландский ученый И. Ван-дер-Ваальс вывел уравнение состояния реального газа, учитывающее собственный объем молекул и силы межмолекулярного взаимодействия. Ван-дер-Ваальсом в уравнение Клапейрона - Менделеева введены две поправки.
Учет собственного объема молекул. Фактический свободный объем, в котором могут двигаться молекулы реального газа не Vm, а (Vm - b), где b – объем, занимаемый самими молекулами, Vm – молярный объем. Объем b равен учетверенному собственному объему молекул.
Учет притяжения молекул.
Действие сил притяжения молекул газа
приводит к появлению дополнительного
давления газа, называемого внутренним
давлением:
![]() ,
где a - постоянная
Ван-дер-Ваальса, характеризующая силы
межмолекулярного притяжения.
,
где a - постоянная
Ван-дер-Ваальса, характеризующая силы
межмолекулярного притяжения.
Вводя эти поправки, получим уравнение
Ван-дер-Ваальса для 1 моль газа
(уравнение состояния реальных газов).
![]()
Для произвольного количества вещества
(газа) g
![]() с учетом того, что
с учетом того, что
![]() уравнение Ван-дер-Ваальса:
уравнение Ван-дер-Ваальса:
![]() ,
где
,
где
a и b – постоянные величины, различные для каждого из газов. Они определяются опытным путем.
При выводе уравнения Ван-дер-Ваальса сделан целый ряд упрощений, поэтому оно тоже весьма приближенно согласуется с опытом.
Изотермы Ван-дер-Ваальса и их анализ. Критическое состояние вещества
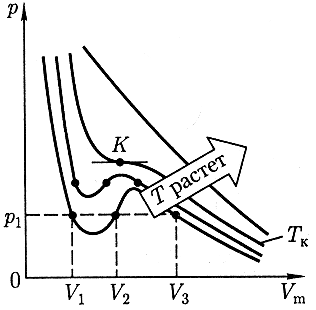
Рассмотрим изотермы Ван-дер-Ваальса для одного моль газа (рисунок 11).
При высоких температурах Т
![]() изотерма реального газа мало отличается
от изотермы идеального газа. При некоторой
критической температуре
изотерма реального газа мало отличается
от изотермы идеального газа. При некоторой
критической температуре
![]() на изотерме есть только одна точка
перегиба К. Эта изотерма называется
критической, а точка перегиба К –
критической точкой. Соответствующие
этой точке объем
на изотерме есть только одна точка
перегиба К. Эта изотерма называется
критической, а точка перегиба К –
критической точкой. Соответствующие
этой точке объем
![]() и давление
и давление
![]() называются критическими. Состояние
вещества с параметрами
называются критическими. Состояние
вещества с параметрами
![]() ,
,
![]() и
и
![]() называется критическим состоянием.
называется критическим состоянием.
Критическое состояние вещества. Если нагревать жидкость в герметически закрытом сосуде, то вследствие расширения жидкости ее плотность будет уменьшаться, а плотность пара будет увеличиваться. Различие между жидкостью и ее насыщающим паром будет сглаживаться и при некоторой температуре должно исчезнуть (рисунок 10). Эта температура называется критической температурой.
Критической температурой (![]() )
вещества называется такая температура,
при которой плотность жидкости и
плотность насыщающего ее пара становятся
одинаковыми (рисунок 10).
)
вещества называется такая температура,
при которой плотность жидкости и
плотность насыщающего ее пара становятся
одинаковыми (рисунок 10).

Рисунок 10. Зависимость плотности воды и насыщенного водяного пара от температуры и зависимость давления от температуры.
Давление насыщенного пара при его
критической температуре называется
критическим давлением
![]() .
Если вещество находится при критической
температуре и критическом давлении, то
его состояние называется критическим
состоянием. Объем вещества в критическом
состоянии называется критическим
объемом
.
Если вещество находится при критической
температуре и критическом давлении, то
его состояние называется критическим
состоянием. Объем вещества в критическом
состоянии называется критическим
объемом
![]() .
.
При температуре выше критической вещество при любом давлении может существовать только в газообразном состоянии.
Если P > Pк, а t < tК, то вещество находится в жидком состоянии.
При
![]() изотермы имеют волнообразный характер.
Они являются следствием преобразования
уравнения Ван-дер-Ваальса к виду:
изотермы имеют волнообразный характер.
Они являются следствием преобразования
уравнения Ван-дер-Ваальса к виду:
![]()
Это уравнение третьей степени может иметь либо три вещественных корня, либо один вещественный корень.
Рисунок 11. Изотермы
Ван-дер-Ваальса для одного моль газа
Р
Рисунок 12. Изотерма Ван-дер-Ваальса
![]() (рисунок
12), можно заметить, что на участках 1-3 и
5-7 при уменьшении объема давление растет,
что естественно. Участка 3-5 в природе
не существует. Наличие участка 3-5
означает, что при изменении объема
вещество не может оставаться в виде
(рисунок
12), можно заметить, что на участках 1-3 и
5-7 при уменьшении объема давление растет,
что естественно. Участка 3-5 в природе
не существует. Наличие участка 3-5
означает, что при изменении объема
вещество не может оставаться в виде
однородной среды и должен наступить скачкообразный распад вещества на две фазы. Истинная изотерма будет иметь вид ломаной линии 7-6-4-2-1.
Участок 7-6 соответствует газообразному состоянию, а участок 2-1 – жидкому. На участке 6-2 наблюдается равновесие жидкой и газообразной фаз вещества. На участке 5-6 вещество находится в состоянии пересыщенного пара. Эти выводы были подтверждены экспериментально ирландским физиком Эндрюсом.
Решая уравнение Ван-дер-Ваальса, можно
найти значение критических параметров:![]()
![]()
![]() .
.
Если через крайние точки 2 и 6 горизонтальных участков семейства изотерм (рисунок 11) провести линии, то получится колоколообразная кривая диаграммы состояний (рисунок 13), ограничивающая область двухфазных состояний вещества. Под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее – жидкое состояние (Ж), а справа – область пара (П). Пар отличается от газа (Г) тем, что при изотермическом сжатии пар сжижается, а газ не сжижается. Точка К – критическая точка.

Рисунок 13. Диаграмма состояний
