
- •Конспект лекций по физике
- •Раздел 2 Молекулярная физика и термодинамика
- •Основы молекулярно-кинетической теории. Термодинамика
- •Основы молекулярно-кинетической теории. Основные положения молекулярно-кинетической теории. Сила и энергия взаимодействия молекул. Шкалы измерения температуры
- •Сила и энергия взаимодействия молекул
- •Контрольные вопросы:
- •Идеальный газ. Давление газа. Основное уравнение молекулярно-кинетической теории идеального газа
- •Контрольные вопросы:
- •Зависимость давления газа от температуры при постоянном объеме. Температура как мера средней кинетической энергии движения молекул
- •Связь между абсолютной температурой и кинетической энергией поступательного движения молекул
- •Контрольные вопросы:
- •Уравнение Клапейрона - Менделеева. Закон Дальтона
- •Количество молекул в 1 моле любого вещества одинаково и называется числом Авогадро:
- •2. 1 Моль любого газа при нормальных условиях занимает объём 22,4 дм3. (закон Авогадро).
- •Контрольные вопросы:
- •Изопроцессы и их графики
- •Контрольные вопросы:
- •Выберете правильный ответ на поставленный вопрос
- •Закон Максвелла о распределении молекул идеального газа по скорости и энергии теплового движения
- •Контрольные вопросы:
- •Барометрическая формула. Распределение Больцмана
- •Контрольные вопросы:
- •Реальные газы. Уравнение Ван-дер-Ваальса
- •Изотермы Ван-дер-Ваальса и их анализ. Критическое состояние вещества
- •Контрольные вопросы:
- •Среднее число столкновений и средняя длина свободного пробега молекул
- •Контрольные вопросы:
- •Выберите правильный ответ на поставленный вопрос
- •Основы термодинамики Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы
- •Изменение внутренней энергии тела в процессе теплообмена и совершения работы. Уравнение теплового баланса
- •Уравнение теплового баланса
- •Контрольные вопросы:
- •Первое начало термодинамики. Адиабатный процесс
- •Контрольные вопросы:
- •Выберите правильный ответ на поставленный вопрос
- •Работа газа. Круговой процесс. Кпд кругового процесса Работа газа при изменении объема
- •Контрольные вопросы:
- •Принцип действия тепловой машины. Цикл Карно
- •Кпд тепловой машины
- •Контрольные вопросы:
- •Необратимые процессы. Понятие о втором начале термодинамики
- •Контрольные вопросы:
- •Явления переноса в термодинамически неравновесных системах
- •Контрольные вопросы:
- •Выберите правильный ответ на поставленные вопросы:
- •Агрегатные состояния вещества и фазовые переходы
- •Свойства паров. Влажность воздуха. Способы определения влажности воздуха. Парообразование
- •Влажность воздуха. Точка росы. Способы определения влажности
- •Приборы для определения влажности воздуха
- •Контрольные вопросы:
- •Кипение.
- •Контрольные вопросы:
- •Характеристика жидкого состояния вещества.
- •Молекулярное давление поверхностного слоя жидкости
- •Энергия поверхностного слоя жидкости.
- •Поверхностное натяжение
- •Смачивание
- •Капиллярность
- •Контрольные вопросы:
- •Кристаллическое состояние вещества. Типы связей в кристаллах, виды кристаллических структур
- •Полиморфизм
- •Применение кристаллов
- •Жидкие кристаллы
- •Контрольные вопросы:
- •Механические свойства твердых тел
- •Закон Гука. Модуль упругости
- •Диаграмма растяжения твердого тела
- •Контрольные вопросы:
- •Тепловое расширение твердых тел.
- •Плавление и кристаллизация. Диаграмма фазовых состояний
- •Контрольные вопросы:
Сила и энергия взаимодействия молекул
При рассмотрении реальных газов
следует учитывать силы межмолекулярного
взаимодействия. Они появляются на
расстоянии, меньшем, чем 10-9м. Между
молекулами вещества одновременно
действует силы притяжения
![]() и силы отталкивания
и силы отталкивания
![]() (см. рисунок 1а). Силы отталкивания
(см. рисунок 1а). Силы отталкивания
![]() положительные,
а силы притяжения
положительные,
а силы притяжения
![]() –
отрицательные. Результирующая сила
–
отрицательные. Результирующая сила
![]() этих двух сил является силой отталкивания
на участке от 0 до
этих двух сил является силой отталкивания
на участке от 0 до
![]() и силой притяжения при 10-9м>
и силой притяжения при 10-9м>
![]() >
>
![]() .
При расстоянии
.
При расстоянии
![]() =
=
![]() равнодействующая сила
равнодействующая сила
![]() =0.
Таким образом, расстояние
=0.
Таким образом, расстояние
![]() соответствует устойчивому состоянию
молекулы. На этом расстоянии и находились
бы молекулы в отсутствие теплового
движения. На расстоянии
соответствует устойчивому состоянию
молекулы. На этом расстоянии и находились
бы молекулы в отсутствие теплового
движения. На расстоянии
![]() >10-9м
межмолекулярные силы также практически
отсутствуют.
>10-9м
межмолекулярные силы также практически
отсутствуют.
Элементарная работа
![]() силы
силы
![]() при увеличении расстояния между
молекулами на
при увеличении расстояния между
молекулами на
![]() совершается за счет уменьшения взаимной
потенциальной энергии молекул:
совершается за счет уменьшения взаимной
потенциальной энергии молекул: ![]() .
.
При
![]() >10-9м
силы отсутствуют и потенциальная энергия
равна 0. взаимодействия молекул (см.
рисунок 1б).
>10-9м
силы отсутствуют и потенциальная энергия
равна 0. взаимодействия молекул (см.
рисунок 1б).
П ри
сближении молекул на расстояние меньшее
чем 10-9м, появляется сила притяжения
(
ри
сближении молекул на расстояние меньшее
чем 10-9м, появляется сила притяжения
(![]() <0),
которая совершает положительную работу
(
<0),
которая совершает положительную работу
(![]() >0).
Поэтому потенциальная энергия уменьшается,
достигая минимума
>0).
Поэтому потенциальная энергия уменьшается,
достигая минимума
![]() при расстоянии
при расстоянии
![]() =
=
![]() .
.
![]() определяет работу, которую нужно
совершить против сил притяжения чтобы
разъединить молекулы.
определяет работу, которую нужно
совершить против сил притяжения чтобы
разъединить молекулы.
При расстоянии
![]() <
<![]() действуют силы отталкивания и совершаемая
против них работа отрицательна (
действуют силы отталкивания и совершаемая
против них работа отрицательна (![]() <0).
Потенциальная энергия начинает резко
возрастать. Таким образом, система из
двух молекул в состоянии устойчивого
равновесия
<0).
Потенциальная энергия начинает резко
возрастать. Таким образом, система из
двух молекул в состоянии устойчивого
равновесия
Рисунок 1. Силы и энергия взаимодействия молекул
(при
![]() =
=![]() )
обладает минимальной потенциальной
энергией
)
обладает минимальной потенциальной
энергией
![]() (потенциальной ямой).
(потенциальной ямой).
Критерием различных агрегатных
состояний вещества является соотношение
![]() и произведением
и произведением
![]() ,
где коэффициент
,
где коэффициент
![]() – постоянная Больцмана (
– постоянная Больцмана (![]() =1,38
=1,38![]() ),
),
![]() - абсолютная температура.
- абсолютная температура.
Произведение
![]() определяет удвоенную среднюю энергию,
приходящуюся на одну степень свободы
теплового движения молекулы.
определяет удвоенную среднюю энергию,
приходящуюся на одну степень свободы
теплового движения молекулы.
Если
![]() <<
<<![]() ,
то вещество находится в газообразном
состоянии.
,
то вещество находится в газообразном
состоянии.
Если
![]() >>
>>![]() ,
то вещество находится в твердом состоянии.
,
то вещество находится в твердом состоянии.
Если
![]() »
»![]() ,
то вещество находится в жидком состоянии,
т.к. в результате теплового движения
молекулы перемещаются в пространстве,
обмениваясь местами, но, не расходясь
на расстояние, превышающее r0.
,
то вещество находится в жидком состоянии,
т.к. в результате теплового движения
молекулы перемещаются в пространстве,
обмениваясь местами, но, не расходясь
на расстояние, превышающее r0.
Внутренняя энергия тела
является суммой
кинетической энергии всех его молекул
![]() и потенциальной энергии их взаимодействия.
и потенциальной энергии их взаимодействия.
Контрольные вопросы:
-
Изложите основные положения молекулярно-кинетической теории.
-
Что такое температура, и какие температурные шкалы Вам известны?
-
Что такое диффузия? Приведите примеры диффузии в газах, жидкостях и твердых телах.
-
Расскажите о силе взаимодействия молекул.
-
Расскажите о кинетической и потенциальной энергии молекул.
Идеальный газ. Давление газа. Основное уравнение молекулярно-кинетической теории идеального газа
Для упрощения рассмотрения процессов в газах можно пренебречь взаимодействием молекул газа, т.к. оно не оказывает существенного влияния на поведение молекул. Немецкий физик Клаузиус ввел понятие идеального газа, в котором:
-
Объемом всех молекул газа можно пренебречь по сравнению с объемом сосуда, в котором этот газ находится.
-
Время столкновения молекул друг с другом пренебрежимо мало по сравнению со временем между двумя столкновениями (т.е. со временем свободного пробега молекул).
-
Молекулы взаимодействуют между собой только при непосредственном соприкосновении, при этом они отталкиваются.
-
Силы притяжения между молекулами идеального газа ничтожно малы, и ими можно пренебречь.
Реальный газ при нормальном давлении очень близок по свойствам к идеальному газу. Значительное повышение давления газа приводит к существенному уменьшению среднего расстояния между молекулами и поэтому реальный газ уже нельзя считать идеальным. Так при давлении 500 МПа объем молекул составит половину занимаемого газом объема.
Давление газа.
Молекулы газа, ударяясь о поверхность
тела (например, о стенку сосуда), оказывают
на нее давление. Давление
![]() ,
где
,
где
![]() – сила давления,
– сила давления,
![]() – площадь поверхности тела.
– площадь поверхности тела.
Единица измерения давления в системе СИ:
![]()
Существуют и другие единицы измерения давления. Наиболее распространенными из них являются атмосфера и миллиметр ртутного столба.
Техническая атмосфера
- давление, оказываемое силой 1 кгс на
площадь 1
![]() .
1
.
1![]() .
.
Миллиметр ртутного столба
(![]() )
– это давление, оказываемое столбом
ртути высотой 1мм. на горизонтальную
поверхность. Давление внутри жидкости
на глубине h:
)
– это давление, оказываемое столбом
ртути высотой 1мм. на горизонтальную
поверхность. Давление внутри жидкости
на глубине h:
![]() .
1мм.рт.ст. =
.
1мм.рт.ст. =
![]() =133
Па
=133
Па
Прибор для измерения давления
называется манометром.
![]()
О
Рисунок 2. Движение
молекулы массой
![]() со скоростью
со скоростью
![]()
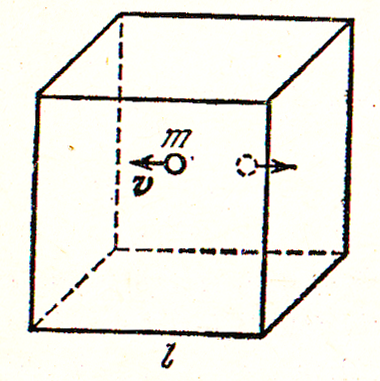
![]() (рисунок 2). В каждой единице объема куба
содержится
(рисунок 2). В каждой единице объема куба
содержится
![]() одинаковых молекул
газа. Общее число молекул в кубе
одинаковых молекул
газа. Общее число молекул в кубе
![]() .
Будем считать удары молекул о стенки
сосудов абсолютно упругими. Каждая
молекула обладает количеством движения
(импульсом) p=
.
Будем считать удары молекул о стенки
сосудов абсолютно упругими. Каждая
молекула обладает количеством движения
(импульсом) p=![]() ,
где
,
где
![]() - масса молекулы, а
- масса молекулы, а
![]() - скорость её движения. В процессе удара
импульс меняется на величину
- скорость её движения. В процессе удара
импульс меняется на величину
![]() 2
2![]() ,
и, следовательно, стенка получает импульс
силы
,
и, следовательно, стенка получает импульс
силы
![]() =2
=2![]() .
.
Средняя сила воздействия одной
молекулы на стенку равна:
![]() ,
где
,
где
![]() - время движения молекулы от одной стенки
к другой и обратно.
- время движения молекулы от одной стенки
к другой и обратно.
![]() .
.
Отсюда:
![]() .
.
Сила давления газа на стенку куба равна
сумме сил ударов
![]() отдельных молекул об эту стенку:
отдельных молекул об эту стенку:
![]() .
.
Величина
![]() - называется среднеквадратической
скоростью
- называется среднеквадратической
скоростью![]() .
.
Отсюда:![]() =
=![]() и
и
![]()
![]() где:
где:
![]() — число молекул, летающих между двумя
противоположными стенками куба. Поскольку
в кубе три пары таких стенок, то в одном
из трех взаимно перпендикулярных
направлений движется
— число молекул, летающих между двумя
противоположными стенками куба. Поскольку
в кубе три пары таких стенок, то в одном
из трех взаимно перпендикулярных
направлений движется
![]() общего
числа молекул.
общего
числа молекул.
Отсюда:
![]() и тогда:
и тогда:
![]()
Поскольку: ![]() ,
а средняя кинетическая энергия
поступательного движения молекулы
,
а средняя кинетическая энергия
поступательного движения молекулы
![]()
![]() ,
отсюда: - - основное
уравнение молекулярно-кинетической
теории газов: давление
газа прямо пропорционально средней
кинетической энергии поступательного
движения его молекул и числу молекул в
единице объема.
,
отсюда: - - основное
уравнение молекулярно-кинетической
теории газов: давление
газа прямо пропорционально средней
кинетической энергии поступательного
движения его молекул и числу молекул в
единице объема.
Поскольку
![]() - плотность газа, то
- плотность газа, то
![]() - уравнение Клаузиуса.
- уравнение Клаузиуса.
