
2.5.Закон Рауля и его следствия
2.5.1. Первый закон Ф. Рауля
Давление пара над раствором нелетучего вещества в каком-либо растворителе всегда ниже, чем над чистым растворителем при одной и той же температуре. Согласно закону Рауля, относительное понижение давления пара растворителя над раствором (депрессия раствора) равно молярной доле растворенного вещества Nh:
![]() (11)
(11)
где рА° — давление пара над чистым растворителем при данной температуре; рА — парциальное давление пара растворителя над раствором при той же температуре; пb — число молей растворенного вещества; па — число молей растворителя. Таким образом, относительное понижение давления пара растворителя над раствором (или депрессия раствора) зависит только от концентрации раствора, no не зависит от температуры.
Для разбавленных растворов пb по сравнению с па мало и поэтому его величиной в знаменателе уравнения (11) можно пренебречь. Тогда
![]() (12)
(12)
При диссоциации молекул (т.е. для электролитов) растворенного вещества в формулы (11) и (12) перед пb ставят изотонический коэффициент (i):
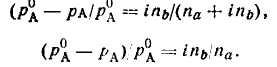 (13)
(13)
Задача 6. Вычислите давление насыщенного пара над раствором, содержащим 6,4 г нафталина (С10Н8) в 90 г бензола (С6Н6) при 20 °С. Давление насыщенного пара над бензолом при данной температуре 9953,82 Па.
Решение. По первому закону Рауля относительное понижение давления насыщенного пара над раствором равно молярной доле растворенного вещества:
![]()
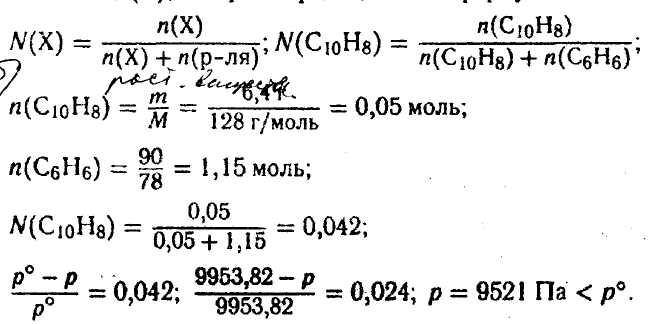
Давление насыщенного пара над раствором всегда меньше, чем над чистым растворителем.
Ответ: р = 9521 Па.
Задача 7 (решить самостоятельно). Давление пара чистого ацетона при 20°С 23940 Па. Давление пара раствора камфоры в ацетоне, содержащего 5 г камфоры на 200 г ацетона при той же температуре, равно 23 710 Па. Определить молекулярную массу камфоры, растворенной в ацетоне.
2.5.2. Замерзание и кипение растворов (2-й закон Рауля и его следствия)
Вследствие понижения давления пара растворителя над растворами нелетучих или малолетучих веществ температуры замерзания растворов ниже, а температуры их кипения выше, чем у чистых растворителей.
1) Понижение температуры замерзания раствора ∆Тз, равное разности температур замерзания растворителя и раствора ∆Тз = Тз раств – Тз раст, прямо пропорционально моляльной концентрации С (Cm) растворенного вещества:
![]() (14)
(14)
где Ез — молекулярное понижение температуры замерзания растворителя или криоскопическая постоянная; М — молекулярная масса растворенного вещества; g — масса растворенного вещества в 1000 г растворителя.
Для растворов электролитов в формулу (14) вводят изотонический коэффициент i:
![]() (15)
(15)
Обычно берут не 1000 г растворителя, а значительно меньшее его количество G (г) и растворяют в нем небольшую навеску вещества т. Тогда формулы (14 и 15) записывают так:
![]() (16)
(16)
![]() (17)
(17)
Определив опытным путем понижение Тз раствора и используя формулу (16), можно рассчитать молекулярную массу (М) растворенного вещества — неэлектролита или по формуле (17) изотонический коэффициент и по формуле (3) кажущуюся степень диссоциации α электролитов (метод криоскопии). Формулу (16) можно использовать также для определения температуры плавления сплавов.
2) Повышение температуры кипения раствора ∆ТК, равное разности между температурами кипения раствора (ТКраст) и растворителя (ТКраств), прямо пропорционально моляльной концентрации (Cm) растворенного вещества:
![]() (118)
где
Ек —
молекулярное повышение температуры
кипения, или эбулиоскопическая
постоянная. Для т
г
растворенного вещества в G
г растворителя:
(118)
где
Ек —
молекулярное повышение температуры
кипения, или эбулиоскопическая
постоянная. Для т
г
растворенного вещества в G
г растворителя:
![]() (19)
(19)
а для электролитов:
![]() (20)
(20)
Определив опытным путем повышение ТК раствора по сравнению с чистым растворителем, можно по формуле (19) вычислить молекулярную массу растворенного вещества — неэлектролита (метод эбулиоскопии).
Криоскопическис и эбулиоскопические постоянные Е3 и Ек являются константами растворителей. Значения Eз и Ек некоторых растворителей приведены в табл. (см. учебник Попков стр. 275). При отсутствии табличных данных Ез и Ек можно рассчитать по формулам:
![]() (21)
(21) ![]() (22)
(22)
где Т3 — температура замерзания растворителя, К; Тк — нормальная температура кипения растворителя, К; lпл — удельная теплота плавления растворителя, Дж/r; lисп — удельная теплота испарения растворителя, Дж/г.
Задача. Вычислите температуру кипения и замерзания водного раствора фруктозы (ώ фр. = 5%).
Решение. По второму закону Рауля
![]()
Справочная величина константы для воды Кэб (Н2О) и Ккр (Н2О) равна 0,52 град • кг/моль 1,86 град • кг/моль соответственно.
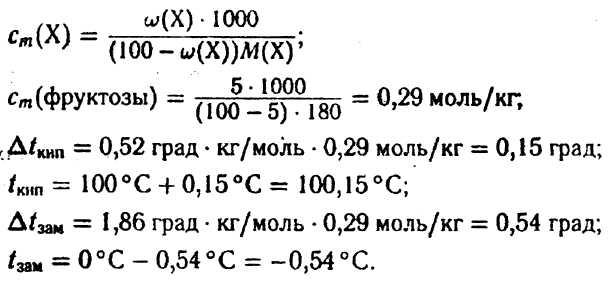
Ответ: 5%-ный раствор фруктозы закипит при 100,15°С, а замерзнет при -0,54 °С.
Задача. При какой примерно температуре будет замерзать водный раствор этилового спирта концентрации 0,4 (40%) масс, доли С2Н5ОН.
Решение.
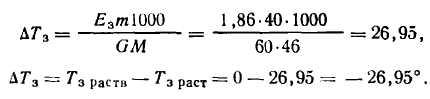
Раствор начнет замерзать примерно при –27° С.
Задача. Раствор, содержащий 1,70 г хлорида цинка в 250 г воды, замерзает при - -0,23° С. Определить кажущуюся степень диссоциации хлорида цинка в этом растворе.
Решение:
1) Вычисляем ∆Т3 данного раствора:
2![]() )
Находим изотонический коэффициент:
)
Находим изотонический коэффициент:
![]()
![]()
Рекомендуемая литература:
-
Попков В.А., Пузаков С.А. Общая химия: Учебник.- М.: ГЭОТАР-Медиа, 2007. - Стр. 269-285.
-
Слесарев В.И. Химия: Основы химии живого: Учебник для вузов. – СПб: Химиздат, 2000. – Стр. 139-152.
-
Общая химия. Биофизическая химия. Химия биогенных элементов. - Под ред. Ершова Ю.А. – М.: Высш. шк.,1993. – Стр. 66- 80.
