
- •Лекция 2, 3
- •2. Строение атома
- •2.1. Корпускулярно-волновой дуализм
- •2.2. Принцип неопределенности
- •2.3. Волновое уравнение
- •2.4. Квантово-механическая модель атома
- •2.5. Квантовые числа
- •2.6. Взаимосвязь квантовых чисел. Емкость уровня и подуровня
- •2.7. Правила заполнения электронами атомных орбиталей (ао)
- •2.8. Периодическая система д.И. Менделеева
- •2.9. Периодические свойства элементов
2.7. Правила заполнения электронами атомных орбиталей (ао)
1) Принцип минимальной энергии. Его предложил В. Клечковский: «АО заполняются электронами в порядке повышения энергии (Е) их уровней. Или при переходе от одного элемента к другому электроны размещаются последовательно на орбиталях, расположенных в порядке возрастания суммы главного и орбитального квантовых чисел (n+ℓ). При одинаковых энергиях этой суммы первой заполняется орбиталь с меньшим значением главного квантового числа». Например,
для 3d подуровня (n+ℓ) = 3+2 = 5 и
для 4р подуровня (n+ℓ) = 4+1 = 5.
E3d < E4p, так как главные квантовые числа 3d = 3; 4р = 4, то первым заполняет подуровень 3d.
Согласно принципу минимальной энергии имеем такой порядок заполнения АО:
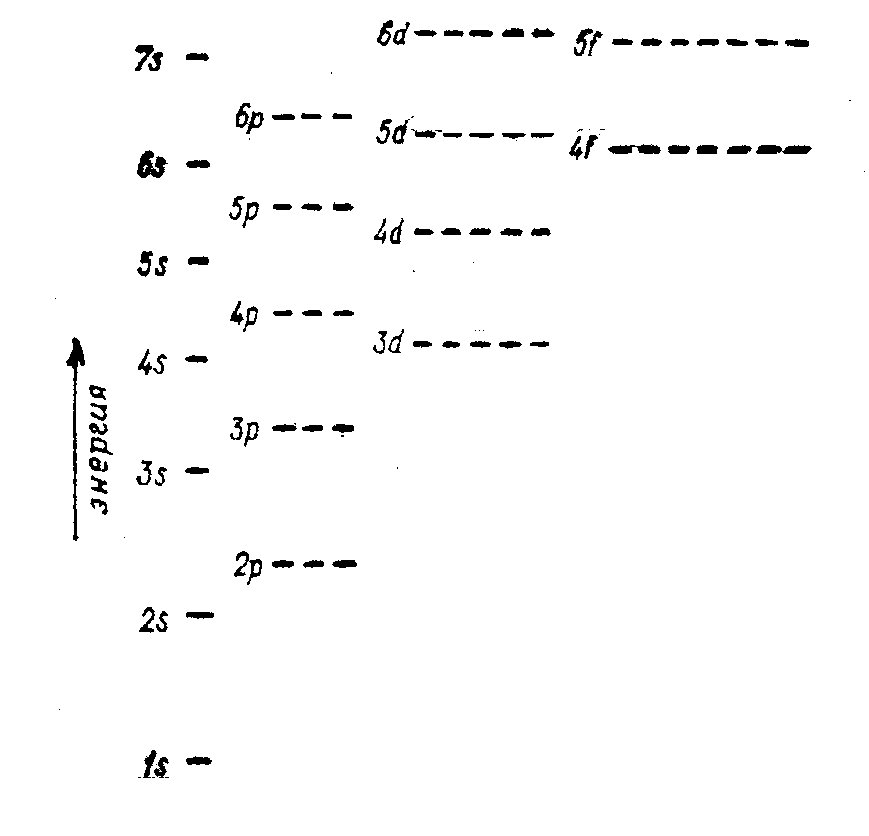
Рассмотрим заполнение электронами атома Ag.
Ag находится в V периоде, в I B подгруппе.
47

Мы записали электрнно-структурную формулу (конфигурацию) атома Ag.
47 Ag 1S22S22p63S23p63d104S24p64d95S2 – это запись электронной формулы атома Ag.
2) Принцип В. Паули: «В атоме не может быть даже двух электронов, у которых все четыре квантовых числа одинаковы».
Следствие: «В одной АО может максимально находиться только два электрона с противоположными спинами».
3) Правило Ф. Хунда: «Суммарный спин электрона в подуровне должен быть максимальным, т.е. АО подуровня сначала заполняются по одному электрону, а затем спариваются».
Задача: Как разместить 3 электрона на р-подуровне?









З апрещено
апрещено
![]()
 Разрешено
Разрешено
![]()
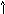
2.8. Периодическая система д.И. Менделеева
и электронная структура атомов
В 1869 г. Д.И. Менделеев сообщил об открытии периодического закона, современная формулировка которого такова:
«Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядер их атомов».
Физический смысл периодического закона: повторение свойств элементов связано с повторением электронного строения внешнего энергетического уровня.
Нагрядным выражением периодического закона служит периодическая система Д.И. Менделеева.
Рассмотрим связь между положением элемента в периодической системе и электронным строением его атомов.
Первый период состоит из двух элементов: Н и Не.
Атом гелия заканчивает формирование К-оболочки атома, обозначим ее [K] или [He]. Электрон, который последним заполняет орбиталь атома, называется формирующим и элемент относится к группе, называемой по формирующему электрону. Оба элемента имеют формирующие s-электроны и соответственно называются s-элементами.
У элементов второго периода формируется L-оболочка, заполняются s- и р- подоболочки (подуровни). Формирующими электронами у первых двух элементов являются s-электроны, поэтому Li и Be относятся к s-элементам. Остальные шесть элементов этого периода входят в число р- элементов, т.к. формирование их орбиталей заканчивается р- электроном. У элемента Ne полностью заполняется 2р подоболочка, обозначается она как [Ne].
Третий период начинается с атома Na, электронная конфигурация которого 1S22S22p63S1 и заканчивается аргоном Ar с электронной конфигурацией 1S22S22p63S23p6, обозначаемой [Ar]. Подоболочка 3d остается незаполненной.
В четвертом периоде начинается формирование N-уровня (n=4) и период начинается с s-элемента калия [Ar] 4S1. Это обусловлено тем, что энергия подуровня 4S несколько ниже, чем энергия 3d. После заполнения 4S заполняется 3d-подоболочка. Элементы от Sc до Zn, имеющие формирующие d-электроны, относятся к d-элементами. У атома Сr более устойчивой является конфигурация 3d54S1, чем 3d44S2. Такое явление получило название «провала» электрона. Провал электронов имеется также у атомов Cu, Nb, Mo, Pt, Pd. Четвертый период завершается формированием 4р подоболочки криптона Kr и обозначается [Ar] 3d104S24p6 или [Kr]. В этом периоде находится 18 элементов.
Пятый период аналогичен 4-ому и заканчивается р-элементом Хе; обозначается [Kr] 4d105S25p6 или [Хе].
В шестом периоде, как и в пятом, после завершения s-подоболочки начинается формирование d-подоболочки предвнешнего уровня у лантана La. Однако, у следующего элемента энергетически выгоднее формирование 4f-подоболочки по сравнению с 5d-подоболочкой. Поэтому после La следует 14 лантаноидов с формирующим f-электронами, т.е. f-элементов от церия Ce [Xe] 4f145d16S2 и до лютеция Lu [Хе] 4f145d16S2. Затем продолжается заполнение оставшихся орбиталей в 5d-подоболочке и 6р-подоболочке. Период завершает радон Rn [Xe] 4f145d106S26р6, или [Rn]. Таким образом, период имеет 32 элемента.
Седьмой период начинается и продолжается аналогично шестому периоду. Однако формирование его еще незавершено.
В настоящее время известно 112 элементов.
