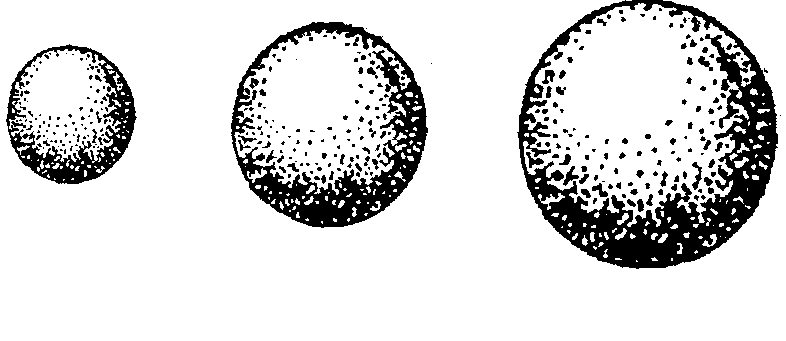- •Лекция 2, 3
- •2. Строение атома
- •2.1. Корпускулярно-волновой дуализм
- •2.2. Принцип неопределенности
- •2.3. Волновое уравнение
- •2.4. Квантово-механическая модель атома
- •2.5. Квантовые числа
- •2.6. Взаимосвязь квантовых чисел. Емкость уровня и подуровня
- •2.7. Правила заполнения электронами атомных орбиталей (ао)
- •2.8. Периодическая система д.И. Менделеева
- •2.9. Периодические свойства элементов
2.4. Квантово-механическая модель атома
Квантово-механическая модель атома – это воображаемый вид атома, созданный на основе положений квантовой механики. Изобразить электронную плотность в околоядерном пространстве можно с помощью рисунков и графиков. Решая уравнение Шредингера и подставляя неоднократно значение различных переменных, получим изображение электронного облака:
2
Рис. Способы изображения распределения электронной плотности в атоме водорода: графики зависимости ψ – r(a), ψ2dv – r(б), электронное облако (в), орбиталь (2)
Электронная облако – это околоядерное пространство, в котором вероятность пребывания электрона максимальна.
Орбиталь – фигура, образованная движением электрона и составляющая примерно 95% электронного облака.
Возможны различные формы орбиталей:
s-, р-, d- и f-
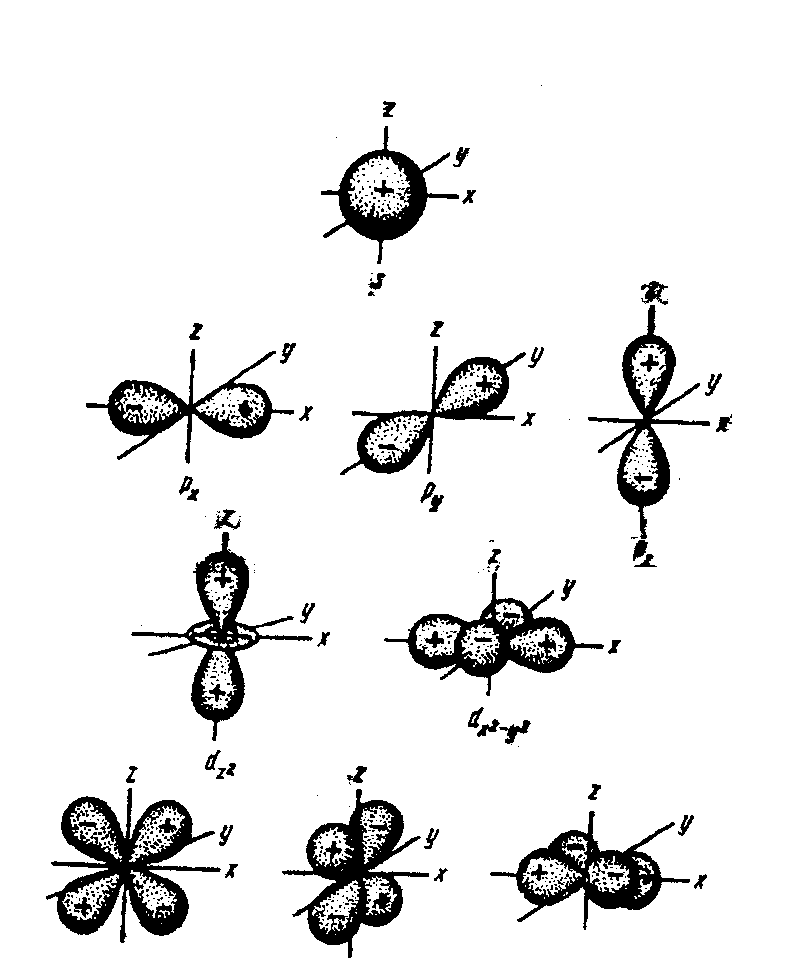
Формы s-, p-, d- орбиталей
2.5. Квантовые числа
Нахождение электрона в атоме характеризуется четырьмя квантовыми числами; n – главное, ℓ - орбитальное, m – магнитное, s – спиновое. Все эти числа характеризуют определенную энергию электрона. Кроме этого n определяет размер электронного облака и принимает значение [1; ). Электроны с одинаковым значением n образуют уровень в атоме.
|
n = 1 n = 2 n = 3 |
Чем больше n, тем выше энергия. Уровни имеют буквенные обозначения:
min max |
ℓ определяет форму электронного облака, принимает значения в зависимости от n [0; n-1]. Электроны с одинаковым значением ℓ образуют подуровень.
ℓ = 0
s - состояние
ℓ = 1
p - состояние
ℓ = 2
d - состояние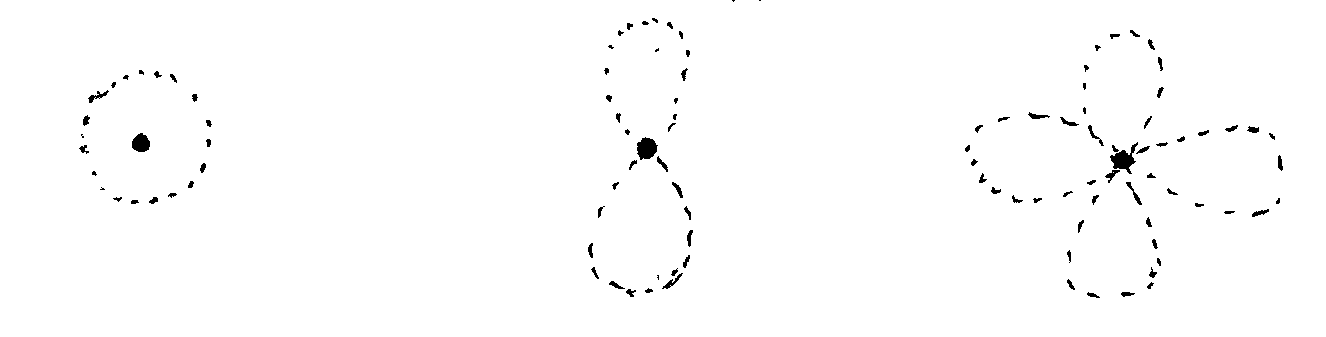
m определяет ориентацию электронного облака, принимает значения в зависимости от ℓ [-ℓ; 0; +ℓ].
Состояние электрона в атоме определяемое значением n, ℓ, m называется атомной орбиталью (АО). Обозначается или сокращено – .
S
определяет внутреннее движение электрона,
независящее от n,
ℓ, m;
принимает значения
![]() :
:
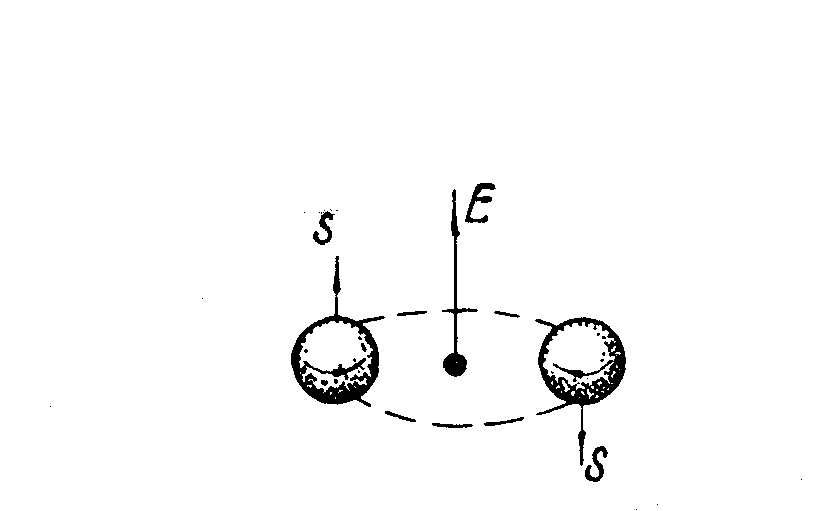
Рис. Спин-орбитальное взаимодействие у электронов, находящихся на одной орбитали и отличающихся направлением спинов
2.6. Взаимосвязь квантовых чисел. Емкость уровня и подуровня
Это положение отразим в виде таблицы:
|
n число уровней |
ℓ |
Буква |
m |
Число п/у = n |
Число АО = = (2ℓ+1) |
Емкость п/у = = 2(2ℓ+1) |
Емкость уровня 2n2 |
|
1 |
0 |
S |
0 |
1 |
1 |
2 |
2 |
|
2 |
0 1 |
S p |
0 -1, 0, +1 |
2 |
1 3 |
2 6 |
8 |
|
3 |
0 1 2 |
S p d |
0 -1, 0, +1 -2, -1, 0, +1, +2 |
3 |
1 3 5 |
2 6 10 |
18 |
|
4 |
0 1 2 3 |
S p d f |
0 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 |
4 |
1 3 5 7 |
2 6 10 14 |
32 |