- •10. Електрохімічні процеси
- •10.1 Електродний потенціал, класифікація електродів.
- •10.2 Гальванічні елементи. Приклади розв’язання типових задач
- •10.3. Електрохімічна корозія металів і сплавів. Приклади розв’язання типових задач
- •10.4. Електроліз. Приклади розв’язання типових задач
- •Має бути мінімальним, має бути максимальним
- •Cередовище стає лужним.
- •Кількісні розрахунки по електролізу потрібно виконувати згідно з законом Фарадея:
- •10.5. Запитання для самоконтролю
10.4. Електроліз. Приклади розв’язання типових задач
Електроліз – це сукупність окисно-відновних процесів, яки відбуваються на електродах при проходженні постійного електричного струму крізь розчин або розплав електроліту.
Напруга
електричного струму, що прикладається
до електродів для того щоб
пішов
процес електролізу,
називається напругою
розкладу
(електролізу). Вона рахується як: U =
=
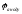 -
-
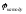 > 0, B
і
повинна мати мінімальне значення. Тобто,
для того щоб пішов процес електролізу
> 0, B
і
повинна мати мінімальне значення. Тобто,
для того щоб пішов процес електролізу
Має бути мінімальним, має бути максимальним
На
катоді
під час електролізу,
як і в гальванічному елементі, відбувається
процес відновлення.
Відновлюватись можуть позитивно
заряджені іони (катіони): Ме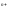 ,
Н
,
Н , або іони водню води (Н
, або іони водню води (Н -ОН).
Тобто, при електролізі катод під’єднується
до негативного полюсу джерела електричного
струму.
-ОН).
Тобто, при електролізі катод під’єднується
до негативного полюсу джерела електричного
струму.
Враховуючи,
що
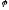 водневого електроду в залежності від
кислотності розчину та перенапруги
виділення водню може змінюватись в
межах від –1,6 до –0,41 Вольт, можна зробити
висновок:
водневого електроду в залежності від
кислотності розчину та перенапруги
виділення водню може змінюватись в
межах від –1,6 до –0,41 Вольт, можна зробити
висновок:
1)
якщо
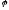 металу менше ніж -1,6 В, на катоді
відновлюється водень води -
металу менше ніж -1,6 В, на катоді
відновлюється водень води -
К(-):
2H O
+ 2е =
H
O
+ 2е =
H + 2OH
+ 2OH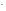 ;
;
Cередовище стає лужним.
2)
якщо
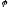 металу більш ніж - 0,41 відновлюються
іони металу –
металу більш ніж - 0,41 відновлюються
іони металу –
Ме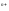 +
ne
= Me
+
ne
= Me ;
;
3)
якщо
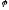 металу знаходиться у межах від -1,6 до
-0,41 В відновлюються одночасно іони
металу та молекули води, хоча змінюючи
умови процесу (концентрація розчину
солі металу, кислотність, густина току,
матеріал електроду) можна відновляти
тільки метал.
металу знаходиться у межах від -1,6 до
-0,41 В відновлюються одночасно іони
металу та молекули води, хоча змінюючи
умови процесу (концентрація розчину
солі металу, кислотність, густина току,
матеріал електроду) можна відновляти
тільки метал.
На аноді під час електролізу, як і в гальванічному елементі, відбуваються процеси окислення. Окислюватись можуть негативно заряджені іони (аніони): кислотні залишки та атоми оксигену води. Процес має йти при мінімальному значенні потенціалу анода. Тут можна користуватись емпіричним правилом простого аніону, яке дає послідовність окислення аніонів на аноді: чим простіше за складом аніон, тім менший потенціал він має і тім легше окислюється:
S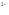 ,
I
,
I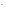 ,
Br
,
Br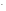 ,
Cl
,
Cl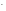 ;
OH
;
OH ,
H2О;
SO
,
H2О;
SO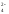 , NO
, NO .
.
Напрямок
зростання
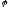 - зліва направо. Тобто, якщо в водному
розчині є прості одноатомні аніони,
вони окислюються в першу чергу. Наприклад:
- зліва направо. Тобто, якщо в водному
розчині є прості одноатомні аніони,
вони окислюються в першу чергу. Наприклад:
S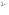 -2e
= S.
-2e
= S.
Якщо їх у розчині немає, окислюється вода:
Н О
- 4е = О
О
- 4е = О + 4 Н
+ 4 Н .
.
Розчин стає кислим.
Якщо анод виготовлений з металу, який має потенціал менший чим потрібен для окислювання води ( <+0,82,В), то відбувається окислення металу (розчинений анод):
Ме - ne
= Me
- ne
= Me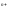 .
.
Кількісні розрахунки по електролізу потрібно виконувати згідно з законом Фарадея:
m(x)
=
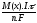 ,
де (10.4.1)
,
де (10.4.1)
m(x) – маса речовини, що окислилась або відновилась, г
М(х) - її молярна маса, г\моль
І - сила струму, А
 -
час електролізу, с
-
час електролізу, с
n - кількість електронів, що беруть участь у електродному процесі
F
- стала Фарадея (
 96500
А.с або Кл\моль).
96500
А.с або Кл\моль).
Задача
1.
Розрахуйте масу, а для газів об’єм (
н.у.) речовин, які виділяються на електродах
під час електролізу водного розчину
AgNO з графітовими (інертними) електродами,
якщо сила струму дорівнює 2А, а тривалість
процесу – 1 година.
з графітовими (інертними) електродами,
якщо сила струму дорівнює 2А, а тривалість
процесу – 1 година.
Розв’язання: Перш за все запишемо рівняння катодного і анодного процесів
K(-):
Ag + e = Ag (
+ e = Ag (
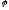 = max.)
= max.)
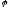
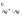 =
+0,80,B
=
+0,80,B
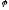

 =
- 0,41,B
=
- 0,41,B
A(+):
Н О
- 4е = О
О
- 4е = О + 4 Н
+ 4 Н згідно з правилом простого аніону.
згідно з правилом простого аніону.
Розрахуємо масу аргентуму:
M(Ag)
=
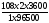
 8,06 (г).
8,06 (г).
Розрахуємо об’єм кисню. При цьому використаємо формулу закону Фарадея для газів (н.у.):
V(газу)
=
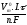 ; V(O
; V(O )
=
)
=
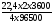
 0,42 (л).
(10.4.2)
0,42 (л).
(10.4.2)
Задача 2. Обчисліть масу речовини, що виділяється на катоді , при електролізі розчину Na2SO4, якщо на аноді виділяється 1,12 л кисню, обмірюваних за н.у.
Розв’язання: Перш за все запишемо рівняння анодного та катодного процесів. На аноді має перебігати процес окиснення системи з найменшим потенціалом. За правилом простого аніону це є окиснення води:
A(+):
Н О
- 4е = О
О
- 4е = О + 4 Н
+ 4 Н
На
катоді вибираємо процес відновлення
іонів натрію (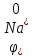 = -2,71B),
або іонів гідрогену води (
= -2,71B),
або іонів гідрогену води (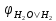 =
-0,41B,).
Найбільший потенціал має гідроген води:
=
-0,41B,).
Найбільший потенціал має гідроген води:
К(-): 2Н2О + 2е = Н2 + 2ОН-
Тобто, і на катоді і на аноді електролізу підвергається сама вода. Соль не витрачається, а лише посилює електропровідність розчину. При розрахунках найпростіше найти об’єм водню, що виділяється на катоді, використавши формулу 10.4.2 :
I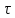 =
=
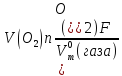 =
=
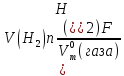 .
.
Пам’ятаючи що n(H2) = 2, a n(O2) = 4, находимо об’єм водню:
V(H2)
=
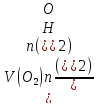 =
=
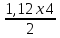 = 2,24 (л).
= 2,24 (л).
І наприкінці, маса водню дорівнює:
m(H2)
= M(H2)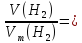
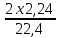 = 0,2 (г)
= 0,2 (г)
Задача 2. При електролізі розчину нітрату двохвалентного металу струмом силою 1А на протязі 1 год. на катоді виділилось 2,219 г металу. Визначте невідомий метал.
Розв’язання: Згідно за формулою 10.4.2 можемо розрахувати молярну масу атомів металу (відносну атомну масу):
М(х)
=
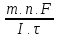 =
=
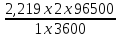 = 118,96 (г/моль).
= 118,96 (г/моль).
Тобто, цей метал – олово.
Задача 3. Скільки часу знадобиться для електролізу розчину NaCl для того, щоби при силі струму 2А виділити хлор об’ємом 11,2 л (н.у.), якщо вихід за струмом дорівнює 80 %?
Розв’язання: Для підрахунку необхідного часу скористуємось формулою 10.4.3:
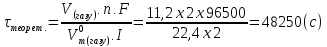
Вихід за струмом або практичний вихід це є:
Вс
=
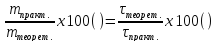 .
.
Тобто, маса виділеної речовини менша за теоретичну, а потрібний час є більшим за теоретичний. У нашому випадку розрахуємо час, який дійсно потрібен:
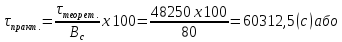 16,75
(час.)
16,75
(час.)
Задача 4. Які продукти і якої маси виділяються на електродах при повному розкладанні NaI масою 300 г, що знаходиться: а) у розплавленому стані; б) у водному розчині.
Розв’язання: У розплаві цієї солі на електродах будуть відбуватись безальтернативні процеси:
A(-): Na+ + e = Na0
K(-): 2I- - 2e = I2
Молярна маса солі, М(NaI) = 23 + 127 = 150(г/моль). Тому для розрахунку мас натрію та йоду складемо пропорції:
150г(NaI) - 23г(Na) 150г(NaI) - 127г(I2)
300 г - х 300г - у
Звідки : x = m(Na) = 46г , y = m(I2) = 254г.
При електролізі розплаву NaI на катоді, як і в задачі 1 з двох можливих процесів реалізується процес відновлення води:
К(-): 2Н2О + 2е = Н2 + 2ОН-
На аноді же згідно з правилом простого аніону вибираємо процес окислення аніонів йоду (тій же самий процес, що і в випадку розплаву):
А(+): 2I- - 2e = I2
Так як маса виділеного при цьому йоду дорівнює 254грами, що утворює 2 моль ( n = m/M = 254/127), то і кількість газоподібного водню, що виділяється на катоді, буде також 2 моль (рівні кількості пропущеної електрики) , або 4 грами ( m = n.M = 2x2 = 4).
Задача 5. Залізний предмет загальною площиною 0,08 м2 було занурено в якості катода у розчин солі нікелю. Через систему пропускали струм силою 3,15А на протязі 42 хв. Яка товщина шару нікелю, що виділився за цих умов (Ni = 8900 кг/м3)?
Розв’язання: Розрахуємо масу нікелю, що виділилася на залізному предметі під час електролізу:
m(Ni)
=
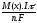 =
=
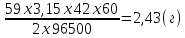
Пам’ятаючи m = xV V = Sxh
h
=
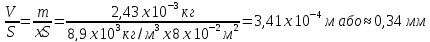
Задача 6. Наведіть рівняння електродних процесів при електролізі водного розчину, який містить суміш Cu(NO3)2 i KCl . Електроди інертні. Напруга в системі та сила струму – мінімально необхідні.
Розв’язання: Нагадаємо, що напругою розкладу при електролізі є різниця потенціалів аноду і катоду, при котрих перебігає цей процес. Вона повинна бути мінімальною величиною і достигає цього при мінімальному значенні потенціал анода та максимальному катода:
Uрозкладу
=
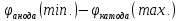
Згідно з правилом простого аніону на аноді будуть окислюватись аніони хлора:
А(+):
2Cl-
- 2e
= Cl2
( ).
).
На
катоді будуть відновлюватись катіони
купруму (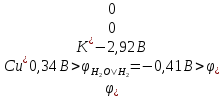 ):
):
K(-): Cu2+ + 2e = Cu0.
Тоді Uрозкладу = 1,36 - 0,34 = 1,02 (В).
Задача 7. В якій послідовності з водних розчинів розряджаються на катоді іони Ag+, Fe2+, Cu2+, Sn4+? Який процес відбувається на інертному аноді, якщо взято нітрати цих металів?
Розв’язання:
На катоді процеси відновлення іонів
металів будуть відбуватись в напрямку
зменшення потенціалів, тобто в першу
чергу - Ag+
(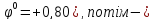 Cu2+
(
Cu2+
(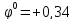 ),
- Sn4+
(
),
- Sn4+
(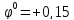 ).
І наприкінці, можуть одночасно
відновлюватись іони залізі і водню, яки
мають приблизно однакові значення
потенціалів: -0,44 та -0,41В відповідно.
).
І наприкінці, можуть одночасно
відновлюватись іони залізі і водню, яки
мають приблизно однакові значення
потенціалів: -0,44 та -0,41В відповідно.
Згідно з правилом простого аніону на аноді буде окислюватись вода:
A(+):
2H2O
-4e = O2
+ 4H+
(
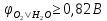 )
)
Задача 8. При електролізі розчину якої з наведених солей: KCl, CuSO4, NaI на електродах виділяються тільки гази? Запишіть рівняння електродних процесів.
Розв’язання: На катоді буде відновлюватись водень в випадках розчинів KCl і NaI:
К(-): 2Н2О + 2е = Н2 + 2ОН-
Тобто, далі аналізуємо анодні процеси тільки для цих розчинів згідно з правилом простого аніону:
А(+): 2Cl- - 2e = Cl2 (газ)
А(+): 2І- - 2e = І2 (тверда)
Відповідь: на катоді і аноді виділяються гази при електролізі тільки KCl – водень та хлор відповідно.
Задача 9. Складіть рівняння електродних процесів, що перебігають при електролізі розчину NiSO4, якщо анод: а) платиновий; б) нікелевий; в) З чого зроблено анод – платини чи нікелю, – якщо його маса за 10 хв. зменшилася на 5,87 г? Розрахуйте струм електролізу.
Розв’язання:
З чого б ні був зроблений анод, на катоді
може відновлюватись вода (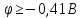 )
або іони нікелю (
)
або іони нікелю (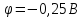 ).
Другий процес має більше значення, тому:
).
Другий процес має більше значення, тому:
K(-): Ni2+ + 2e = Ni0
На
аноді має окислюватись система з
найменшим значенням потенціалу: а)
 ;
;
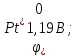
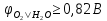 )
– тобто
вода:
)
– тобто
вода:
A(+):
2H2O
-4e = O2
+ 4H+
(
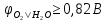 )
)
б)
 ;
;
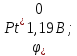
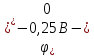 тобто матеріал самого нікелевого аноду
(розчинний анод):
тобто матеріал самого нікелевого аноду
(розчинний анод):
А(+): Ni0 -2e = Ni2+.
в) В цьому випадку анод зроблений із нікелю, якщо при електролізі він зменшує масу. Розрахуємо силу струму використовуючи формулу 10.4.1:
I
=