- •10. Електрохімічні процеси
- •10.1 Електродний потенціал, класифікація електродів.
- •10.2 Гальванічні елементи. Приклади розв’язання типових задач
- •10.3. Електрохімічна корозія металів і сплавів. Приклади розв’язання типових задач
- •10.4. Електроліз. Приклади розв’язання типових задач
- •Має бути мінімальним, має бути максимальним
- •Cередовище стає лужним.
- •Кількісні розрахунки по електролізу потрібно виконувати згідно з законом Фарадея:
- •10.5. Запитання для самоконтролю
10.3. Електрохімічна корозія металів і сплавів. Приклади розв’язання типових задач
Корозія, тобто процес самодовільного руйнування поверхні металевих виробів, дуже часто має електрохімічний характер.
Якщо є два різних метали в контакті (покриття, клепка, сплав, тощо), то виконуються всі три умови для виникнення та праці гальванічного елемента (дві різних електрохімічні системи, замкнутість зовнішнього та внутрішнього колів).
Однак,
цей гальванічний елемент відрізняється
від звичайного як схемою, так і електродними
процесами. Замість двох спеціально
підібраних електролітів (розчини солей
відповідних металів) маємо лише один –
електроліт корозійного середовища,
тобто електроліт середовища експлуатації
вироба. Це може бути: вологе
повітря, яке містіть кислі гази - СО ,
SO
,
SO ,
H
,
H S
(а); не містіть їх (б); а також кислі (в)
або нейтральні водні розчини, яки не
містять кисню (г).
S
(а); не містіть їх (б); а також кислі (в)
або нейтральні водні розчини, яки не
містять кисню (г).
Первинний
процес
на аноді
в цих елементах не відрізняється від
процесу в звичайному гальванічному
елементі (г.е.) – йде окислення
металу з меншим
значенням
електродного потенціалу (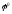 ),
тобто його руйнування – корозія.
),
тобто його руйнування – корозія.
Наприклад,
якщо маємо оцинковане залізо, то при
механічному порушенні цілостності
покриття начинає кородувати цинк (анодне
покриття) як метал з меншим
 :
:
А(-):
Zn - 2e
= Zn
- 2e
= Zn .
.
На катоді (залізо) із електроліту корозійного середовища має відновлюватись система з найбільшим потенціалом. Це може бути кисень повітря або розчинений у воді кисень, іони водню кислот або води. Тобто, найпоширенішими окисниками є кисень і іон гідрогену. При цьому потрібно пом’ятати що:
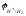 =
-0,059 рН
- водневий електрод
=
-0,059 рН
- водневий електрод
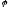
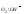 =
1,23 - 0,059
- кисневий електрод
=
1,23 - 0,059
- кисневий електрод
Тоді потенціали цих окисників для різних по кислотності середовищ будуть :
|
рН |
0 |
7 |
14 |
|
|
0 |
-0,41 |
-0,82 |
|
|
1,23 |
+0,82 |
+0,41 |
Для вже згаданого прикладу катодні процеси можуть бути:
а)
К(-): O + 4e
+ 2H
+ 4e
+ 2H O
= 4OH
O
= 4OH
 у нейтральному вологому середовищі,
яке містить повітря або кисень (аеріроване
середовище)
у нейтральному вологому середовищі,
яке містить повітря або кисень (аеріроване
середовище)
б)
К(-): (-):
O + 4e
+
4Н
+ 4e
+
4Н = 2Н2О
у кислому середовищі, яке містіть
повітря (аеріроване кисле середовище)
= 2Н2О
у кислому середовищі, яке містіть
повітря (аеріроване кисле середовище)
в)
К(-): (-):
2Н + 2е = H
+ 2е = H у кислому середовищі без кисню або
повітря (деареріроване кисле середовище)
у кислому середовищі без кисню або
повітря (деареріроване кисле середовище)
г)
К(-): 2H O
+
2е =
H
O
+
2е =
H + 2OH
+ 2OH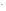 у нейтральному середовищі без кисню
або повітря (деаріроване середовище)
у нейтральному середовищі без кисню
або повітря (деаріроване середовище)
Загальна схема корозійного гальванічного елементу (корозійної пари):
Ме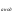 |
електроліт |Ме
|
електроліт |Ме
Наприклад:
Zn
| H O,
O
O,
O , H
, H | Fe
. Це є схема корозійної пари для
оцинкованого заліза у кислому середовищі,
яке містіть повітря. Рівняння первинних
електродних процесів в цьому випадку
будуть такими:
| Fe
. Це є схема корозійної пари для
оцинкованого заліза у кислому середовищі,
яке містіть повітря. Рівняння первинних
електродних процесів в цьому випадку
будуть такими:
А(-): Zn0 -2e = Zn2+
K(+): O2 +4e + 4H+ = 2H2O
Тобто, кородує (руйнується) цинкове покриття. При перебігу вторинного процесу іони цинку утворюють соль з кислотними залишками.
В усіх наведених нижче задачах з електрохімічної корозії металів у відповідях обов’язково треба навести схеми корозійних пар і електронні рівняння анодного та катодного процесів.
Задача 1. Як відбувається атмосферна корозія лудженого (покритого станумом) і оцинкованого заліза при порушенні цілісності покриття?
Розв’язання: Якщо корозія перебігає
на повітрі, це означає, що ми маємо
нейтральне кисневмісне середовище. Так
як,
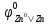 = -0,76B;
= -0,76B;
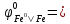 -0,44B;
-0,44B;
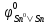 =
-0,14B, залізо в парі з цинком
буде катодом (руйнуватись не буде), а в
парі зі станумом – анодом (буде кородувати,
або руйнуватись). Схеми відповідних
корозійних пар і анодних процесів -
=
-0,14B, залізо в парі з цинком
буде катодом (руйнуватись не буде), а в
парі зі станумом – анодом (буде кородувати,
або руйнуватись). Схеми відповідних
корозійних пар і анодних процесів -
Zn|H2O, O2|Fe ; Fe|H2O, O2|Sn
А(-): Zn - 2e = Zn2+ ; A(-): Fe - 2e = Fe2+
На катоді можливі два процеси – відновлення іонів гідрогену води (потенціал водневого електроду при рН = 7 дорівнює -0,41В) і відновлення кисню повітря (потенціал кисневого електроду при рН = 7 дорівнює +0,82В). Тому на катоді в обох випадках буде відновлюватись кисень, як система, що має більший потенціал:
К(+): O2 +4e + 2H2O = 4OH-
Задача 2. Яке металічне покриття називається анодним і яке – катодним? Яки з приведених нижче металів можуть виступати в якості анодних і катодних покриттів для виробу з Al, що знаходиться: а) у вологому повітрі, яке містить кислі гази – CO2 i SO2; б) у сильно кислому безповітряному середовищі: Mg, Ni, Cr, Be, Co, Cu ? Наведіть по одному прикладу повних характеристик корозійних пар різних типів.
Розв’язання: Анодним є покриття із металу, що має менший потенціал ніж потенціал металу виробу, а у металу катодного покриття потенціал навпаки більший ніж потенціал металу виробу. Тому анодними покриттями для алюмінія будуть: Mg і Be; При пошкодженні анодного покриття кородує метал покриття. Катодними будуть - Cr, Co, Ni, Cu. Приводимо повну характеристику двох корозійних пар різних типів, що утворюються при порушенні шару покриття:
-
Mg|H2O, H+, O2|Al
A(-): Mg - 2e = Mg2+
K(+): O2
+ 4e + 4H+
= 2H2O
(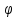 = 1,23B)
= 1,23B)
б) Al| H2O, H+|Co
A(-): Al - 3e = Al3+
K(+): 2H+ + 2e = H2
Задача 3. Алюміній склепано з міддю. Який з металів буде руйнуватися, якщо ці метали знаходяться: а) у вологому повітрі; б) у безкисневому електроліті з рН 7? Наведіть повні характеристики утворених корозійних пар.
Розв’язання: Алюміній має менше значення стандартного електродного потенціалу, тому він буде виконувати роль аноду в корозійних парах і руйнуватись:
а) Al|H2O, O2|Cu ; б) Al|H2O, H+|
A(-): Al - 3e = Al3+
У нейтральному середовищі (а) потенціали водневого і кисневого електродів будуть дорівнювати -0,41 та 0,82 В відповідно. Тому на катоді в цьому випадку буде відновлюватись кисень:
а) К(+): О2 + 4е + 2Н2О = 4ОН- .
На катоді
у другому випадку більший потенціал
буде у катіона гідрогену в кислоті ніж
в воді (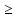 0 і -0,41В відповідно). Тому
0 і -0,41В відповідно). Тому
б) К(+): 2Н+ + 2е = Н2
Сплави металів часто являють собою так звані механічні суміші – мікрозерна одного металу знаходяться у тісному контакті з мікрозернами іншого металу. Студентам-електроенергетикам буде достатньо цікаво познайомиться з якісним та кількостним вмістом деяких поширених у промисловості сплавів металів та потренуватись розбираючи питання електрохімічної корозії на поверхнях виробів, виконаних з цих сплавів, у різних струмопровідних середовищах:
-
Монель-метал (70 мас. % Cu, 30 мас. % Ni);
-
Магналій (20 мас. % Mg, 80 мас. % Al);
-
Монетний сплав (Cu i 38-45 мас. % Zn);
-
Дюралюміній (93-95 мас. % Al, 3,5-5,5 мас. % Cu, домішки Mn, Mg);
-
Бронза (90 мас. % Cu, 10 мас. % Sn);
-
Константан (60 мас. % Cu, 40 мас. % Ni);
-
Ніхром (60 мас. % Ni, 40 мас. % Cr);
-
Електрон (80 мас. % Mg, 20 мас. % Zn);
-
Антифрикційний сплав для заливки підшипників (99 мас. % Pb, 1 мас. % Ca);
-
Латунь (сплав міді з цинком (30-35 мас.%);
-
Нержавіюча сталь являє собою сплав заліза з 8 % мас. нікелю та 18 % мас. хрому).
Задача 4. Опишіть процес електрохімічної корозії стального виробу у вологому повітрі в наслідок чого утворюється іржа на поверхні цього виробу. При цьому треба врахувати, що на поверхні заліза є ділянки, заповнені карбідом заліза Fe3C (цементитом), які виконують роль катода у мікрокорозійних парах.
Розв’язання: Наведемо повну характеристику схему корозійної пари: Fe|H2O, O2|Fe3C
A(-): Fe0 - 2e = Fe2+
K(+): O2 + 4e + 2H2O = 4OH-
За рахунок вторинного процесу окиснення іонів феруму (ІІ) киснем повітря на поверхні виробу утворюється іржа:
4Fe2+(OH)2 + O2 = 4Fe3+O(OH) + 2H2O