
- •10. Електрохімічні процеси
- •10.1 Електродний потенціал, класифікація електродів.
- •10.2 Гальванічні елементи. Приклади розв’язання типових задач
- •10.3. Електрохімічна корозія металів і сплавів. Приклади розв’язання типових задач
- •10.4. Електроліз. Приклади розв’язання типових задач
- •Має бути мінімальним, має бути максимальним
- •Cередовище стає лужним.
- •Кількісні розрахунки по електролізу потрібно виконувати згідно з законом Фарадея:
- •10.5. Запитання для самоконтролю
10. Електрохімічні процеси
Програмні питання
Предмет електрохімії. Електродні потенціали. Рівняння Нернста. Типи електродів: першого та другого родів; металічні, газові, окисно-відновні. Стандартний водневий електрод. Ряд стандартних електродних потенціалів металів. Гальванічні елементи Електродні процеси та струмоутворююча реакція. Електрорушійна сила. Поляризація електродів та напруга гальванічних елементів. Напрямок окисно-відновних реакцій.
Корозія металів і сплавів. Хімічна корозія. Електрохімічна корозія, її причини. Захист металів від корозії: ізоляція металів від навколишнього середовища, зміна корозійного середовища, електрохімічні методи захисту.
Електроліз. Електроліз з нерозчинним та розчинним анодами. Закони електролізу. Застосування електролізу в техніці та промисловості.
10.1 Електродний потенціал, класифікація електродів.
Вихідним
поняттям
в електрохімії є поняття про електродний
потенціал,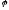 ,
який вимірюється у Вольтах. При зануренні
металевої пластинки у воду за рахунок
взаємодії полярних молекул води з іонами
кристалічної решітки металу на межи
розподілу фаз – поверхня металу та
вода, утворюється так званий ,, подвійний
електричний шар,,. Він характеризується
від’ємним
електричним зарядом на поверхні пластинки
та позитивним зарядом у воді біля цієї
поверхні. Тобто, утворюється плоский
конденсатор або подвійний електричний
шар, який характеризується різницею
електричних потенціалів. Ця різниця
електричних потенціалів і називається
електродним потенціалом,
,
який вимірюється у Вольтах. При зануренні
металевої пластинки у воду за рахунок
взаємодії полярних молекул води з іонами
кристалічної решітки металу на межи
розподілу фаз – поверхня металу та
вода, утворюється так званий ,, подвійний
електричний шар,,. Він характеризується
від’ємним
електричним зарядом на поверхні пластинки
та позитивним зарядом у воді біля цієї
поверхні. Тобто, утворюється плоский
конденсатор або подвійний електричний
шар, який характеризується різницею
електричних потенціалів. Ця різниця
електричних потенціалів і називається
електродним потенціалом,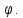 Сама же пластина, яка знаходиться у воді
або в розчині солі того ж металу, утворює
електрод. В електрохімії прийнято
записувати умовні схеми
електродів:
Сама же пластина, яка знаходиться у воді
або в розчині солі того ж металу, утворює
електрод. В електрохімії прийнято
записувати умовні схеми
електродів:
Ме
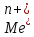 ;
де вертикальна риса означає границю
поділу фаз (тверде тіло – рідина, …). У
загальному випадку для любих
окисно-відновних систем схеми виглядять
як: Re|Ox
, де Red
– відновлена форма системи, а Ox
– окислена форма.
;
де вертикальна риса означає границю
поділу фаз (тверде тіло – рідина, …). У
загальному випадку для любих
окисно-відновних систем схеми виглядять
як: Re|Ox
, де Red
– відновлена форма системи, а Ox
– окислена форма.
Між окисленою і відновленою формами системи встановлюється рівновага, яка відображається рівнянням електродної реакції:
Ме
Меn+
+ n
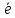 , або
, або

Red
Ox + n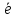


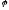 -
кількісна величина, котра характеризує
здібність окисно-відновної системи к
окисленню та відновленню.
Чим менша її значення, тім легше
окислюється відновлена форма системи
(Red);
чим вона більше, тем легше йде процес
відновлення окисленої форми (Ox).
-
кількісна величина, котра характеризує
здібність окисно-відновної системи к
окисленню та відновленню.
Чим менша її значення, тім легше
окислюється відновлена форма системи
(Red);
чим вона більше, тем легше йде процес
відновлення окисленої форми (Ox).
Рівняння
Нернста
дає залежність
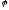 від природи окисно-відновної системи,
концентрації потенціал-утворюючих
іонів та температури:
від природи окисно-відновної системи,
концентрації потенціал-утворюючих
іонів та температури:
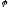
 =
=
 +
+
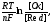
де
 - стандартний електродний потенціал
системи, R – універсальна газова стала
- 8,31 Дж/моль.К; T – температура, К; F –стала
Фарадея – 96485 Кл/моль, n
- число
електронів в реакції, а
[Ox],
[Red]
– концентрації
відповідно окисленої та відновленої
форм системи.
- стандартний електродний потенціал
системи, R – універсальна газова стала
- 8,31 Дж/моль.К; T – температура, К; F –стала
Фарадея – 96485 Кл/моль, n
- число
електронів в реакції, а
[Ox],
[Red]
– концентрації
відповідно окисленої та відновленої
форм системи.
За стандартних термодинамічних умов ( Р- 101,34 КПа, Т – 298 К) це рівняння перетворюється в:
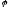
 =
=
 +
+
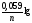
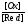 ,
(10.1)
,
(10.1)
Для металічних електродів це рівняння має вигляд:
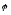 =
=
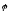
 +
+
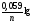 [Me
[Me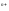 ].
(10.2)
].
(10.2)
В загальному випадку електроди класифікуються на два типи:
-
Першого роду, в яких величина електродного потенціалу залежить від концентрації катіонів (металічні електроди, водневий, …)
-
Другого роду, в яких величина електродного потенціалу залежить від концентрації аніонів ( хлор-срібний, каломельний, …). В цих випадках в рівнянні Нернста перед другим членом стоїть знак мінус (наприклад, для хлор-срібного електроду):
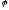
 2
=
2
=
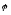
 -
-
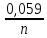 lg
[Cl-].
lg
[Cl-].
Також електроди можна класифікувати по якомусь специфічному признаку:
-
Металічні – одна з двох форм (Red - Ox )є метал; 2. Газові – присутня газова складова ( водневий, кисневий, …); 3. Окисно-відновні – сам електрод, виготовлений з інертного матеріалу, є тільки електропровідником, а окислена та відновлені форми окисно- відновної системи знаходяться у розчині. Наприклад, Pt Fe2+, Fe3+. Рівняння електродної реакції:
Fe2+
Fe3+
+ е

4.Електроди
зрівняння –
потенціал є сталою величиною, тобто не
залежить від концентрації потенціал-утворюючих
іонів. Наприклад, це є той же самий
хлор-срібний електрод з насиченим
розчином KCl (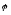 =
0,203
B).
=
0,203
B).
Значення електродних потенціалів розраховують відносно стандартного потенціалу водневого електроду, який прийнятий за умовний нуль потенціалів.
Водневий електрод – це платинова пластинка, яка покрита платиновою черню для збільшення площини поверхні і занурена в розчин сульфатної кислоти. Ця пластина обдувається газоподібним гідрогеном, який адсорбується на її поверхні, утворюючи якби ‘’металічний водень ‘’. Тобто, в цьому випадку маємо одночасно електроди першого роду і газовий. Схема водневого електроду та рівняння електродної реакції будуть виглядати як:
Pt, H2 (адсорб. )|Н+
Н2
2Н+ + 2е

В загальному випадку потенціал водневого електроду розраховується згідно рівняння:
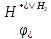 =
=
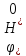 +
+
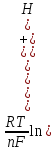 .
.
Після
внесення всіх сталих величин в
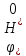 та приймання його за умовний нуль для
стандартних умов здобуваємо формулу
для розрахунку потенціалу водневого
електроду:
та приймання його за умовний нуль для
стандартних умов здобуваємо формулу
для розрахунку потенціалу водневого
електроду:
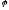
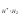 =
0,059lg[H
=
0,059lg[H ]
= - 0,059 pH.
(10.3)
]
= - 0,059 pH.
(10.3)
