
- •Основы биологической химии предисловие
- •Введение Предмет и задачи биохимии
- •Основные признаки живой материи
- •Глава 1. Химический состав организмов
- •Глава 2. Структура и свойства белков
- •2.1. Роль и определение белков.
- •2.2. Функции белков в организме
- •2.3. Элементный состав белков. Содержание белков в органах и тканях
- •2.4. Аминокислотный состав белков
- •2.5. Кислотно-основные свойства аминокислот
- •2.6. Стереохимия аминокислот
- •2.7. Строение белков
- •2.8. Уровни структурной организации белков
- •Первичная структура
- •Вторичная структура белков
- •Третичная структура белков
- •Четвертичная структура белков
- •2.9. Физико-химические свойства белков
- •Кислотно-основные свойства белков
- •Растворимость белков
- •Денатурация и ренатурация
- •2.10. Классификация белков
- •2.11. Методы выделения и очистки белков
- •Очистка белков
2.6. Стереохимия аминокислот
Важной особенностью белковых α-аминокислот является их оптическая активность. За исключением глицина все они построены асимметрично, в связи с чем, будучи растворены в воде или в соляной кислоте, способны вращать плоскость поляризации света. Аминокислоты существуют в виде пространственных изомеров, относящихся к D- или L-ряду. L- или D-конфигурация определяется типом строения соединения относительно асимметрического атома углерода (атом углерода, связанный с четырьмя различными атомами или группами атомов). В формулах асимметрический атом углерода обозначают звездочкой. На рис.3 показаны проекционные модели L- и D- конфигураций аминокислот, которые являются как бы зеркальным отображением друг друга. Все 18 оптически активных белковых аминокислот относятся к L -ряду. Однако в клетках многих микроорганизмов и в антибиотиках, продуцируемых некоторыми из них, обнаружены D-аминокислоты.
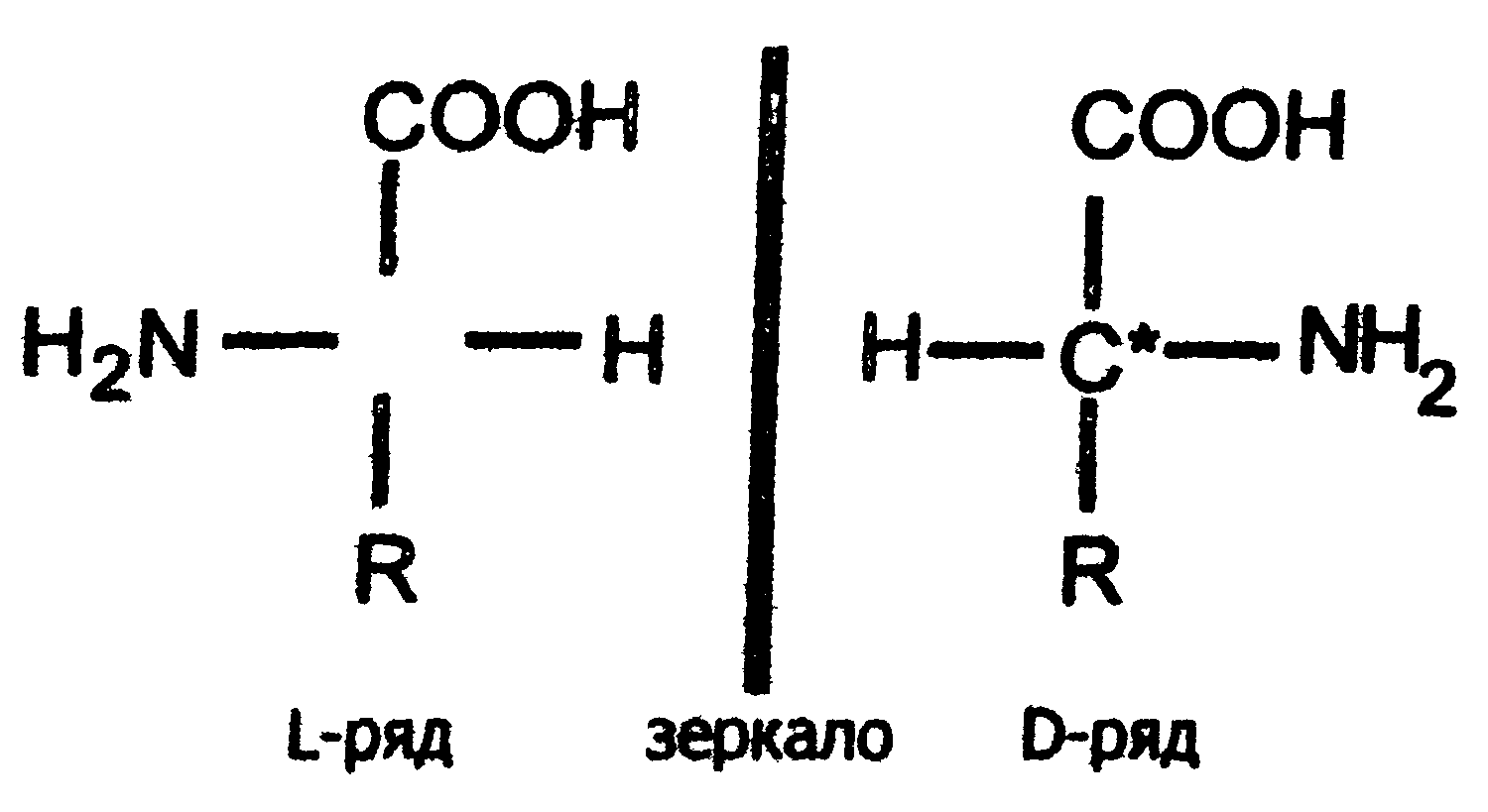
Рис. 3. Конфигурация L- и D- аминокислот
2.7. Строение белков
Исходя из результатов изучения продуктов гидролиза белков и выдвинутых А.Я. Данилевским идей о роли пептидных связей -CO-NH- в построении белковой молекулы, немецкий ученый Э. Фишер предложил в начале XX века пептидную теорию строения белков. Согласно этой теории, белки представляют собой линейные полимеры α-аминокислот, связанных пептидной связью - полипептиды:
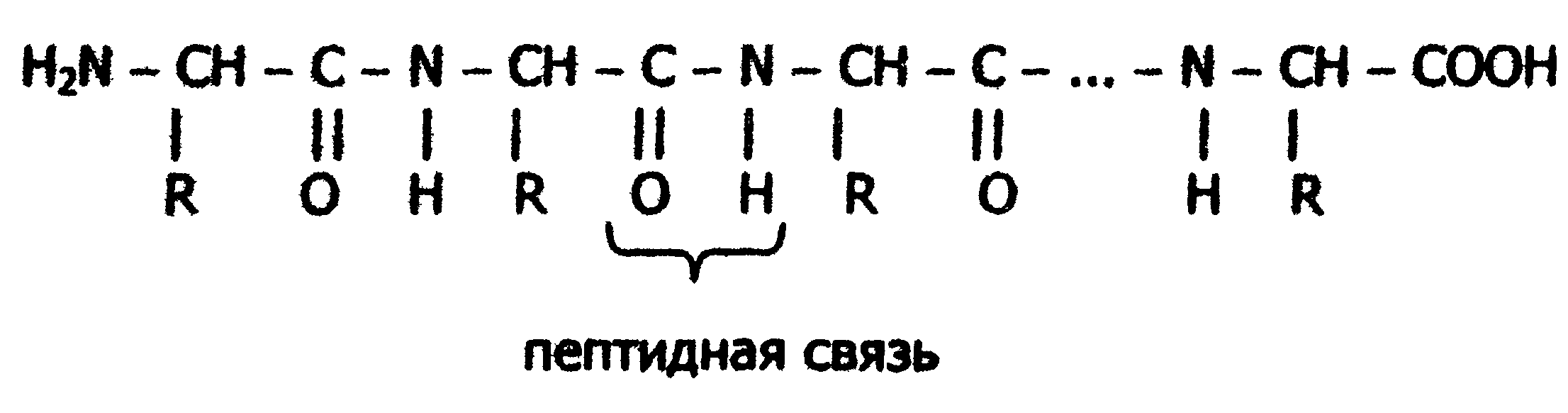
В каждом пептиде один концевой аминокислотный остаток имеет свободную α-аминогруппу (N-конец), а другой - свободную α-карбоксильную группу (С-конец). Структуру пептидов принято изображать, начиная с N-концевой аминокислоты. При этом аминокислотные остатки обозначаются символами. Например: Ala-Tyr-Leu-Ser-Tyr- •••-Cys. Этой записью обозначен пептид, в котором N-концевой α-аминокислотой является аланин, а С-концевой - цистеин. При чтении такой записи окончания названий всех кислот, кроме последних меняются на - "ил": аланил-тирозил-лейцил-серил-тирозил-••• -цистеин. Длина пептидной цепи в пептидах и белках, встречающихся в организме, колеблется от двух до сотен и тысяч аминокислотных остатков.
Для определения аминокислотного состава белки (пептиды) подвергают гидролизу:

В нейтральной среде эта реакция протекает очень медленно, но ускоряется в присутствии кислот или щелочей. Обычно гидролиз белков проводят в запаянной ампуле в 6М растворе соляной кислоты при 105 °С; в таких условиях полный распад происходит примерно за сутки. В некоторых случаях белок гидролизуют в более мягких условиях (при температуре 37-40 °С) под действием биологических катализаторов-ферментов в течение нескольких часов.
Затем аминокислоты гидролизата разделяют методом хроматографии на ионообменных смолах (сульфополистирольный катионит), выделяя отдельно фракцию каждой аминокислоты. Для вымывания аминокислот с ионнообменной колонки используют буферы с возрастающим значением рН. Первым снимается аспартат, имеющий кислотную боковую цепь; аргинин с основной боковой цепью вымывается последним. Последовательность снятия аминокислот с колонки определяют по профилю вымывания стандартных аминокислот. Фракционированные аминокислоты определяют по окраске, образующейся при нагревании с нингидрином:

В этой реакции бесцветный нингидрин превращается; в синефиолетовый продукт, интенсивность окраски которого (при 570 нм) пропорциональна количеству аминокислоты (только пролин дает желтое окрашивание). Измерив, интенсивность окрашивания, можно рассчитать концентрацию каждой аминокислоты в гидролизате и число остатков каждой из них в исследуемом белке.
В настоящее время такой анализ проводят с помощью автоматических приборов - аминокислотных анализаторов (см. ниже рис. Схемы прибора). Результат анализа прибор выдаёт в виде графика концентраций отдельных аминокислот. Этот метод нашел широкое применение в исследовании состава пищевых веществ , клинической практике; с его помощью за 2-3 часа можно получить полную картину качественного состава аминокислот продуктов и биологических жидкостей.
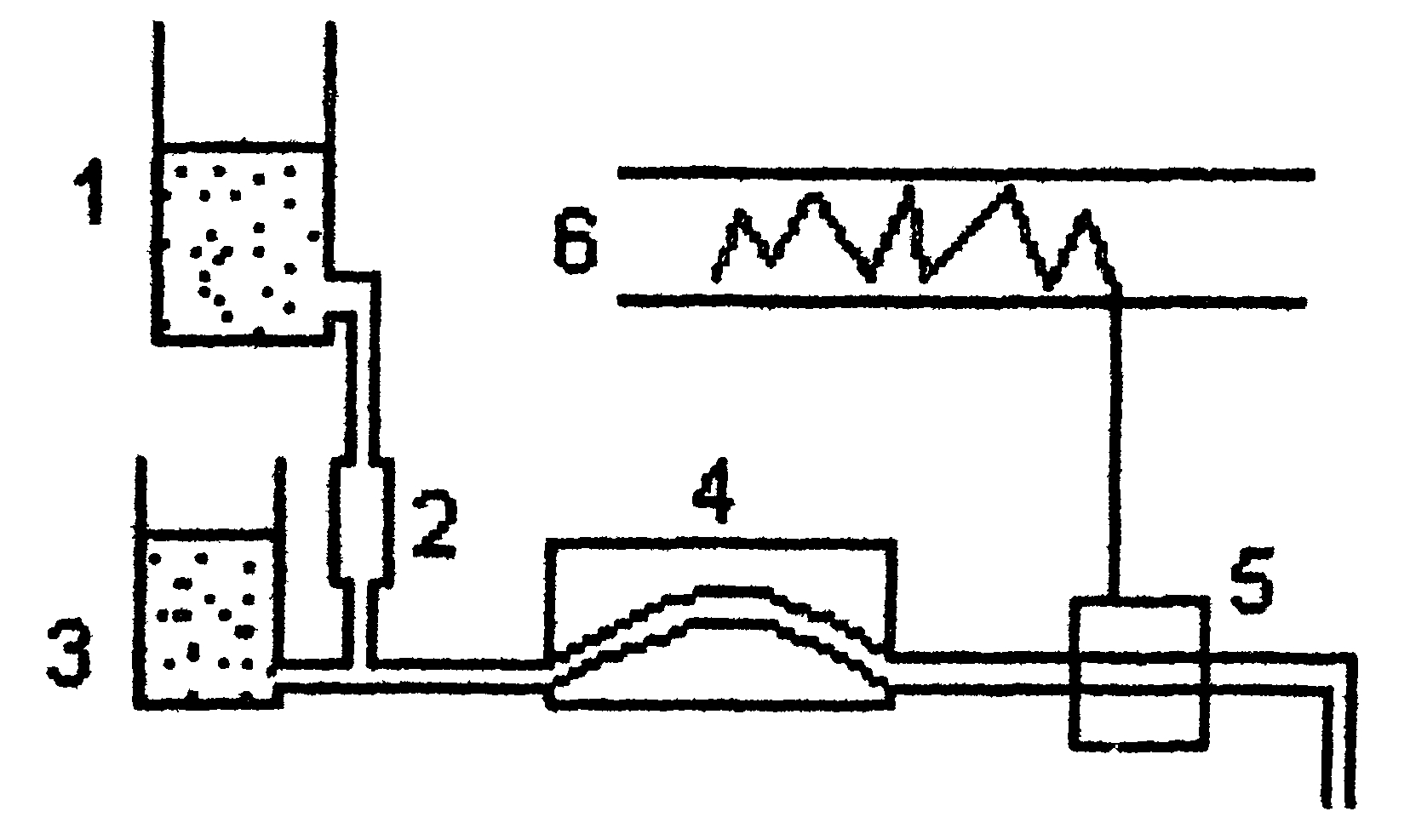
Рис. Схема аминокислотного анализатора: 1 - вымывающий раствор (буфер с переменным рН); 2 - хроматогрифическая колонка (в верхнюю часть колонки вносят гидролизат белка, затем начинают вымывание); 3 - раствор нингидрина; 4 - водяная баня (подогревание необходимо для ускорения реакции нингидрина с аминокислотами); 5 - спектрофотометр и записывающее устройство; 6 - хроматограмма, каждый пик которой соответствует одной аминокислоте, а площадь пика пропорциональна концентрации аминокислоты в гидролизате.
