
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •2. Окислительно-восстановительные реакции в олимпиадных задачах Классификация овр
- •Составление уравнений методом электронного баланса
- •Алгоритм составления овр
- •Примеры
- •Реальные механизмы овр
- •Влияние условий на овр, расчет возможности протекания овр
- •1. Влияние температуры на течение овр
- •2. Влияние соотношения реагентов на протекание овр
- •3.3. Закономерности влияния среды на протекание овр
- •Примеры:
- •4. Влияние разбавления на протекание овр
- •5. Влияние степени измельчения твёрдых реагентов на ход овр
- •3. Задания для самостоятельной работы
4. Влияние разбавления на протекание овр
Сера и медь не реагируют с разбавленной серной кислотой, но окисляются концентрированной:
S + H2SO4(р)
+ H2SO4(р)
S + 2H2SO4(конц) = 3SO2 + 2H2O;
C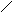 u
+ H2SO4(р)
=
u
+ H2SO4(р)
=
Cu + 2H2SO4(конц) = CuSO4 + SO2 + H2O.
При разбавлении окислитель средней силы H2SO4 диссоциирует и образует стабильный, симметричный гидратированный сульфат-ион SO42 • nH2O, в котором S+6 не проявляет окислительных свойств и слабый окислитель H3O+, который не способен окислить ни серу, ни медь.
5. Влияние степени измельчения твёрдых реагентов на ход овр
При измельчении за счет увеличения площади контакта скорость гетерогенных ОВР увеличивается, а глубина может уменьшиться. Это можно легко показать на примере окисления металлов. Если в системе типа “металл раствор кислоты” наблюдается разогревание и образование газообразных продуктов, то нагревание:
а) ухудшает адсорбцию первичных газообразных продуктов восстановления кислоты на поверхности металла;
б) уменьшает растворимость этих же продуктов в растворе;
в) не дает кислоте восстановится глубоко.
Гранулированный цинк холодную концентрированную азотную кислоту восстанавливает до NO; цинковая пыль – до NO2:
3Zn(гр) + 8HNO3(конц) = 3Zn(NO3)2 + 2NO + 4H2O,
Zn(пыль) + 4HNO3(конц) = Zn(NO3)2 + 2NO2 + 2H2O.
Влияние степени измельчения хорошо наблюдается и в ОВР углерода: кристаллический углерод (sp3 алмаз) не реагирует с кислотами; пылевидный углерод (sp2 графит) окисляется и серной и азотной концентрированными кислотами:
С(пыль) + 2H2SO4(конц) = 2SO2 + CO2 + 2H2O;
С(пыль) + 4HNO3(конц) = CO2 + 4NO2 + 2H2O.
3. Задания для самостоятельной работы
1. Расставьте коэффициенты методом электронного баланса в следующих уравнениях:
1) As2S3 + HNO3 NO2 + H3AsO4 + H2O + H2SO4;
2) Сu + HNO3 Cu(NO3)2 + NO + H2O;
3) Н2O2 + PbO2 + CH3COOH O2 + Pb(CH3COO)2 + H2O;
4) SO2 + Fe2(SO4)3 + H2O H2SO4 + FeSO4;
5) Al + H2SO4 + KClO4 Al2(SO4)3 + KCl + H2O.
2. Расставьте коэффициенты методом электронно-ионного баланса:
1) КCrO2 + H2O2 + KOH K2CrO4 + H2O,
2) Na2SeO3 + Cl2 + NaOH Na2SeO4 + NaCl + H2O,
3) KClO3 + KOH + MnSO4 K2MnO4 + KCl + K2SO4 + H2O.
4) Pb3O4 + H2 = Pb + H2O
Допишите уравнения
5). P + HNO3(k) = H3PO4 + …
6) H2O2 + KOH + MnSO4 = …
7) I2 + Cl2(избыток) + H2O = …
8) P + K2Cr2O7 + H2SO4 = ….. + …
9) H(H2PO2) + HNO3 =…..
10. CuFeS2 + HNO3(к) = ...
1 Окислительно-восстановительный потенциал дихромат-ионов в кислой среде 0(Cr2O7/2Cr3+) = 1,36 В. О потенциалах см. ниже.
