
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •2. Окислительно-восстановительные реакции в олимпиадных задачах Классификация овр
- •Составление уравнений методом электронного баланса
- •Алгоритм составления овр
- •Примеры
- •Реальные механизмы овр
- •Влияние условий на овр, расчет возможности протекания овр
- •1. Влияние температуры на течение овр
- •2. Влияние соотношения реагентов на протекание овр
- •3.3. Закономерности влияния среды на протекание овр
- •Примеры:
- •4. Влияние разбавления на протекание овр
- •5. Влияние степени измельчения твёрдых реагентов на ход овр
- •3. Задания для самостоятельной работы
3.3. Закономерности влияния среды на протекание овр
Как отмечалось ранее, реакция окисления – восстановления могут протекать в различных средах: в кислой (избыток Н+ - ионов),
в нейтральной (Н2О),
в щелочной (избыток ОН- - ионов).
В зависимости от среды может изменяться характер протекания реакций между одними и теми же веществами. Среда влияет на изменение степеней окисления атомов. Рассмотрим несколько общеизвестных примеров.
Так, ион MnO4, придающий раствору малиновую окраску, в кислой среде (рН < 7) восстанавливается до Mn2+ (с.о. Mn = + 2), в нейтральной среде (рН = 7) – до MnO2 (с.о. Mn = + 4), в щелочной среде (рН > 7) – до MnO42 (с.о. Mn = + 6). Или схематично:
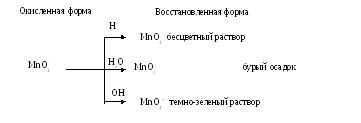
2KMnO4 + 5Na2SO3 + 3H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O;
ПРОДУКТ БЕСЦВЕТНЫЙ
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH;
КОРИЧНЕВЫЙ ОСАДОК
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O.
ПРОДУКТ ТЕМНО-ЗЕЛЕНЫЙ
Пероксид водорода восстанавливается также в зависимости от среды:
Н+
 Н2О2
+ 2Н+ + 2
Н2О2
+ 2Н+ + 2![]() 2Н2О
2Н2О
 Н2О2
Н2О2
Н2О2
+ 2![]() 2ОН
2ОН Н2О, ОН
Н2О, ОН
В данном случае Н2О2 выступает как окислитель, но может быть и восстановителем, встречаясь с очень сильным окислителем (КMnO4, (NH4)2S2O8):
Н2О2 – 2ē О2 + 2Н+.
Примеры:
1 .
FeSO4
+ H2O2
+ H2SO4
Fe2(SO4)3
+ H2O;
.
FeSO4
+ H2O2
+ H2SO4
Fe2(SO4)3
+ H2O;
Полуреакция восстановления H2O2 + 2H+ + 2ē 2Н2O 1
Полуреакция окисления Fe2+ - ē Fe3+ 2
2Fe2+ + H2O2 + 2H+ = 2H2O + Fe3+,
2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O.
2. KI + H2O2 = I2 + KOH;
П олуреакция
восстановления H2O2
+ 2ē 2 OН
1
олуреакция
восстановления H2O2
+ 2ē 2 OН
1
Полуреакция окисления 2I - 2ē I2 1
2I + H2O2 = I2 + 2OH ,
2KI + H2O2 = I2 + 2KOH.
В предложенных реакциях пероксид водорода выступал в роли окислителя. Рассмотрим пример ОВР, в которой H2O2 ведёт себя как восстановитель:
H2O2 + KMnO4 + H2SO4 O2 + MnSO4 + K2SO4 + H2O;
 Полуреакция
восстановления MnO4
+ 8H+ + 5ē
Mn2+ + 4H2O 2
Полуреакция
восстановления MnO4
+ 8H+ + 5ē
Mn2+ + 4H2O 2
Полуреакция окисления H2O2 - 2ē O2 + 2H+ 5
5H2O2 + 2MnO4 + 6H+ = 5O2 + 2Mn2+ + 8H2O,
5H2O2 + 2KMnO4 + 3H2SO4 5O2 + 2MnSO4 + K2SO4 + 8H2O.
ещё ярче влияние среды сказывается на окислительных свойствах солей хрома (VI). Если в кислой среде дихромат-ион ведёт себя как сильный окислитель1:
Cr2O72 + 14H+ + 6е = 2Cr3+ + 7H2O, 0(Cr2O72/2Cr3+) =1,36 В;
то в нейтральной, и тем более в щелочной среде хромат практически не проявляет окислительных свойств.
В общем же, в соединениях, в которых хром имеет устойчивую степень окисления: +6 (соединения хрома проявляют свойства окислителей); +2 или +3 (соединения хрома проявляют свойства восстановителей и окислителей).
В зависимости от среды имеют место переходы:
2СrO42
+ 2H+
![]() Cr2O72
+ H2O.
Cr2O72
+ H2O.
При рН < 7 ход окислительно-восстановительной реакции можно изобразить схемой: Cr2O72 / Cr3+ .
В щелочной среде для твердофазных реакций: СrO2 / CrO42 .
В щелочной среде в растворе (рН > 7): [Сr(OH)6]3/ CrO42 .
