
- •Электролитическая диссоциация веществ
- •Электролиты. Неэлектролиты.
- •Теория электролитической диссоциации.
- •Свойства ионов
- •Механизм электролитической диссоциации. Гидратация ионов.
- •I. Механизм диссоциации электролитов с ионной связью в водных растворах
- •II. Механизм диссоциации электролитов с ковалентной полярной связью в водных растворах
- •Степень диссоциации.
- •Химическое равновесие. Закон действующих масс. Константа равновесия. Константа диссоциации.
- •Диссоциация кислот, оснований и солей. Амфолиты.
- •Реакции ионного обмена.
- •Правила написания реакций ионного обмена в растворах электролитов
- •Обратимые и необратимые реакции.
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации.
- •Качественные реакции на катионы и анионы.
- •Качественные реакции на катионы и анионы
- •Гидролиз. Гидролиз солей.
- •I. Понятие о гидролизе.
- •II. Типы солей.
- •III. Типы гидролиза
- •IV. Ступенчатость гидролиза
- •V. Степень гидролиза
- •VI. Практическая значимость гидролиза
- •Электролитическая диссоциация веществ
- •Электролитическая диссоциация веществ
Качественные реакции на катионы и анионы.
Для основных классов неорганических соединений (кислот, оснований и солей) характерны не только общие свойства, но специфические. Одной из групп специфических свойств являются качественные реакции, которые позволяют отличить катионы и анионы (например, благодаря данным реакциям можно отличить катионы натрия от катионов бария, хлорид-ионы от сульфат-ионов и др.). Самые распространённые качественные реакции представлены в таблице.
Таблица 2
Качественные реакции на катионы и анионы
|
Определяемый ион |
Реактив |
Внешний признак реакции |
|
Катионы |
||
|
Н+ |
Индикаторы |
Изменение окраски |
|
Ag+ |
Сl- |
Белый осадок |
|
Na+ |
Пламя |
Цвет пламени жёлтый (через кобальтовое стекло) |
|
К+ |
Пламя |
Цвет пламени фиолетовый (через кобальтовое стекло) |
|
NH4+ |
OH- |
Запах аммиака |
|
Са2+ |
СО32- |
Белый осадок |
|
Сu2+ |
ОН- S2- Пламя |
Синий осадок Чёрный осадок Цвет пламени сине-зелёный |
|
Ba2+ |
SO42- |
Белый осадок |
|
Zn2+ |
ОН- S2- |
Белый осадок, при избытке ОН- растворяется Белый осадок |
|
Fe2+ |
OH- |
Хлопьевидный осадок зеленоватого цвета |
|
Fe3+ |
OH- |
Осадок бурого цвета |
|
Al3+ |
OH- |
Белый осадок, при избытке OH- растворяется |
|
Анионы |
||
|
OH- |
Индикаторы |
Изменение окраски |
|
Cl- |
Ag+ H2SO4 |
Белый осадок Выделение газа с резким запахом (HCl) |
|
Br- |
Ag+ H2SO4 |
Жёлтоватый осадок Выделение бесцветного SO2 и Br2 (бурый цвет) |
|
I- |
Ag+ H2SO4 |
Жёлтый осадок Выделение Н2S (запах тухлых яиц) и I2 (фиолетовый цвет) |
|
S2- |
H+ Pb2+ |
Выделение Н2S (запах тухлых яиц) Чёрный осадок |
|
SO32- |
H+ |
Выделение SO2 (резкий запах), обесцвечивает раствор фуксина и фиолетовых чернил |
|
СО32- |
Н+ |
Выделение СО2, вызывающего помутнение известковой воды Са(ОН)2 |
|
NO3- |
H2SO4(конц.) и Сu |
Выделение бурого газа NO2 |
|
SO42- |
Ba2+ |
Белый осадок |
|
РО43- |
Ag+ |
Жёлтый осадок |
Рассмотрим несколько задач с использованием качественных реакций.
Задача 1. В двух пробирках находятся бесцветные растворы нитрата серебра и нитрата натрия. Предложите способ, с помощью которого можно отличить содержимое каждой пробирки.
Решение:
Так как предложено два нитрата, то отличить эти вещества по аниону становится невозможным. Следовательно, для определения каждой соли используем качественные реакции на катионы. Используя данные таблицы, можно предложить отличие этих соединений путём приливания к каждому нитрату раствор ортофосфата калия.
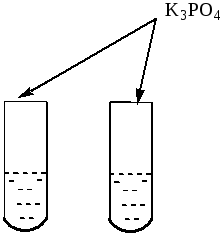
П осле
того как в каждую пробирку был добавлен
раствор ортофосфата калия, в одной из
пробирок выпал осадок жёлтого цвета.
осле
того как в каждую пробирку был добавлен
раствор ортофосфата калия, в одной из
пробирок выпал осадок жёлтого цвета.
Рис 13 До приливания ортофосфата калия Результат опыта
Запишем уравнения происходящих процессов:
1. Взаимодействие растворов ортофосфата калия и нитрата серебра.
3AgNO3 + K3PO4 Ag3PO4 + 3KNO3
3Ag+ + 3NO3- + 3K+ + PO43- Ag3PO4 + 3K+ + 3NO3-
3Ag+ + PO43- Ag3PO4
жёлтый осадок
2. Взаимодействие растворов ортофосфата калия и нитрата натрия.
3NaNO3 + K3PO4
![]() Na3PO4
+ 3KNO3
Na3PO4
+ 3KNO3
Так как ни одно из условий протекания реакций до конца не соблюдается, и все вещества являются сильными электролитами, то все ионы остаются в растворе. Никаких изменений не наблюдается. Реакция не идёт.
3![]() NaNO3
+ K3PO4
NaNO3
+ K3PO4
Вывод: с помощью реактива ортофосфата калия отличили нитрат натрия от нитрата серебра.
Данные задачи называются качественными, так как для их решения не требуется никаких расчётов. Такие задачи могут включать в себя и количественные данные (по разным причинам), хотя они уже будут вспомогательными для общего решения.
Задачи для самостоятельного решения:
Задача 1. Предложите способ отличия хлорида бария от хлорида меди (II).
Задача 2. Предложите способ отличия гидроксида бария от гидроксида натрия.
Задача 3. Предложите способ отличия гидроксида бария от хлорида бария.
Задача 4. Предложите способ отличия соляной кислоты от серной кислоты.
Задача 5. Предложите способ отличия соляной кислоты от гидроксида натрия.
Усложнённый вариант:
Задача 1. Имея в наличии любые реактивы, предложите способ отличия растворов следующих веществ: соляной кислоты, хлорида бария, гидроксида бария.
Задача 2*. Имея в наличии только растворы соляной и серной кислот, предложите способ отличия растворов карбоната натрия, хлорида бария, нитрата серебра, сульфата меди (II).
Задача 3**. В лаборатории имеются растворы хлорида натрия, сульфата натрия, гидроксида бария, сульфата меди (II). Не используя никаких дополнительных реактивов, предложите способ их отличия.
Лекция 11
