
- •Электролитическая диссоциация веществ
- •Электролиты. Неэлектролиты.
- •Теория электролитической диссоциации.
- •Свойства ионов
- •Механизм электролитической диссоциации. Гидратация ионов.
- •I. Механизм диссоциации электролитов с ионной связью в водных растворах
- •II. Механизм диссоциации электролитов с ковалентной полярной связью в водных растворах
- •Степень диссоциации.
- •Химическое равновесие. Закон действующих масс. Константа равновесия. Константа диссоциации.
- •Диссоциация кислот, оснований и солей. Амфолиты.
- •Реакции ионного обмена.
- •Правила написания реакций ионного обмена в растворах электролитов
- •Обратимые и необратимые реакции.
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации.
- •Качественные реакции на катионы и анионы.
- •Качественные реакции на катионы и анионы
- •Гидролиз. Гидролиз солей.
- •I. Понятие о гидролизе.
- •II. Типы солей.
- •III. Типы гидролиза
- •IV. Ступенчатость гидролиза
- •V. Степень гидролиза
- •VI. Практическая значимость гидролиза
- •Электролитическая диссоциация веществ
- •Электролитическая диссоциация веществ
Диссоциация кислот, оснований и солей. Амфолиты.
Диссоциацию кислот, оснований и солей мы будем рассматривать в водных растворах. При этом необходимо отметить, что в данном случае оксиды будут неэлектролитами и, если вещество нерастворимо в воде, то оно также является неэлектролитом (хотя вам известно, что есть вещества, которые в воде растворяются, но являются неэлектролитами).
Диссоциация кислот
● Кислоты – это электролиты, при диссоциации которых в качестве катиона образуются только катионы водорода Н+.
Необходимо знать, что сильные кислоты нацело диссоциируют на катионы водорода и кислотный остаток, тогда как слабые кислоты диссоциируют ступенчато.
Сильные кислоты:
HNO3
![]() H+ + NO3-
H+ + NO3-
(без учёта молекул воды, т.е. упрощённый вариант записи электролитической диссоциации). Так как при диссоциации образуются протоны (катионы водорода), а процесс протекает в водном растворе, то происходит протонизация молекул воды. Образуется ион-гидроксония (смотри лекцию 3). Следовательно, правильнее записывать уравнение электролитической диссоциации следующим образом:
HNO3 + Н2О
![]() H3О+ + NO3-
H3О+ + NO3-
При написании уравнений реакций электролитической диссоциации необходимо учитывать, что суммарно заряды левой и правой частей уравнений должны быть одинаковыми.
Рассмотрим другие примеры диссоциации сильных кислот:
HClO4
![]() H+ +
ClO4-
H+ +
ClO4-
H2SO4
![]() 2H+ +
SO42-
2H+ +
SO42-
Слабые кислоты:
Слабые кислоты диссоциируют ступенчато. Количество ступеней зависит от основности кислоты (основность кислоты определяется числом атомов водорода, способных замещаться на металл).
Одноосновная кислота:
HF
![]() H+ + F-
H+ + F-
Двухосновная кислота:
H2SO3
![]() H+ + HSO3-
(I ступень)
H+ + HSO3-
(I ступень)
HSO3-
![]() H+ +
SO32-
(II ступень)
H+ +
SO32-
(II ступень)
При этом необходимо помнить, что константы диссоциации по каждой ступени будут отличаться:
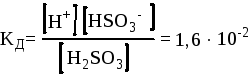
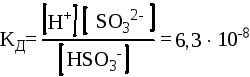
Для первой ступени Для второй ступени
При диссоциации веществ по ступеням, константа диссоциации с каждым разом становится меньше. Это связано с тем, что при диссоциации вещества на первой ступени отрыв протона происходит от нейтральной молекулы вещества, а на второй уже от заряженного аниона. Отрыв протона (как и любой другой частицы) от иона всегда протекает труднее (энергетические затраты увеличиваются).
Диссоциация оснований
● Основания – это электролиты, при диссоциации которых в качестве аниона всегда образуются только гидроксид-ионы ОН-. Сильные основания диссоциируют нацело, слабые – по ступеням.
Сильные основания:
КOН
![]() К+ + OН-
К+ + OН-
Ва(OН)2
![]() Ва2+ + 2OН-
Ва2+ + 2OН-
Слабые основания:
Слабые основания диссоциируют ступенчато. Количество ступеней зависит от кислотности оснований (количество гидроксильных групп, способных замещаться на кислотный остаток).
Двухкислотное основание:
Сd(OН)2
![]() CdOH+ + OН-
CdOH+ + OН-
CdOН+
![]() Cd2+ + OН-
Cd2+ + OН-
При этом необходимо помнить, что константы диссоциации по каждой ступени будут отличаться:
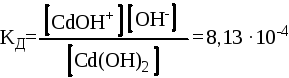
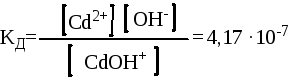
Для первой ступени Для второй ступени
Несмотря на то, что гидроксид кадмия (II) в воде не растворяется, диссоциацию его мы можем записать. Это объясняется тем, что абсолютно нерастворимых веществ в воде не существует. Следовательно, в той части гидроксида кобальта (II), которая в воде растворяется, будет протекать электролитическая диссоциация.
Диссоциация солей
● Средние соли – это электролиты, при диссоциации которых в качестве катиона образуются катионы металла (или ион аммония NH4+), а качестве аниона – анионы кислотного остатка. Растворимые в воде соли диссоциируют нацело:
NaNO3
![]() Na+ + NO3-
Na+ + NO3-
Na2SO4
![]() 2Na+ + SO42-
2Na+ + SO42-
Fe2(SO4)3
![]() 2Fe3+ + 3SO42-
2Fe3+ + 3SO42-
● Амфолиты – это вещества проявляющие двойственную природу свойств (амфотерность) и при диссоциации одновременно могут образовывать катионы водорода Н+ (как кислоты) и гидроксид-анионы ОН- (как основания).
В чистой воде протекает реакция (условно):
Н2O
![]() Н+ + ОН-
Н+ + ОН-
Н2O + Н+
![]() Н3О+
Н3О+
Суммарно: Н2О
+ Н2О
![]() Н3О+ + ОН-
Н3О+ + ОН-
Следовательно, вода – типичный амфолит, так как она диссоциирует и как кислота, и как основание.
Рассмотрим диссоциацию амфотерных гидроксидов (например, Zn(OH)2 и Al(OH)3). В зависимости от другого реагента, данные гидроксиды могут проявлять свойства как оснований, так и кислоты. Поэтому они диссоциируют по типу кислоты и по типу основания. Не рассматривая ступенчатость процессов, уравнения электролитической диссоциации этих веществ можно записать следующим образом:
![]() 2H+
+ ZnO22-
2H+
+ ZnO22-![]() H2ZnO2
Zn(OH)2
H2ZnO2
Zn(OH)2
![]() Zn2+ +
2OH-
Zn2+ +
2OH-
3![]() H+
+ AlO33-
H+
+ AlO33-![]() H3AlO3
Al(OH)3
H3AlO3
Al(OH)3
![]() Al3+ +
3OH-
Al3+ +
3OH-
Необходимо помнить, что данные гидроксиды в воде не растворяются. Следовательно, электролитическая диссоциация данных веществ протекает лишь только в той области, в которой данные гидроксиды растворимы в воде.
Лекция 7
