
- •Электролитическая диссоциация веществ
- •Электролиты. Неэлектролиты.
- •Теория электролитической диссоциации.
- •Свойства ионов
- •Механизм электролитической диссоциации. Гидратация ионов.
- •I. Механизм диссоциации электролитов с ионной связью в водных растворах
- •II. Механизм диссоциации электролитов с ковалентной полярной связью в водных растворах
- •Степень диссоциации.
- •Химическое равновесие. Закон действующих масс. Константа равновесия. Константа диссоциации.
- •Диссоциация кислот, оснований и солей. Амфолиты.
- •Реакции ионного обмена.
- •Правила написания реакций ионного обмена в растворах электролитов
- •Обратимые и необратимые реакции.
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации.
- •Качественные реакции на катионы и анионы.
- •Качественные реакции на катионы и анионы
- •Гидролиз. Гидролиз солей.
- •I. Понятие о гидролизе.
- •II. Типы солей.
- •III. Типы гидролиза
- •IV. Ступенчатость гидролиза
- •V. Степень гидролиза
- •VI. Практическая значимость гидролиза
- •Электролитическая диссоциация веществ
- •Электролитическая диссоциация веществ
Степень диссоциации.
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остаётся в растворе в недиссоциированном виде.
● Число, показывающее, какая часть молекул электролита распалась на ионы, называется степенью электролитической диссоциации ().
![]()
Степень электролитической диссоциации () равна отношению числа молекул, которые распались на ионы, к общему числу молекул в растворе.
Например, если степень диссоциации азотистой кислоты равна 10%, то это означает, что из 100 молекул азотистой кислоты только 10 распались на ионы.
Необходимо отметить, что степень электролитической диссоциации может быть выражена в процентах, а также в долях единицы. Например: (HNO2)=10% или (HNO2)=0,1. Данные записи абсолютно равнозначны.
● Факторы, влияющие на степень диссоциации:
-
При повышении температуры степень диссоциации, как правило, увеличивается.
-
При уменьшении концентрации электролита, т.е. при разбавлении раствора, степень диссоциации увеличивается, так как увеличиваются расстояния между ионами в растворе и уменьшается возможность соединения их в молекулы.
В зависимости от степени диссоциации
различают сильные и слабые электролиты
(иногда указывают электролиты средней
силы).
зависимости от степени диссоциации
различают сильные и слабые электролиты
(иногда указывают электролиты средней
силы).
Схема 2
Классификация электролитов в зависимости от степени диссоциации
Чаще всего электролиты делят на сильные ( 30%) и слабые ( 30%).
Сильные электролиты: 1) большинство растворимых солей; 2) кислоты: НClO4, НClO3, HNO3, H2SO4, HCl, HBr, HI; 3) щёлочи: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Слабые электролиты: 1) кислоты: НClO2, НClO, HNO2, H2SO3, H2СO3, H2SiO3, H3PO4, H3PO3, H3BO3, H2S, HCN, HF и др.; 2) нерастворимые или малорастворимые в воде основания: Fe(OH)2, Pb(OH)2, Cu(OH)2 и др.; 3) гидроксид аммония NH4OH; 4) вода.
Лекция 5
Химическое равновесие. Закон действующих масс. Константа равновесия. Константа диссоциации.
Рассмотрим реакцию диссоциации азотистой кислоты (слабого электролита):
HNO2
![]() H+ + NO2-
H+ + NO2-
Данная запись означает, что данный процесс протекает в двух противоположных направлениях: молекулы азотистой кислоты диссоциируют (прямая реакция) и ассоциируют (обратная реакция).
● Химические реакции, которые при одних и тех же условиях могут идти в двух противоположных направлениях, называются обратимыми.
Любой процесс идёт с определённой скоростью.
● Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ с учётом коэффициентов (закон действующих масс). Рассмотрим обратимую реакцию:
аА + bВ
![]() сС + dD
сС + dD
Скорость прямой реакции равна: прямой = kпрямойАаВb
Скорость обратной реакции равна: обратной = kобратнойАаВb
k-коэффициент пропорциональности, который называется константой скорости реакции.
В случае диссоциации сначала скорость прямой реакции резко увеличивается. При достижении определённой концентрации ионов в растворе скорость обратного процесса (ассоциации) начинает увеличиваться. Через определённый промежуток времени скорость прямой и обратной реакции станут одинаковыми и в системе наступит химическое равновесие.
● Химическое равновесие – это состояние системы, при котором скорости прямой и обратной реакции равны.
Химическое равновесие является динамическим равновесием. Скорость прямой и обратной реакций равны и имеют некоторое постоянное значение (константа).
прямой = обратной
kпрямойАаВb = kобратнойАаВb
Т огда
огда
●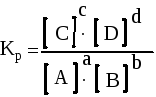 Отношение констант скоростей прямой и
обратной реакций является величиной
постоянной и называется константой
равновесия (Кр):
Отношение констант скоростей прямой и
обратной реакций является величиной
постоянной и называется константой
равновесия (Кр):
![]()
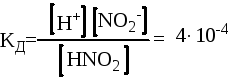 Для
характеристики слабых электролитов
применяют константу диссоциации (КД).
Вследствие того, что слабые электролиты
диссоциируют на ионы не полностью, в их
растворах устанавливается динамическое
равновесие между недиссоциированными
молекулами и ионами. Константу равновесия
в этом случае называют константой
диссоциации КД. В случае азотистой
кислоты выражение КД будет
записано:
Для
характеристики слабых электролитов
применяют константу диссоциации (КД).
Вследствие того, что слабые электролиты
диссоциируют на ионы не полностью, в их
растворах устанавливается динамическое
равновесие между недиссоциированными
молекулами и ионами. Константу равновесия
в этом случае называют константой
диссоциации КД. В случае азотистой
кислоты выражение КД будет
записано:
Чем меньше константа диссоциации, тем слабее электролит.
Для слабого электролита константа диссоциации – величина постоянная при данной температуре, которая не зависит от концентрации раствора. Константа диссоциации зависит от природы растворителя, природы электролита и температуры.
Лекция 6
