
- •Электролитическая диссоциация веществ
- •Электролиты. Неэлектролиты.
- •Теория электролитической диссоциации.
- •Свойства ионов
- •Механизм электролитической диссоциации. Гидратация ионов.
- •I. Механизм диссоциации электролитов с ионной связью в водных растворах
- •II. Механизм диссоциации электролитов с ковалентной полярной связью в водных растворах
- •Степень диссоциации.
- •Химическое равновесие. Закон действующих масс. Константа равновесия. Константа диссоциации.
- •Диссоциация кислот, оснований и солей. Амфолиты.
- •Реакции ионного обмена.
- •Правила написания реакций ионного обмена в растворах электролитов
- •Обратимые и необратимые реакции.
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации.
- •Качественные реакции на катионы и анионы.
- •Качественные реакции на катионы и анионы
- •Гидролиз. Гидролиз солей.
- •I. Понятие о гидролизе.
- •II. Типы солей.
- •III. Типы гидролиза
- •IV. Ступенчатость гидролиза
- •V. Степень гидролиза
- •VI. Практическая значимость гидролиза
- •Электролитическая диссоциация веществ
- •Электролитическая диссоциация веществ
Теория электролитической диссоциации.
Для объяснения электропроводности растворов и расплавов солей, кислот и оснований шведский учёный Сванте Август Аррениус создал в 1887 году теорию электролитической диссоциации.
Основные положения теории электролитической диссоциации веществ (ТЭД):
1. Молекулы электролитов при растворении или расплавлении распадаются на ионы.
● Процесс распада молекул электролитов
на ионы в растворе или в расплаве
называется электролитической
диссоциацией.
Процесс распада молекул электролитов
на ионы в растворе или в расплаве
называется электролитической
диссоциацией.
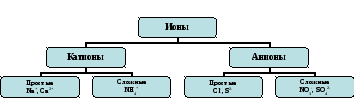
Ионы – это атомы или группы атомов, имеющие положительный или отрицательный заряд.
Схема 1
2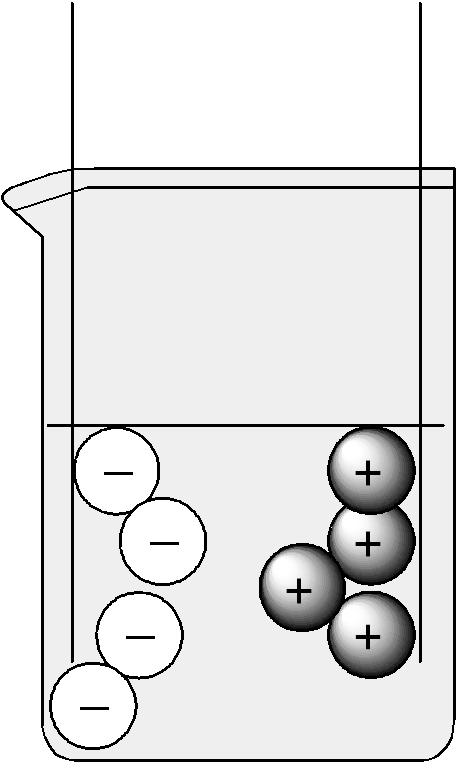 .
В растворе или расплаве электролитов
ионы движутся хаотически. При пропускании
через раствор или расплав электрического
тока положительно заряженные ионы
движутся к отрицательно заряженному
электроду (катоду), а отрицательно
заряженные ионы движутся к положительно
заряженному электроду (аноду). Поэтому
положительные ионы называются катионами,
отрицательные ионы – анионами.
.
В растворе или расплаве электролитов
ионы движутся хаотически. При пропускании
через раствор или расплав электрического
тока положительно заряженные ионы
движутся к отрицательно заряженному
электроду (катоду), а отрицательно
заряженные ионы движутся к положительно
заряженному электроду (аноду). Поэтому
положительные ионы называются катионами,
отрицательные ионы – анионами.
Анод (+) Катод (-)
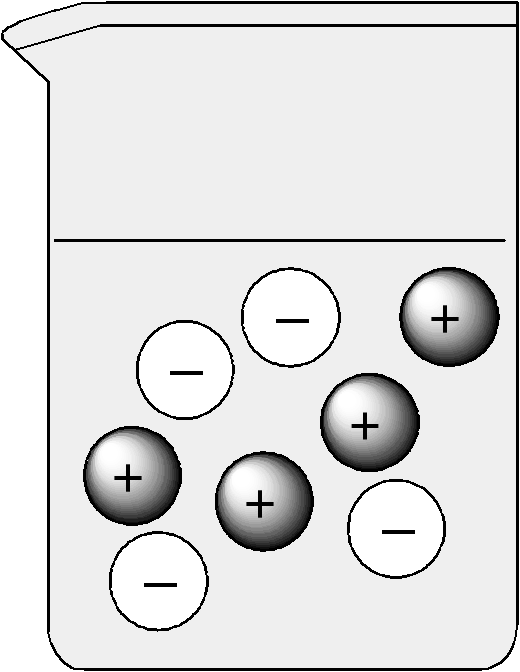
Рис 4 Хаотическое движение Рис 5 Направленное движение ионов
ионов при пропускании электрического тока
3. Диссоциация – процесс обратимый. Это
значит, что одновременно идут два
противоположных процесса: распад молекул
на ионы (диссоциация) и соединение ионов
в молекулы (ассоциация). Диссоциацию
молекул электролитов выражают уравнениями,
в которых вместо стрелки или знака
равенства ставят знак обратимости
![]() .
В левой части уравнения записывают
формулу молекулы электролита, в правой
– формулы ионов, которые образуются в
процессе электролитической диссоциации.
Например:
.
В левой части уравнения записывают
формулу молекулы электролита, в правой
– формулы ионов, которые образуются в
процессе электролитической диссоциации.
Например:
NaNO3
![]() Na+
+ NO3-
Na+
+ NO3-
Каждая молекула нитрата натрия диссоциирует на катион натрия и нитрат-анион. Следовательно, при диссоциации одной молекулы нитрата натрия образуется два иона.
Общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку, так как растворы электролитов электронейтральны.
Свойства ионов
Ионы по своим физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Различные свойства атомов и ионов одного и того же элемента объясняется разным электронным строением этих частиц. Химические свойства свободных атомов металлов определяются валентными электронами, которые атомы металлов легко отдают и переходят в положительно заряженные ионы (катионы). Атомы неметаллов легко присоединяют электроны и переходят в отрицательно заряженные ионы (анионы). Ионы находятся в более устойчивых электронных состояниях, чем атомы.
Таблица 1
Сравнительная характеристика нейтральных атомов и ионов
|
Критерии сравнения |
Натрий Na |
Катион натрия Na+ |
Хлор Cl2 |
Ион хлора Cl- |
|
Электронная формула |
1s22s22p63s1 |
1s22s22p6 |
1s22s22p63s23p5 |
1s22s22p63s23p6 |
|
Цвет |
Серебристо-белый |
Бесцветный |
Жёлто-зелёный |
Бесцветный |
|
Запах, опасность |
Без запаха, вызывает ожоги |
Без запаха, безопасен |
Резкий запах, ядовит |
Без запаха, не ядовит |
|
Взаимодействие с водой |
2Na + 2H2O → 2NaOH + H2 |
Не реагирует |
Cl2 + H2O → HClO + HCl |
Не реагирует |
Ионы имеют различную окраску. Гидратированные и негидратированные ионы s- и p-элементов обычно бесцветны. Например, бесцветны ионы Н+, К+, Ва2+, Аl3+ и другие. Ионы некоторых d-элементов имеют окраску, причём окраска гидратированных и негидратированных ионов одного и того же d-элемента может быть различной. Например, негидратированные ионы меди Cu2+ - бесцветные, а гидратированные ионы меди – синего цвета1.
В дальнейшем основные положения теории электролитической диссоциации были развиты в трудах русских химиков И.А.Каблукова и В.А.Кистяковского.
Лекция 3
