
- •Электролитическая диссоциация веществ
- •Электролиты. Неэлектролиты.
- •Теория электролитической диссоциации.
- •Свойства ионов
- •Механизм электролитической диссоциации. Гидратация ионов.
- •I. Механизм диссоциации электролитов с ионной связью в водных растворах
- •II. Механизм диссоциации электролитов с ковалентной полярной связью в водных растворах
- •Степень диссоциации.
- •Химическое равновесие. Закон действующих масс. Константа равновесия. Константа диссоциации.
- •Диссоциация кислот, оснований и солей. Амфолиты.
- •Реакции ионного обмена.
- •Правила написания реакций ионного обмена в растворах электролитов
- •Обратимые и необратимые реакции.
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации.
- •Качественные реакции на катионы и анионы.
- •Качественные реакции на катионы и анионы
- •Гидролиз. Гидролиз солей.
- •I. Понятие о гидролизе.
- •II. Типы солей.
- •III. Типы гидролиза
- •IV. Ступенчатость гидролиза
- •V. Степень гидролиза
- •VI. Практическая значимость гидролиза
- •Электролитическая диссоциация веществ
- •Электролитическая диссоциация веществ
Механизм электролитической диссоциации. Гидратация ионов.
Причины и механизм диссоциации электролитов объясняются химической (гидратной) теорией растворов Д.И.Менделеева и природой химической связи. Электролитами являются вещества с ионной или ковалентной сильно полярной связями. Растворители, в которых происходит диссоциация, состоят из полярных молекул. Например, вода – полярный растворитель. Диссоциация электролитов с ионной и полярной связями протекает различно.
![]() Вода
представляет собой диполь –
двухполюсная молекула, т.е. имеет два
поля зарядов «+» и «-» (молекула полярна)2.
Диполь схематически изображают .
Вода
представляет собой диполь –
двухполюсная молекула, т.е. имеет два
поля зарядов «+» и «-» (молекула полярна)2.
Диполь схематически изображают .
Растворители обладают способностью ослаблять химические связи в молекулах растворённых веществ – диэлектрическая проницаемость растворителя. У воды она равна 81, что означает: вода способна ослаблять химические связи в молекулах растворяемых веществ в 81 раз.
I. Механизм диссоциации электролитов с ионной связью в водных растворах
1. Растворение вещества с ионной связью в воде. Вода – полярный растворитель.
2. Происходит ориентация диполей воды вокруг ионов натрия и ионов хлора (рис 6).
П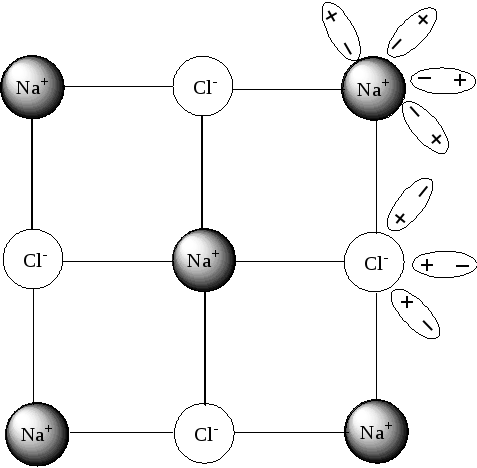 ри
этом химические связи между ионами
натрия и хлора ослабляются. Диполи воды
как бы «изымают» ионы из разрушающейся
кристаллической решётки хлорида натрия,
т.е. в результате химического взаимодействия
между молекулами растворителя и ионами
электролита, притяжение между ионами
в кристаллической решётки ослабевает.
Кристаллическая решётка разрушается,
и ионы переходят в раствор.
ри
этом химические связи между ионами
натрия и хлора ослабляются. Диполи воды
как бы «изымают» ионы из разрушающейся
кристаллической решётки хлорида натрия,
т.е. в результате химического взаимодействия
между молекулами растворителя и ионами
электролита, притяжение между ионами
в кристаллической решётки ослабевает.
Кристаллическая решётка разрушается,
и ионы переходят в раствор.
Рис 6 Ориентация диполей воды
3. Образование гидратированных ионов.
О бразующиеся
ионы в водном растворе находятся не в
свободном состоянии, а связаны с
молекулами воды, т.е. являются
гидратирован-ными ионами (рис 7).
бразующиеся
ионы в водном растворе находятся не в
свободном состоянии, а связаны с
молекулами воды, т.е. являются
гидратирован-ными ионами (рис 7).
Диссоциация ионных соединений в водном растворе происходит полностью.
Таким образом диссоциируют все растворимые в воде соли и щёлочи (КCl, NaCl, NaOH, КОН и др.).
Рис 7 Образование гидратированных ионов
II. Механизм диссоциации электролитов с ковалентной полярной связью в водных растворах
1. Растворение вещества с ковалентной полярной связью в воде (например НCl).
2. Так как в молекуле вещества нет ионов, то диполи воды ориентируются вокруг полюсов (рис 8).
П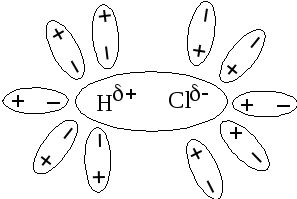 роисходит
взаимодействие диполей воды с молекулами
растворённого вещества. Диполи
ориентируются вокруг полюсов в молекуле
НСl.
роисходит
взаимодействие диполей воды с молекулами
растворённого вещества. Диполи
ориентируются вокруг полюсов в молекуле
НСl.
Рис 8 Ориентация диполей воды
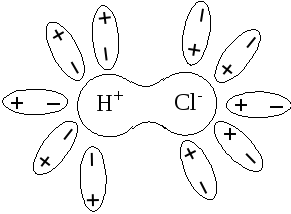
3. Поляризация связи в молекуле НСl.
 Под влиянием молекул воды изменяется
характер связи в
Под влиянием молекул воды изменяется
характер связи в
молекуле НСl: связь становится более полярной, т.е. диполи
воды как бы «растягивают» связь в НСl (рис 9).
Рис 9 Поляризация связи
4. Образование гидратированных ионов.
Р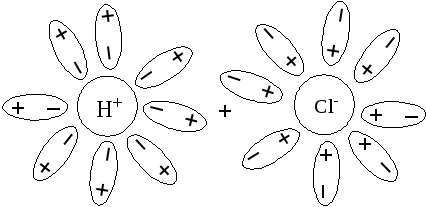 езультатом
процесса является диссоциация электролита
и образование в растворе гидратированных
ионов (рис 10).
езультатом
процесса является диссоциация электролита
и образование в растворе гидратированных
ионов (рис 10).
Таким образом диссоциируют кислородсодержа-щие и бескислородные кислоты: HCl, HBr, HI, HNO3, H2SO4 и другие. Диссоциация электролитов с полярной связью может быть полной или частичной. Это зависит от полярности связей в молекулах электролитов.
Рис 10 Гидратированные ионы
Причина диссоциации
Главной причиной диссоциации в водных растворах является гидратация ионов. В растворах электролитов все ионы находятся в гидратированном состоянии. Рассмотрим, гидратацию ионов водорода. Катион водорода Н+ (протон) соединяется с молекулой воды и образуется ион гидроксония3 Н3О+ по донорно-акцепторному механизму4:
Н2О + Н+ → Н3О+

или
структурные формулы иона гидроксония
Кислород выступает в качестве донора (предоставляет неподелённую электронную пару), катион водорода в качестве акцептора (предоставляет свободную атомную орбиталь).
Лекция 4
