- •У генетической информации – свой код.
- •Трансляция - один из сложнейших механизмов синтеза макромолекул.
- •Активирование аминокислот происходит в два этапа
- •Существуют два пути узнавания инициирующего кодона
- •Диссоциация рибосомы – необходимая предпосылка для инициации.
- •Малая рибосомная субъединица –главный исполнитель в сценарии инициации
- •Ингибиторы синтеза белков
- •Синтезированные на рибосомах белки доставляются к местам их деятельности разными путями.
- •Ограниченный протеолиз - обязательный механизм посттрансляционной модификации белков
- •Присоединение углеводов наиболее популярный способ пострибосомальной ковалентной модификации белков
- •Семейство с высоким содержанием маннозы
- •Углеводы белков клеточных поверхностей ответственны за клеточную специфичность.
- •Ацилирование помогает белкам встраиваться в мембраны
- •Метилирование аминокислотных остатков в белках встречается редко
- •Фосфорилирование белков в большинстве случаев обратимый процесс
- •Сульфатирование белков пример необратимой ковалентной модификации структуры белка.
- •Пренилирование – способ «заякоривания» белка в мембранах
- •Витамин с – кофактор гидроксилирования белков.
- •Витамин к помогает белкам приобрести свойство связывать кальций.
- •Р егуляция экспрессии генов
- •Регуляция на уровне транскрипции требует специфического взаимодействия днк и белков
- •Инициация транскрипции - основное место действия регуляторов на синтез белков у прокариот
- •Для инициации транскрипции у эукариот требуются дополнительные факторы
- •Регулировать экспрессию генов можно и после транскрипции
- •Аттенуация транскрипции один из возможных механизмов регуляции экспрессии генов.
- •Альтернативный сплайсинг рнк -своеобразная форма регуляции экспрессии генов
- •Транспорт рнк из ядра и последующее редактирование рнк могут быть объектом регуляции.
- •Продолжительность «жизни» иРнк можно регулировать .
Ограниченный протеолиз - обязательный механизм посттрансляционной модификации белков
После синтеза белка на рибосомах происходят не только описанные выше процессы целенаправленной сортировки белков, но одновременно вносятся значительные изменения в первичную структуру белковой молекулы. Большинство белков подвергается действию протеаз. Самая простая форма такого протеолиза - удаление инициирующего метионина. Многие белки синтезируются в форме неактивных предшественников, активирование которых происходит порой далеко от места их синтеза при помощи так называемого ограниченного протеолиза. Примерами могут служить секретируемые ферменты поджелудочной железы или ферменты системы свертывания крови. Неактивные предшественники таких белков, активируемых удалением дополнительных пептидов, названы пропротеинами. Термин препротеины используется для обозначения белков, содержащих сигнальные последовательности, которые также удаляются специфическими протеазами. Многие секретируемые белки (пропротеины) также имеют сигнальные последовательности. Ддя обозначения таких белков используют термин препропротеины. Посттрансляционный протеолиз в в ряде случаев может принимать сложный характер. Например, препроопиомеланотропин, синтезируемый гипофизом, или препроинсулин (см рис).
Присоединение углеводов наиболее популярный способ пострибосомальной ковалентной модификации белков
Присоединение углеводов одна из составляющих механизма сортировки белков в клетке. Многие полипептидные цепи, попадающие в полости ЭР, взаимодействуют с углеводами. Наиболее популярные моносахариды, участвующие в ковалентной модификации белков приводятся в следующей таблице
|
Таблица 10-7.Роль отдельных моносахаридов в ковалентной модификации структуры белков |
|||
|
тип |
Название |
активная форма |
Замечания |
|
гексоза, |
Галактоза, |
УДФ-Гал |
часто расположена субтерминально к N-ацетилнейрминовой кислоте, выделена из корового олигосахарида протеогликанов. |
|
гексоза, |
Глюкоза, |
УДФ-Глю |
обычно обнаруживается во время синтеза N-связанных гликопротеинов, но отсутствует в зрелых гликопротеинах |
|
гексоза |
Манноза |
ГДФ-Ман |
сахар N-связанных гликопротеинов |
|
|
N- ацетил нейраминовая кислота |
ГМФ-Нейрам |
наиболее частый терминальный сахар в гликопротеинах |
|
дезоксигексоза |
Фукоза, |
ГДФ-Фук |
встречается на концевых отделах гликопротеинов |
|
аминогексоза |
N- ацетилгалактозамин |
УДФ-Галамин |
выделен из всех гликопротеинов |
|
аминогексоза |
N- ацетилглюкозамин |
УДФ-Гламин |
выделен из всех гликопротеинов |
Тип связи между белком и углеводом - результат разных механизмов синтеза. В зависимости от типа связи между углеводной и белковой частями различают 2 типа гликопротеинов:
-
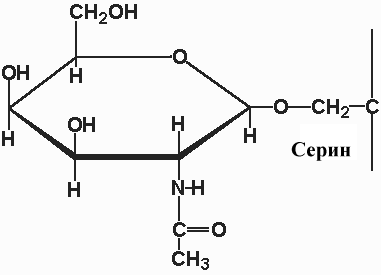
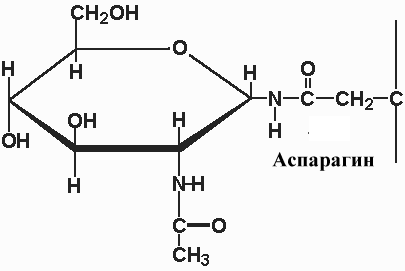
Гликопротеины с О- гликозидной связью между СЕР (ТРЕ) и N-ацетилгалактозамином, СЕР и ксилулозой или между гидроксилизином и галактозой (О-связанные гликопротеины)
-
Соединения с N- гликозидной связью между АСН и N-ацетилгалактозамином (N-связанные гликопротеины)
|
|
|
|
О-гликозидная связь |
N-гликозидная связь |
Полипептидные цепи (коровые белки) обоих типов гликопротеинов синтезируются на мембраносвязанных полирибосомах по матричному механизму синтеза,
Углеводная часть гликопротеина образуется по двум механизмам:
-
Олигосахаридные цепи О-связанных гликопротеинов образуются путем постепенного добавления моносахаридов к образованной полипептидной цепи, Ферменты, которые катализируют этот процесс - мембраносвязанные гликозилтрансферазы. Синтез самих ферментов контролируется отдельными генами. Образование одного типа связи требует отдельного специфического фермента (гипотеза одна связь - одна гликозилтрансфераза). Присоединение первого сахара происходит во время трансляции, а остальные добавляются ферментами, локализованными на эндоплазматической сети. Ферменты, присоединяющие последний сахар локализованы в аппарате Гольджи.
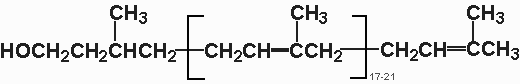
Рис. Структура долихола
-
Образование олигосахаридной части N-связанных гликопротеинов происходит отдельно от белковой части.
Ведущую роль в синтезе олигосахаридов занимает полиизопреновое соединение долихол (состоит 17-20 изопреновых единиц).
|
|
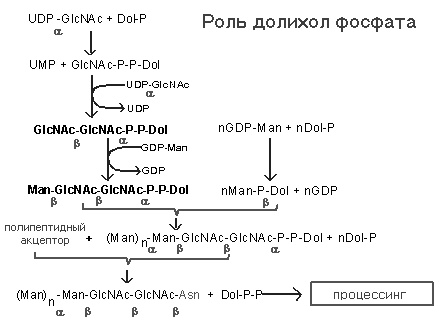
Рис Роль долихол-фосфата в механизме синтеза N-гликозидносвязанных белково- углеводных комплексов.
Долихол-киназа превращает долихол в долихол-фосфат, который в свою очередь вступает в реакцию с УДФ-N-ац-глюкозамином с образованием долихол-пирофосфат-N-ац-глюкозамина. Затем к этому соединению присоединяется еще одна молекула N-ац-глюкозамина, 5 молекул маннозы (ГДФ-манноза как субстрат), затем еще 4 маннозы ( донор маннозы долихол-манноза) и, наконец, добавляются 3 периферические остатка глюкозы (донор - долихол-глюкоза).
Образованный олигосахарид переносится на АСН белка, расположенного на люминальной поверхности эдоплазматической сети. Катализируется этот процесс с участием 'олигосахарид-трансферазы', связанным с мембраной ферментом. Гликозилируются в основном секретируемые белки, белки цитозоля обычно не гликозилируются. Продукт трансферазной реакции долихол-Р-Р превращается в долихол-Р при помощи фосфатазы. Долихол -фосфат вновь используется в реакциях переноса.
Преобладающим типом гликопротеинов животных клеток являются N – связанные гликопротеины. Участок связывания углевода в N - связанном гликопротеине представлен консенсусной последовательностью аминокислот, АСН-Y-СЕР (ТРЕ), (N-X-S (T)), где X - любая аминокислота кроме пролина. Присоединенный олигосахарид в последующем подвергается дополнительной модификации, однако у всех N-связанных гликопротеинов имеется одинаковое олигосахаридное ядро, связанное с полипептидом. Это ядро состоит из трех остатков манноз и двух GlcN-AцГлюкозамина. В зависимости от вариантов других сахаров присоединяемых в последующем к этому ядру различают три главных N -связанных семейства гликопротеинов (см рис.):
![]() Р
Р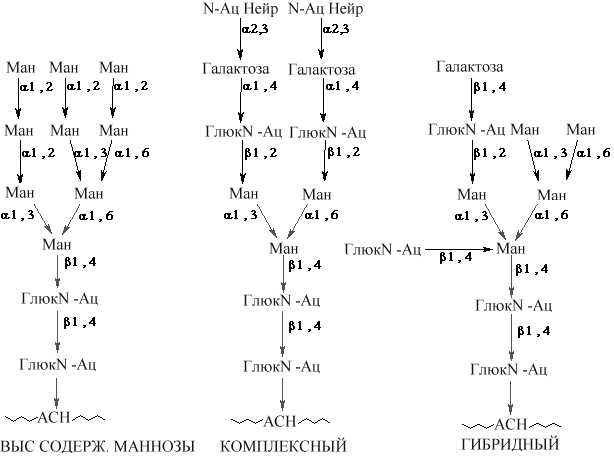 ис.Семейства
N-гликозидносвязанных белково-углеводных
комплексов.
ис.Семейства
N-гликозидносвязанных белково-углеводных
комплексов.