
- •У генетической информации – свой код.
- •Трансляция - один из сложнейших механизмов синтеза макромолекул.
- •Активирование аминокислот происходит в два этапа
- •Существуют два пути узнавания инициирующего кодона
- •Диссоциация рибосомы – необходимая предпосылка для инициации.
- •Малая рибосомная субъединица –главный исполнитель в сценарии инициации
- •Ингибиторы синтеза белков
- •Синтезированные на рибосомах белки доставляются к местам их деятельности разными путями.
- •Ограниченный протеолиз - обязательный механизм посттрансляционной модификации белков
- •Присоединение углеводов наиболее популярный способ пострибосомальной ковалентной модификации белков
- •Семейство с высоким содержанием маннозы
- •Углеводы белков клеточных поверхностей ответственны за клеточную специфичность.
- •Ацилирование помогает белкам встраиваться в мембраны
- •Метилирование аминокислотных остатков в белках встречается редко
- •Фосфорилирование белков в большинстве случаев обратимый процесс
- •Сульфатирование белков пример необратимой ковалентной модификации структуры белка.
- •Пренилирование – способ «заякоривания» белка в мембранах
- •Витамин с – кофактор гидроксилирования белков.
- •Витамин к помогает белкам приобрести свойство связывать кальций.
- •Р егуляция экспрессии генов
- •Регуляция на уровне транскрипции требует специфического взаимодействия днк и белков
- •Инициация транскрипции - основное место действия регуляторов на синтез белков у прокариот
- •Для инициации транскрипции у эукариот требуются дополнительные факторы
- •Регулировать экспрессию генов можно и после транскрипции
- •Аттенуация транскрипции один из возможных механизмов регуляции экспрессии генов.
- •Альтернативный сплайсинг рнк -своеобразная форма регуляции экспрессии генов
- •Транспорт рнк из ядра и последующее редактирование рнк могут быть объектом регуляции.
- •Продолжительность «жизни» иРнк можно регулировать .
Существуют два пути узнавания инициирующего кодона
Терминальная инициация (характерна для эукариот), представляет процесс, при котором рибосома точно присоединяется к модифицированному (кэп) 5’-концу иРНК и перемещается по ней до тех пор, пока не обнаружит инициирующий кодон. В этом процессе участвуют специальные иРНК-связывающие белки, помогающие рибосомной частице узнать 5'-конец мРНК и двигаться вдоль цепи иРНК, используя энергию гидролиза АТФ для расплетания вторичной структуры иРНК и движения .
Внутренняя инициация, характерна для прокариот, В этом случае рибосома взаимодействует непосредственно с определенной последовательностью иРНК, содержащей инициирующий кодон независимо от 5'-конца иРНК и его удаленности от начала кодирующей последовательности. Этот способ обеспечивает инициацию трансляции сразу нескольких кодирующих последовательностей внутри одной иРНК более или менее независимо друг от друга. У прокариот, как уже упоминалось, очень часто одна цепь иРНК содержит несколько кодирующих последовательностей для различных белков [полицистронные мРНК]. В некоторых случаях эукариоты также могут использовать путь внутренней инициации
Диссоциация рибосомы – необходимая предпосылка для инициации.
По окончании синтеза молекулы белка рибосомные субъединицы диссоциируют на составляющие малую и большую субъединиы. Это состояние подерживается специальными белками, которые связываются со свободной малой рибосомной субъединицей [30S у прокариот или 40S у эукариот] и препятствуют ее взаимодействию с большой субъединицей. Эти белки называют факторами инициации или IF [Initiation Factors] .Таких белков у прокариот три, а у эукариот их значительно больше. Их принято обозначать как IF1, IF2, IF3 у прокариот, в названии факторов эукариот прибавляется буква е (eIF-1, eIF-2, eIF-3, eIF-4A, eIF-4B, eIF-4C, eIF-4D, eIF-4E, eIF-4F, eIF-5 и т.д.). Функции отдельных факторов приведены в таблицах
|
Факторы трансляции прокариот. |
|||
|
Фактор |
Число на 1 рибосому |
Связывает ГТФ |
Функция |
|
Инициация |
|||
|
IF1 |
1/7 |
Нет |
Ускоряет диссоциацию 70S рибосомы |
|
IF2 |
1/7 |
Да |
Способствует связыванию инициирующей тРНК |
|
IF3 |
1/7 |
Нет |
См IF1 |
|
Элонгация |
|||
|
EF-Tu |
10 |
Да |
Переносит тРНК на А участок |
|
EF-Ts |
1 |
Да |
Участвует в обмене ГТФ на EF-Tu |
|
EF-G |
1 |
Да |
Необходим для транслокации |
|
Терминация |
|||
|
RF1 |
1/20 |
Нет |
Терминирующий фактор (узнает УАА, УАГ) |
|
RF2 |
1/20 |
Нет |
Терминирующий фактор (узнает УАА, УГА) |
|
RF3 |
? |
Да |
ГТФаза, ускоряющая отделение пептида от рибосомы |
|
Некоторые факторы трансляции эукариот |
|
|
Факторы эукариот |
Функции |
|
Инициация |
|
|
еIF1 |
Участвуют в образовании инициирующего комплекса |
|
eIF2 |
|
|
eIF3, eIF4C |
|
|
eIF4E |
Участвует в связывании кэпа иРНК |
|
eIF4A, eIF4B,eIF4F |
Участвуют в поиске первого кодона АУГ |
|
eIF5 |
Способствуют диссоциации eIF2, eIF3, eIF4C |
|
eIF6 |
Способствует диссоциации 60S субъединиц |
|
Элонгация |
|
|
eEF1a |
Доставляет аминоацил тРНК к рибосоме |
|
eEF1bg |
Участвует в рециклизации eEF1a |
|
eEF2 |
Фактор транслокации |
|
Терминация |
|
|
eRF |
Завершает синтез полипептидной цепи |
Наибольшим сродством к малой субъединице рибосомы обладает IF3 , котрорый является ведущим белком, поддерживающим эту субъединицу в свободном нативном состоянии. Другой фактор, IF2, является представителем большой группы белков, способных связываться с гуаниловыми нуклеотидами и обладающими ГТФазной активностью. Он вступает в процесс на следующем этапе инициации, который может осуществляться двумя способами
а) нативная малая субъединица вначале взаимодействует с иРНК, и затем к этому комплексу присоединяется инициирующая аминоацил-тРНК связанная с IF2 и ГТФ
б) с малой субъединицей вначале взаимодействует инициирующая аминоацил-тРНК с IF2 и ГТФ, а затем к этому комплексу присоединяется иРНК
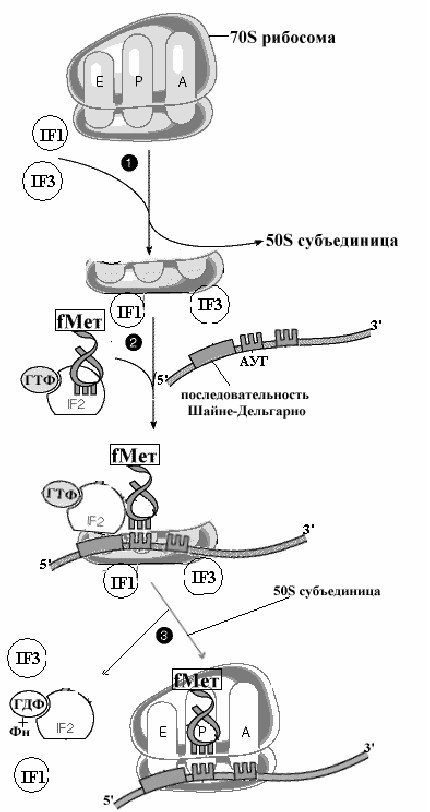
Рис..Образование инициирующего комплекса у прокариот.
Как видно и тот и другой способы приводят к образованию так называемого инициирующего комплекса, состоящего из малой рибосомной субъединицы, иРНК, инициирующей аминоацил-тРНК и факторов инициации. Образование инициирующего комплекса решает важную задачу точной установки инициирующей аминоацил тРНК в начале кодирующей последовательности иРНК.
Р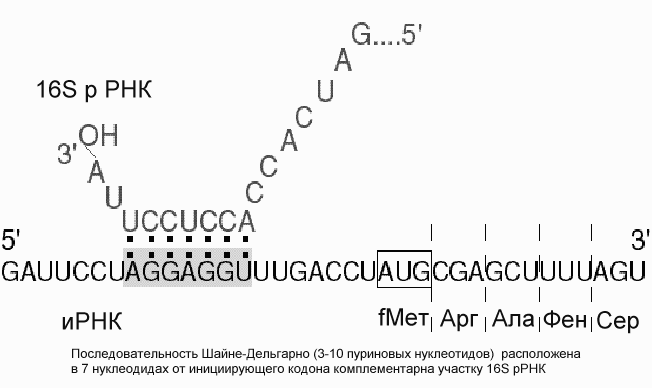 ис.
Механизм взаимодействия иРНК и рибосомы
у прокариот. Основная роль в этом
взаимодействии принадлежит комплементарному
связыванию 16S РНК рибосомы
и специфической последовательности на
иРНК (последовательность Шайне-Дельгарно)
ис.
Механизм взаимодействия иРНК и рибосомы
у прокариот. Основная роль в этом
взаимодействии принадлежит комплементарному
связыванию 16S РНК рибосомы
и специфической последовательности на
иРНК (последовательность Шайне-Дельгарно)
У прокариот и у эукариот это происходит по-разному. У прокариот малая рибосомная субъединица с факторами инициации имеет повышенное сродство к специальному внутреннему участку иРНК, который называют инициирующим, или рибосомосвязывающим участком.. Наиболее известной универсальной структурой такого участка является полипуриновая нуклеотидная последовательность Шайне-Дельгарно , отстоящая от инициирующего кодона на несколько (3-10) нуклеотидов к 5'-концу, т.е. предшествующей инициирующему кодону.
Эта последовательность в большей или меньшей степени комплементарна 3'-концевому участку рибосомной 16S РНК, богатому пиримидиновыми нуклеотидными остатками (5'-GAUCACCUCCUUA-3' у E.coli). Комплементарными могут быть от 3 до 9 остатков (обычно около 4-5). Последовательность CCUCC 3'-концевого участка 16S РНК E.coli оказывается наиболее часто комплементарной (хотя, как правило, частично) полипуриновой прединициирующей последовательности иРНК. Считается, что комплементарное спаривание 3'-концевого участка 16S РНК с прединициирующим полипуриновым блоком иРНК и обеспечивает точную установку инициирующего комплекса на начало кодирующей последовательности иРНК.
У эукариот малая рибосомная субъединица с факторами инициации узнает кэп 5'-концевого участка иРНК, и как правило, взаимодействует с ним. У эукариот малая субъединица обычно взаимодействует с инициирующей аминоацил-тРНК до связывания иРНК. Связавшись с 5'-концом иРНК вместе с инициирующей аминоацил-тРНК и факторами инициации, малая рибосомная субъединица начинает двигаться от 5'-конца по направлению к 3'-концу, используя энергию гидролиза АТФ для раскручивания вторичной структуры иРНК. АТФазной и хеликазной активностью обладает специальный эукариотический фактор инициации eIF4. Когда рибосомная частица достигает и узнает инициирующий кодон, антикодон инициирующей аминоацил-тРНК взаимодействует с ним, обеспечивая тем самым узнавание начала кодирующей последовательности иРНК .
Е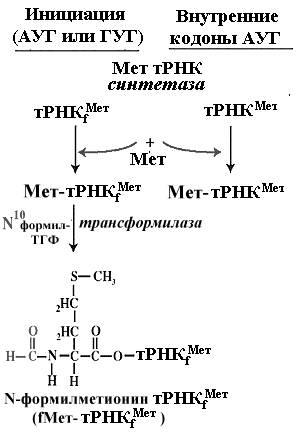 динственным
инициирующим кодоном эукариот является
триплет АУГ. У прокариот с этого триплета
также начинается 90% всех кодирующих
последовательностей. Однако некоторая
часть прокариотических мРНК инициирует
трансляцию на других триплетах - ГУГ,
реже УУГ и совсем редко на некоторых
других . Очевидно, что у прокариот
способность некоторых триплетов быть
инициирующими определяется их положением
в инициирующем или рибосомосвязывающем
участке иРНК . Эти же триплеты, когда
они встречаются в кодирующей
последовательности в ходе элонгации,
кодируют ту или иную аминокислоту АУГ
- метионин, ГУГ - валин, УУГ - лейцин .
динственным
инициирующим кодоном эукариот является
триплет АУГ. У прокариот с этого триплета
также начинается 90% всех кодирующих
последовательностей. Однако некоторая
часть прокариотических мРНК инициирует
трансляцию на других триплетах - ГУГ,
реже УУГ и совсем редко на некоторых
других . Очевидно, что у прокариот
способность некоторых триплетов быть
инициирующими определяется их положением
в инициирующем или рибосомосвязывающем
участке иРНК . Эти же триплеты, когда
они встречаются в кодирующей
последовательности в ходе элонгации,
кодируют ту или иную аминокислоту АУГ
- метионин, ГУГ - валин, УУГ - лейцин .
И у прокариот и у эукариот инициирующей аминоацил-тРНК является метионил-тРНК, у прокариот, как уже отмечалось, ее аминогруппа блокирована формильным остатком -формил-метионил-тРНК. Ее антикодон всегда ЦАУ, так что он полностью комплементарен кодону АУГ и частично комплементарен другим возможным инициаторным кодонам прокариот [например, ГУГ и УУГ].
Структура молекулы тРНК выпонящей роль инициирующей метионил-тРНК несколько отличается от структур других тРНК, в том числе и от структуры метионил-тРНК, используемой в процессе элнгации, что и делает ее функцию в качестве инициатора трансляции уникальной. Инициаторные тРНК имеют консервативный участок ГАУЦ в положении 51-54. Универсальная последовательность в тех же позициях элонгаторных тРНК содержит T вместо A и псевдоуридин вместо У. В инициаторных тРНК дигидроуридиловая петля не содержит дигидроуридина Особенности структуры инициирующей метионил-тРНК обеспечивают ее специфическое комплексирование с белком IF2 при наличии ГТФ [ГТФ, присоединяясь к белку, повышает сродство белка к инициирующей метионил-тРНК] . Универсальность инициации с участием инициирующей метионил-тРНК приводит к тому, что всегда и
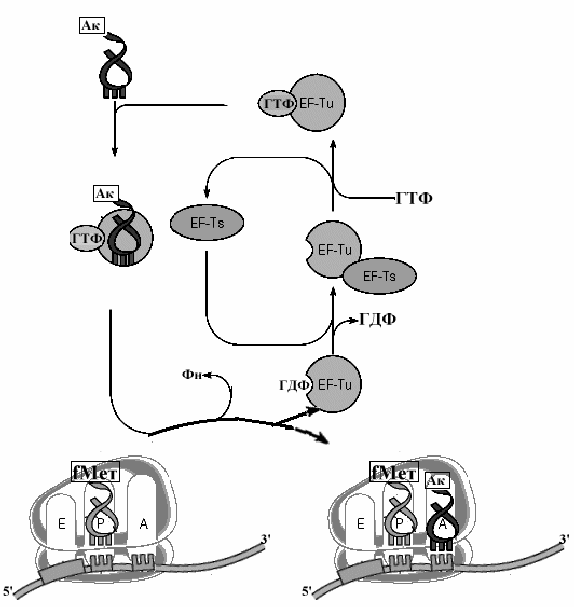
Рис..Схема механизма инициации трансляции у эукариот.
везде любая полипептидная цепь, синтезируемая на рибосоме, начинается с метионина. Лишь потом, в ходе трансляции или после нее, этот концевой метионин может отщепиться специальной протеазой, что и происходит в большинстве случаев
 Итак,
после завершения описанных выше процессов
возникает инициирующий комплекс, в
состав которого входит малая рибосомная
субъединица, связанная с иРНК. К
инициирующему кодону иРНК комплементарно
присоединен антикодон инициирующей
метионил-тРНК, с последней связан фактор
инициации IF2, который несет на себе
молекулу ГТФ.
Итак,
после завершения описанных выше процессов
возникает инициирующий комплекс, в
состав которого входит малая рибосомная
субъединица, связанная с иРНК. К
инициирующему кодону иРНК комплементарно
присоединен антикодон инициирующей
метионил-тРНК, с последней связан фактор
инициации IF2, который несет на себе
молекулу ГТФ.
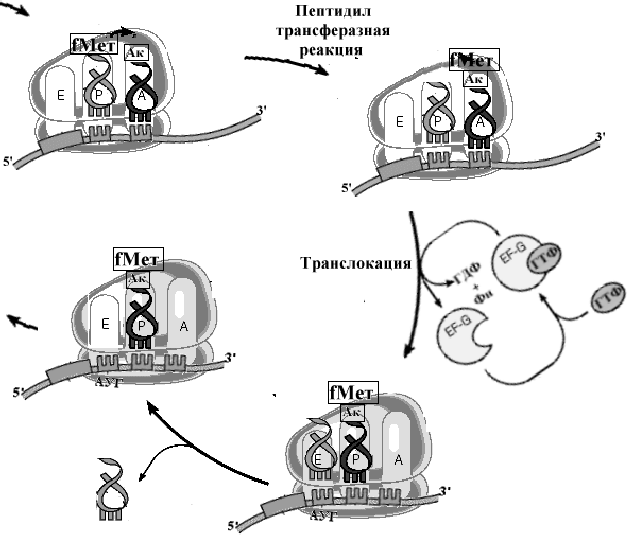
Рис. Схема реакций механизма элонгации процесса трансляции.
На этом этапе в процесс включается свободная большая рибосомная субъединица. Взаимодействуя с малой субчастицей и фактором IF2, большая суъединица активирует ГТФазную активность IF2, в результате чего ГТФ гидролизуется до ГДФ и ортофосфата, что приводит к снижению сродства IF2 к инициирующей метионил-тРНК и IF2 с ГДФ легко вытесняются из рибосомы. На большой субъединице формируется пептидильный участок (Р участок), на котором размещается инициирующая метионил-тРНК. Вытесняются одновременно и все другие факторы инициации, включая IF3 . В итоге образуется полная 70S [ у прокариот] или 80S [ у эукариот] рибосома с Р-участком, занятым инициирующей метионил-тРНК, и с вакантными А- и Е участками .
Этот завершающий шаг процесса инициации начинает образование и элонгацию пептида. На вакантный А-участок поступает первая аминоацил-тРНК в комплексе с фактором элонгации EF1(EF-Tu у прокариот) и ГТФ. После гидролиза ГТФ, EF1(EF-Tu) с ГДФ покидают рибосому, а аминоацил-тРНК, связанная на А-участке, получает возможность реагировать с инициирующей метионил-тРНК в реакции транспептидации, катализируемой большой субъединицей рибосомы. Фактор EF1 (EF-Tu) вновь подключается в процесс трансляции после замены ГДФ на ГТФ при участии факторов, стимулирующих этот обмен гуаниловых нуклеотидов. Так начинается элонгация.
