
- •У генетической информации – свой код.
- •Трансляция - один из сложнейших механизмов синтеза макромолекул.
- •Активирование аминокислот происходит в два этапа
- •Существуют два пути узнавания инициирующего кодона
- •Диссоциация рибосомы – необходимая предпосылка для инициации.
- •Малая рибосомная субъединица –главный исполнитель в сценарии инициации
- •Ингибиторы синтеза белков
- •Синтезированные на рибосомах белки доставляются к местам их деятельности разными путями.
- •Ограниченный протеолиз - обязательный механизм посттрансляционной модификации белков
- •Присоединение углеводов наиболее популярный способ пострибосомальной ковалентной модификации белков
- •Семейство с высоким содержанием маннозы
- •Углеводы белков клеточных поверхностей ответственны за клеточную специфичность.
- •Ацилирование помогает белкам встраиваться в мембраны
- •Метилирование аминокислотных остатков в белках встречается редко
- •Фосфорилирование белков в большинстве случаев обратимый процесс
- •Сульфатирование белков пример необратимой ковалентной модификации структуры белка.
- •Пренилирование – способ «заякоривания» белка в мембранах
- •Витамин с – кофактор гидроксилирования белков.
- •Витамин к помогает белкам приобрести свойство связывать кальций.
- •Р егуляция экспрессии генов
- •Регуляция на уровне транскрипции требует специфического взаимодействия днк и белков
- •Инициация транскрипции - основное место действия регуляторов на синтез белков у прокариот
- •Для инициации транскрипции у эукариот требуются дополнительные факторы
- •Регулировать экспрессию генов можно и после транскрипции
- •Аттенуация транскрипции один из возможных механизмов регуляции экспрессии генов.
- •Альтернативный сплайсинг рнк -своеобразная форма регуляции экспрессии генов
- •Транспорт рнк из ядра и последующее редактирование рнк могут быть объектом регуляции.
- •Продолжительность «жизни» иРнк можно регулировать .
Ингибиторы синтеза белков
Многие антибиотики, используемые для лечения бактериальных инфекций также как и некоторые токсины действуют путем ингибирования трансляции. Ингибирование может быть произведено на всех стадиях трансляции от инициации элонгации к терминации.
|
Некоторые Антибиотики и токсины - ингибиторы трансляции |
|
|
Ингибитор |
Действие |
|
Хлорамфеникол |
Ингибирует пептидилтрансферазу на большой субъединице рибосом прокариот |
|
Циклогексимид |
Ингибирует пептидилтрансферазу на большой субъединице рибосом эукариот |
|
Эритромицин |
Ингибирует транслокацию прокариотическими большими субъединицами |
|
Фузидиновая кислота |
Ингибирует элонгацию у прокариот путем связывания EF-G GDP, предотвращая диссоциацию его от большой субъединицы |
|
Пуромицин |
Аналог аминоацил-тРНК, вызывает преждевременную терминацию у прокариот и эукариот |
|
Стрептомицин |
Ингибирует инициацию роста пептидной цепи, способствует неправильному считыванию иРНК, у прокариот |
|
Тетрациклин |
Ингибирует связывание аминоацил тРНК к прокариотической малой субъединице |
|
Дифтерийный токсин |
Ингибирует связывание аминоацил - т-РНК к прокариотической маленькой субъединице Каталитически инактивирует eEF-2 путем АДФ- рибозилирования |
|
Рицин |
Смертельный растительный лектин. Найден в касторовом семени, катализирует распад рРНК большой субъединицы рибосом эукариот |
Синтезированные на рибосомах белки доставляются к местам их деятельности разными путями.
К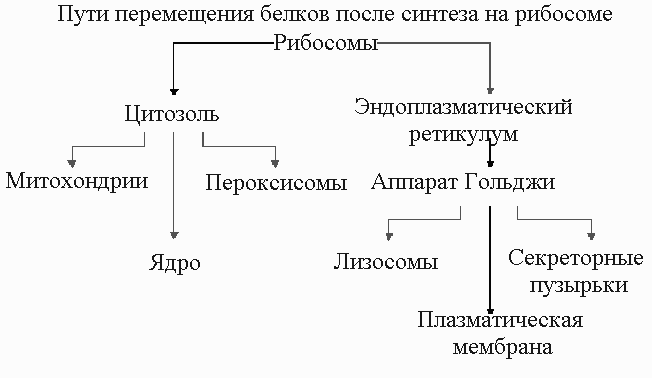 летки
эукариот содержат клеточные органеллы,
каждая из которых состоит из спеРисСхема
путей перемещения белков после синтеза
на рибосоме.
летки
эукариот содержат клеточные органеллы,
каждая из которых состоит из спеРисСхема
путей перемещения белков после синтеза
на рибосоме.
цифических белков. Лишь небольшая часть этих белков может быть синтезирована в пределах органеллы, а основная масса их синтезируется на рибосомах и нуждается в механизмах доставки этих белков. В цитоплазме клеток эукариот имеется две пространственно изолированные популяции рибосом. Одни из них ( рибосомы, связанные с мембраной ), расположены на обращенной к цитоплазме поверхности мембраны ЭР (шероховатый ЭР) и заняты синтезом белков, которые сразу же переносятся внутрь ЭР. Другие (свободные рибосомы) не прикреплены к мембранам и производят все остальные белки, кодируемые ядром. Связанные и свободные рибосомы идентичны по строению и функции. Они различаются только по белкам, которые синтезируются на них в каждый данный момент. Если рибосоме достается синтез белка с сигнальным пептидом для ЭР, то такой сигнал направляет рибосому к мембране ЭР.
Белки, синтезируемые свободными рибосомами – Это белки, предназначенные для цитоплазмы или для включения в митохондрии, хлоропласты или ядра. Вновь синтезированные белки, предназначенные для митохондрий (подобный механизм вероятен и для хлоропластов) содержат специфичные аминокислотные последовательности (то есть, сигнальные последовательности) на своих N - концевых отделах. Многие сигнальные пептиды таких белков имеют положительно заряженные аминокислотные остатки, которые чередуются с гидрофобными. Сигнальные последовательности не только обеспечивают встраивание белка в мембраны, но и выполняют роль сигналов, которые способствуют точному и целенаправленному переносу белка к месту его функционирования. Среди белков, направ
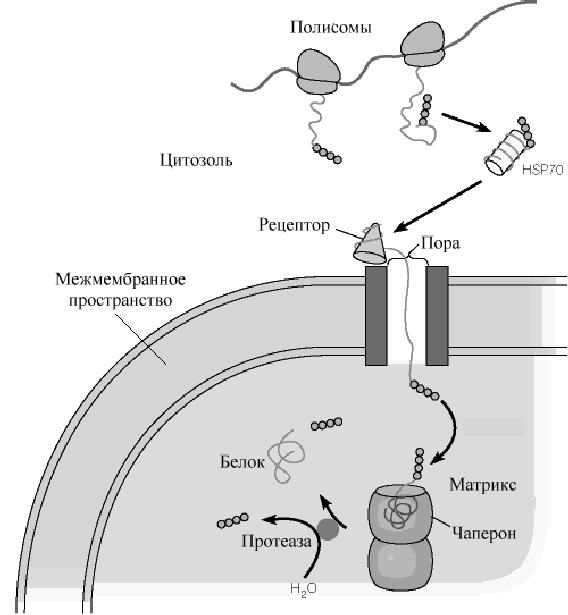
Рис .Белки теплового шока обеспечивают прохождение белков из цитозоля в матрикс митохондрий.
ляющихся в ядро, большинство имеет сигнальные пептиды, образованные кластером положительно заряженных аминокислотных остатков. Наконец, некоторым белкам цитозоля присущи сигнальные пептиды, с которыми ковалентно связывается жирная кислота, направляющая эти белки к мембранам Важную роль в механизме переноса таких белков принадлежит специальному классу белков, получивших название шапероны. Функция этих белков не ограничивается только участием в переносе белка. Шапероны состоят из нескольких полипептидных цепей, формирующих внутримолекулярную полость с рядом гидрофобных поверхностей внутри этой полости. Такая полость выполняет роль хранителя полипептидных цепей синтезированной молекулы от неправильного сворачивания и межмолекулярной агрегации. Наиболее хорошо изученные шапероны - члены семейства белков " теплового шока "(HSP) . Эти белки образуются у бактерий в ответ на тепловое воздействие. Они классифицируются, как правило, по молекулярным массам. Различают семейства HSP70, HSP60 и т.д. Белки при взаимодействии с шаперонами остаются развернутыми и доставляются к участку рецептора на мембране органеллы. Развернутый белок затем проходит через специальные ворота, расположенные во внутренней и внешней мембранах митохондрий. В процессе этого транспорта происходит специфическое узнавание белков, предназначенных для межмебранного пространства, мембран, или матрикса. Если комплекс проходит в матрикс, белок может быть принят внутриорганельными шаперонами для конечного сворачивания. N - концевая последовательность удаляется во время этого транспорта
Белки, синтезируемые на шереховатом эндоплазматическом ретикулуме - белки, предназначенные для клеточных мембран, лизосом, или внеклеточного транспорта используют специальную систему сортировки, вовлекающую шереховатый эндоплазматический ретикулум (ШЭР) и комплекс Гольджи. ШЭР - представлен сетью связанных между собой пузырьков, окруженных мембраной в пределах цитоплазмы. На внешней, цитозольной поверхности пузырьков располагаются полисомы, придающие мембране шереховатый вид. Комплекс Гольджи по строению напоминает ШЭР, он состоит из стека небольших, окруженных мембраной пузырьков, не связанных между собой и не покрытых рибосомами. Комплекс Гольджи действует как " переключающий центр " для белков различного предназначения.
Белки, транспорт которых связан с участием комплекса Гольджи, синтезируются полирибосомами, связанными с ШЭР следующим образом
1. Рибосома начинает синтез N - концевой гидрофобной лидирующей (сигнальной) последовательности на цитоплазматической иРНК.
2. Сигнальные частицы, распознающие сигнальную последовательность (SRPs), состоящие из нескольких белков и небольшой (7SL) РНК, узнают лидирующие последовательности соответствующих синтезированных белков и связываются с ними, как только те покинут рибосомы. Это соединение временно останавливает трансляцию, до тех пор, пока N - концевая лидирующая последовательность, сошедшая с рибосомы не свяжется со специальным связывающим белком на ШЭР мембране.
3. Этот белок связывает рибосому с ШЭР, и лидирующая последовательность вставляется в ШЭР мембрану.
4. SRP отделяется и трансляция возобновляется.
5. Синтезируемый белок фактически протягивается через мембрану АТФ зависимым процессом.
6. Прежде, чем трансляция завершится, лидирующие последовательности удаляются связанной с мембраной протеазой. Белки высвобождаются в просвет ШЭР и подвергаются дальнейшей сортировке. Белки, которые остаются в эндоплазматическом ретикулуме, имеют устойчивые специальные сигнальные пептиды на С- концах и таким образом остаются связанными к мембраной ШЭР
Р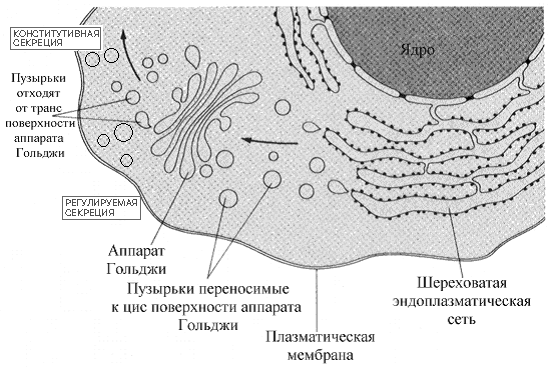 оль
комплекса Гольджи -
В просвете ШЭР, белки подвергаются
первым стадиям Рис.Роль аппарата Гольджи
в секреции белков клеткой.
оль
комплекса Гольджи -
В просвете ШЭР, белки подвергаются
первым стадиям Рис.Роль аппарата Гольджи
в секреции белков клеткой.
гликозилирования (см ниже). Пузырьки, несущие эти белки отпочковываются от ШЭР и перемещаются к комплексу Гольджи, где завершается достройка углеводной половины гликопротеинов. Мембранные пузырьки комплекса Гольджи - многослойная арена для сортировки модифицированных белков. Пузырьки от ШЭР поступают вначале на цис поверхность комплекса Гольджи (поверхность, расположенная ближе к ШЭР) и сливаются (объединяются) с мембраной цистерн Гольджи. Белки затем проходят снова через пузырьки, к промежуточным слоям. Наконец, часть пузырьков отшнуровывается от транс поверхности комплекса Гольджи (та, что дальше от ШЭР) и участвуют в формировании лизосом, пероксисом или глиоксисом или доставляются к плазматической мембране. Часть белков, обладающих специфической последовательностью (KDEL сигнальной последовательности (Лиз-Асп-Глу-Лей)) «отлавливается» рецепторами мембран аппарата Гольджи и в комплексе с рецептором возвращается в эндоплазматический ретикулум путем ретроградного транспорта.
Везикулярный транспорт белков от комплекса Гольджи требует высокой специфичности в целенаправленном перемещении. Нарушение везикулярного транспорта - причина клеточного хаоса. Мембраны везикул переносящих упакованные в пузырьки белки метятся специфичными белками мембран. В некоторых случаях мембраны пузырьков содержат комплементарные белки (называемые ловушками), которые взаимодействуют с другими мембранами и вызывают слияние мембран и точную доставку переносимых белков.
Секретируемые из клетки белки в составе пузырьков (везикулярный транспорт) могут покидать клетку несколькими путями. Различают конститутивную и регулируемую секрецию. В механизмах регулируемой секреции важное место отводится специальному белку клатрину (покрытые клатрином окаймленные пузырьки).
Клатрин - консервативный фибриллярный белок (18О кДа), образующий вместе с другим полипептидом (35 кДа) характерный многогранный чехол на поверхности так называемых окаймленных пузырьков. Основным структурным компонентом чехла служит трехвалентный белковый комплекс (трискелион ), состоящий из трех полипептидных цепей клатрина и трех меньших по размеру полипептидов. Трискелионы образуют на поверхности окаймленных пузырьков корзиноподобные сетки из шести- и пятиугольников. Выделенные трискелионы при соответствующих условиях способны к спонтанной агрегации. При этом даже в отсутствие пузырьков формируются типичные многогранные корзинки. Остальные белки, входящие в состав мембран окаймленных пузырьков, по-видимому, отвечают за связывание клатриновой оболочки с пузырьком и за улавливание рецепторов плазматической мембраны в окаймленные ямки и пузырьки.
В механизмах конститутивной секреции участвуют неклатриновые окаймленные пузырьки.
У бактерий свои особенности транспорта белков. Бактериальные белки, предназначенные для секреции (транслокация через клеточную мембрану) содержат высоко гидрофобные отрезки аминокислот (называемые сигнальными последовательностями или лидирующими последовательностями) на их N- концевой области. После того, как белок прошел через мембрану, лидирующая последовательность удаляется.
В настоящее время принятая модель транслокации показана на рис.10-14. Последовательность событий выглядит следующим образом:
Б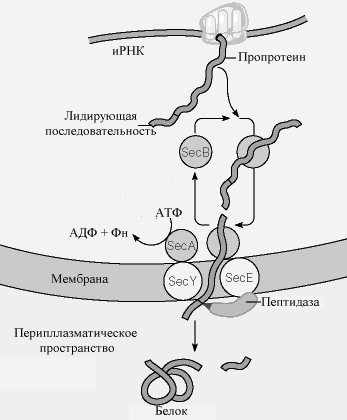 елок,
который участвует в транслокации
(называемый про-белком) - образует
комплекс в цитоплазме с шапероном
(например, Sec
B белок). Комплекс предохраняет белок
от преждевременного сворачивания,
которое помешало бы пройти через пору.
По
елок,
который участвует в транслокации
(называемый про-белком) - образует
комплекс в цитоплазме с шапероном
(например, Sec
B белок). Комплекс предохраняет белок
от преждевременного сворачивания,
которое помешало бы пройти через пору.
По
Рис.. Механизм переноса белков через мембрану у бактерий.
следняя состоит из двух трансмембранных белков, Sec E и Sec Y. Sec A - АТФаза, которая способствует транслокации. После того, как про-белок пройдет через мембрану, лидирующий пептид удаляется связанной с мембраной протеазой , и белок может свернуться в свою активную трехмерную форму.
