
- •1. Биологическая ценность белка.
- •Белки –основной источник аминокислот, аминокислоты же используются для синтезе многих соединений.
- •Белковое питание должно быть полноценным.
- •Аминокислоты образуются при распаде белков.
- •Переваривание белков начинается в желудке.
- •Пристеночное пищеварение олигопептидов завершает процесс гидролиза белков в кишечнике.
- •Объемы внутриклеточного протеолиза в несколько раз превышают объемы протеолиза в желудочно-кишечном тракте
- •Микроорганизмы толстого кишечника используют непереваренные белки для своих процессов жизнедеятельности
- •В механизмах поступления аминокислот в клетки важная роль отводится глутатиону.
- •1.Мультимедийная презентация
Пристеночное пищеварение олигопептидов завершает процесс гидролиза белков в кишечнике.
Олигопептиды, образованные в процессе гидролиза белков в просвете кишечника, в дальнейшем гидролизуются специфическими олигопептидазами (экзопептидазы, дипептидазы), локализованными в мембранах щеточной каемки энтероцитов. Эти ферменты являются гликопротеинами, углеводная часть молекулы обеспечивает ориентацию активных центров в просвет кишечника. Конечные продукты пристеночного пищеварения — свободные аминокислоты, ди- и трипептиды.
Потенциальная опасность освобождения в поджелудочную железу малого количества трипсина очевидна: отмеченная выше цепная реакция произвела бы активные ферменты, которые могли переварить поджелудочную железу. Не удивительно, что поджелудочная железа обычно содержит ингибитор трипсина.
Объемы внутриклеточного протеолиза в несколько раз превышают объемы протеолиза в желудочно-кишечном тракте
Если механизмы переваривания белков в желудочно-кишечном тракте, описанные выше, достаточно подробно изучены и их исследование получило прямой выход в медицинскую практику, то о механизмах внутриклеточного протеолиза, занимающих по объему значительно большее место в обмене белков, известно мало. Наиболее хорошо в этих процессах известна роль лизосом и в последнее время много внимания уделяется АТФ-зависимым процессам протеолиза в цитозоле.
Аутофагия - процесс разрушения отработанных частей самой клетки. На электронных микрофотографиях нормальных клеток можно увидеть лизосомы, содержащие митохондрии и секреторные пузырьки. Отработанные органеллы могут быть утилизированы в лизосомах. Процесс деградации начинается с окружения органеллы мембранами, происходящими из ЭР, в результате чего образуется аутофагосома
В случае эндоцитоза и аутофагии захваченные в мембранные пузырьки белковые молекулы, после слияния с лизосомами, подвергаются протеолизу с участием лизосомальных протеолитических ферментов – катепсинов. Катепсины обозначаются заглавными латинскими буквами и являются протеазами одного из указанных выше классов протеаз.
Подобно фосфорилированию белков, изменяющему свойства белковой молекулы, в цитозоле происходит, зависимое от АТФ, соединение белков, подлежащих протеолизу, со специальным белком – убиквитином.
Убиквитин- небольшой белок, состоящий из 76 аминокислот, формирует плотно упакованную глобулу, с выступающим в окружающую среду С-концевым участком. Убиквитинилирование протекает в несколько этапов:
1. Убиквитин вначале активируется убиквитин активирующим ферментом, E1
2. Убиквитин переносится на остаток цистеина убиквитин коньюгирующего фермента , E2
3. Молекулы убиквитина переносятся на остатки лизина белков, предназначенных для распада. В ряде случаев для соединения с белком-мишенью необходимо участие вспомогательного белка, обеспечивающего узнавание белков, подлежащих гидролизу.
C-концевой остаток убиквитина связывается пептидной связью с аминогруппой боковой цепи лизина в белке-мишени. Это вызывает ковалентную модификацию структуры белка мишени (подобно фосфорилированию), что может изменять функцию этого белка. К одной молекуле может быть присоединено несколько молекул убиквитина с образованием полиубиквитина. Это может служить сигналом для переноса белка-мишени на большую.
Предполагается также, что убиквитинилирование подобно фосфорилированию может быть механизмом универсальной модификации белковых молекул.
Апикальную и базолатеральную мембраны энтероцитов аминокислоты проходят разными механизмами.
В
мембране микроворсинок кишечника
расположены специфические транспортные
системы, участвующие в активном транспорте
аминокислот в энтероциты. Различают
несколько таких систем для переноса:
1. нейтральных аминокислот, 2. - алифатических
гидрофобных аминокислот, 3. - иминокислот,
4. - кислых аминокислот, 5. - основных
аминокислот. Работа некоторых их этих
переносчиков
зависит от ионов натрия,
градиент которого (как и при всасывании
глюкозы) обеспечивает их перенос через
мембрану. Два
переносчика также требуют Cl-.
У двух систем транспорт независим от
Na+.
Ди- и
трипептиды транспортируются в энтероциты
системой, которая требует Н+
вместо Na+.
Большие пептиды всасываются в очень
небольших количествах. В энтероцитах
олигопептиды распадаются до аминокислот
внутриклеточным гидролизом и
образовавшиеся аминокислоты вместе с
аминокислотами, поступ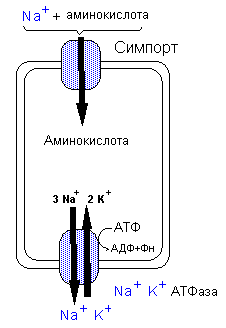 ившим
из кишечника покидают клетку через
базолатеральную мембрану при помощи
по крайней мере пяти транспортных
систем. Две из этих систем зависимы и
три независимы от Na+.
Из межклеточного пространства аминокислоты
и небольшие пептиды попадают в систему
воротной вены.
ившим
из кишечника покидают клетку через
базолатеральную мембрану при помощи
по крайней мере пяти транспортных
систем. Две из этих систем зависимы и
три независимы от Na+.
Из межклеточного пространства аминокислоты
и небольшие пептиды попадают в систему
воротной вены.
Всасывание аминокислот активно происходит в верхних отделах тонкого кишечника. Часть белка не усваивается в тонком кишечнике и поступает в толстый кишечник, где используется микрофлорой.
У новорожденных возможно всасывание умеренных количеств непереваренных белков. Антитела материнского молока - представленные секреторными иммуноглобулинами (IgA), поступают в кровь из кишечника при помощи эндоцитоза с последующим экзоцитозом и обеспечивают пассивный иммунитет против инфекций. Этот процесс снижается с возрастом , но взрослые все еще абсорбируют небольшие количества белка. Чужеродные белки поступающие в кровь, способствуют образованию антител, и реакция на последующее поступление большего количества того же белка может вызвать аллергические симптомы, что объясняет происхождение аллергических реакций после приема некоторых пищевых продуктов.
Поглощение белковых антигенов, например, бактериальных и вирусных белков, происходит в больших М клетках, специализированных кишечных эпителиоцитах, которые передают антигены к лимфоидным клеткам, и активируют лимфобласты, в последующем секретирующие IgA в ответ на поступление того же антигена. Этот секреторный иммунитет - важный механизм защиты в кишечнике.
