
- •1. Биологическая ценность белка.
- •Белки –основной источник аминокислот, аминокислоты же используются для синтезе многих соединений.
- •Белковое питание должно быть полноценным.
- •Аминокислоты образуются при распаде белков.
- •Переваривание белков начинается в желудке.
- •Пристеночное пищеварение олигопептидов завершает процесс гидролиза белков в кишечнике.
- •Объемы внутриклеточного протеолиза в несколько раз превышают объемы протеолиза в желудочно-кишечном тракте
- •Микроорганизмы толстого кишечника используют непереваренные белки для своих процессов жизнедеятельности
- •В механизмах поступления аминокислот в клетки важная роль отводится глутатиону.
- •1.Мультимедийная презентация
Аминокислоты образуются при распаде белков.
В клетках млекопитающих возможности образования новых аминокислот из небольших молекул предшественников ограничены, поэтому основным источником аминокислот являются белки, которые разрушаются до аминокислот при помощи протеаз
Международный Союз по Биохимии и Молекулярной Биологии (1984) рекомендовал использовать термин пептидаза для подкласса гидролитических ферментов, действующих на пептидную связь (подкласс E.C 3.4.). Широко используемый термин «протеаза» является синонимом термину пептидаза. Пептидазы разделяются на две группы ферментов: эндопептидазы и экзопептидазы. Эндопептидазы расщепляют пептидные связи внутри целой молекулы белка, а экзопептидазы удаляют аминокислоты последовательно от N или C-концов белковой молекулы. Используется также термин «протеиназа», как синоним, для эндопептидаз.
Протеолитические ферменты вовлекаются в большое число разнообразных физиологических процессов. Протеолиз может протекать вне клеток и внутриклеточно. Действие протеолитических ферментов может быть разделено на две различные категории:
-
Ограниченный протеолиз, в котором протеаза специфически расщепляет одну или несколько пептидных связей в белке-мишени, что обычно приводит к изменению функционального состояния последнего: ферменты, например, при этом становятся активными, а прогормоны превращаются в гормоны.
-
Неограниченный или тотальный протеолиз, при котором белки распадаются до своих аминокислот. Такому протеолизу, например, подвергаются белки в желудочно-кишечном тракте, в цитозоле при участии протеосом с затратой АТФ (после предварительного взаимодействия гидролизуемого белка со специальным белком убиквитином) или в лизосомах.
Выделяют 4 класса протеаз. Протеазы классифицируются по типу их механизма катализа. Международный Союз по Биохимии и Молекулярной Биологии выделяет четыре класса протеаз:
|
Сериновые протеиназы |
Аспарагиновые протеиназы |
|
Цистеиновые протеиназы |
Металлопротеиназы |
В дополнение к этим четырем классам имеется секция в Номенклатуре Ферментов, которая выделена для протеаз неопознанного каталитического механизма. Это указывает на возможность существования новых типов протеаз.
Сериновые протеиназы представлены двумя разными семействами.
А. Семейство химотрипсина, которое включает ферменты животных -- типа химотрипсина , трипсина, эластазы или калликреина.
Б. Семейство субтилизина, которое включает бактериальные ферменты-- типа субтилизина.
Хотя третичная структура ферментов этих двух семейств различна, они имеют одинаковую геометрию активного центра и поэтому катализируют реакции по одному и тому же механизму. Сериновые протеиназы проявляют разную субстратную специфичность, которая связана с заменами аминокислот в различных субъединицах фермента, взаимодействующих с аминокислотными остатками субстрата. Некоторые ферменты имеют более широкий участок взаимодействия с субстратом, в то время как другие имеют ограниченную специфичность. Три аминокислотных остатка формируют домен - каталитическую триаду, обеспечивающую проведение катализа (например, Гис 57, Асп 102 и Сер195 у химотрипсиногена).
Цистеиновые протеиназы. Это семейство включает протеазы из растений типа папаина, несколько лизосомальных катепсинов, цитозольные калпаины (активизируются кальцием), а также несколько протеаз из паразитов (например, из трипаносом, шистосом). Папаин – наиболее хорошо изученный член этого семейства.. Подобно сериновым протеиназам, катализ при участии цистеиновых протеаз проходит через этап формирования ковалентного промежуточного звена и вовлекает остатки цистеина и гистидина. Важные для катализа Цис25 и Гис159 (счет ведется по папаину) играют ту же роль что и Сер195 и Гис57 соответственно в сериновых протеиназах.
Аспарагиновые протеиназы. Большинство аспарагиновых протеиназ принадлежит семейству пепсина. Оно включает пищеварительные ферменты типа пепсина и химозина, лизосомальный катепсин D и ферменты процессинга типа ренина, некоторые протеазы из грибов (пенициллопепсин , ризопуспепсин, эндотиапепсин).
Второе семейство включает вирусные протеиназы типа протеаз вируса СПИДа (HIV) (ретропепсин). Эти ферменты представляют собой структуры, состоящие из двух гомологичных долей с активным центром, расположенным между этими долями. Каждая доля вносит один остаток аспартата в создаваемую каталитически активную диаду радикалов аспарагиновой кислоты Один аспартат находится в ионизированной форме, в то время как второй ионизируется при рН оптимуме в диапазоне 2-3. Ретропепсины являются мономерными. Это значит, они несут только один каталитический аспартат , и поэтому необходима димеризация для формирования активного фермента.
Металлопротеиназы. Большинство этих ферментов содержат атом цинка, который является каталитически активным. В некоторых случаях, цинк может быть заменен другими металлами типа кобальта или никеля без потери активности.
Основными источниками аминокислот являются белки пищи и тканевые белки.
В желудочно-кишечный тракт белки поступают из двух источников:
-
Экзогенные белки — белки пищевых продуктов (70-100 г)
-
Эндогенные белки — белки пищеварительных секретов и слущивающегося эпителия пищеварительного тракта (20-30 г/сут).
Основная часть поступивших в желудочно-кишечной тракт белков переваривается до смеси аминокислот, дипептидов и трипептидов и небольшое количество непереваренного белка выделяется с калом.
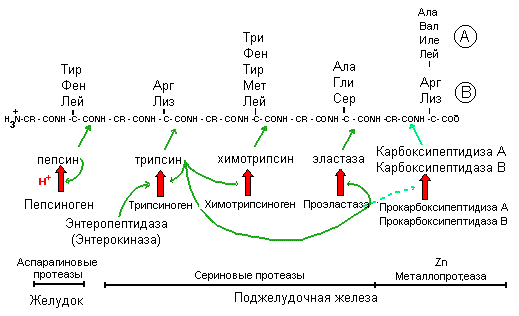 Протеолитические
ферменты. В
желудочно-кишечном тракте под действием
протеолити
Протеолитические
ферменты. В
желудочно-кишечном тракте под действием
протеолити
Рис.4. Схема протеолиза пищевых белков в желудочно-кишечном тракте.
ческих ферментов происходит расщепление белков. Они имеют различную специфичность и последовательно гидролизуют белки до аминокислот
Для переваривания белков необходимы:
-
Водный раствор с различным значением рН и концентрацией электролитов создает условия, необходимые для оптимальной активности ферментов
-
Предшественники ферментов - протеолитические ферменты синтезируются в виде неактивных предшественников (проферментов) и затем активируются в полости желудочно-кишечного тракта. Проферменты активируются путем ограниченного протеолиза.
-
Слизь (мукопротеины) – высоковязкие растворы мукопротеинов действуют как смазочные средства, ускоряя прохождение пищи по ЖКТ.
