
Тема 17. Органічні реакції і речовини. Ізомери.
Класифікація органічних реакцій. В ході реакцій в молекулах реагуючих речовин розриваються одні хімічні зв”язки і утворюються інші. Органічні реакції класифікуються за типом розриву хіміч-них зв”язків в реагуючих частинках. Із них можна виділити дві великі групи реакцій - радикальні і іонні. Радикальні реакції – це процеси, що йдуть з гомолітичним розривом ковалентного зв”язку. При гомолітичному розриві пара електронів, що утворює зв”язок, ділиться таким чином, що кожна з частинок, що виникають, отримує по одному електрону. В результаті гомолітичного розриву утворюються вільні радикали:
![]()
Нейтральний атом або частинка з неспареним електроном називається вільним радикалом.
Іонні реакції – це процеси, що йдуть з гетеролітичним розривом ковалентних зв”язків, коли обидва електрони зв”язку залишаються з однією із раніше зв”язаних частинок:
![]()
В результаті гетеролітичного розриву зв”язку утворюються заряджені частинки: нуклеофільна і електрофільна. Нуклеофільна частинка (нуклеофіл) – частинка, яка має пару електронів на зовнішньому електронному рівні. За рахунок пари електронів нуклеофіл здатний утворювати новий ковалентний зв”язок. Електрофільна частинка (електрофіл) – має незаповнений зовнішній елект-ронний рівень. Елекрофіл надає незаповнені, вакантні орбіталі для утворення ковалентного зв”язку за рахунок електронів тої частинки, з якою він взаємодіє. В органічній хімії всі структурні зміни розглядаються відносно атома (або атомів) карбону, який приймає участь у реакції. Частіше всього зустрічаються наступні типи перетворень:
приєднання
![]()
заміщення
![]()
відщеплення (елімінування)
![]()
полімерізація
![]()
У зв”язку з вищевикладеним, хлорування метану під дією світла класифікують як радикальне заміщення, приєднання галогенів до алкенів – як електрофільне приєднання, а гідроліз алкіл- галогенідів - як нуклеофільне заміщення.
2. Алкани і циклоалкани
Згідно з будовою карбонового скелету вуглеводні розподіляють на аліфатичні (з відкритим карбоновим ланцюгом) і циклічні (з замкненим карбоновим ланцюгом). В залежності від типу зв”язків між атомами карбону як аліфатичні, так і циклічні вуглеводні діляться на насичені, що мають тільки -зв”язки, і ненасичені, які мають як - так і -зв”язки. До насичених вуглеводнів належать алкани і циклоалкани.
Алкани – є насиченими вуглеводнями, оскільки всі вільні валентності атомів карбону зайняті (пов-ністю „насичені”) атомами гідрогену. Алкани називають також парафінами (цей термін означає „ті, що мають низьку спорідненість”). Найпростіший представник алканів – метан СН4. Починаючи з нього, можна побудувати ряд, в якому кожний наступний вуглеводень відрізняється від поперед-нього на одну групу СН2. Загальна формула гомологічного ряду алканів СnН2n+2.
Згідно з систематичною номенклатурою IUPAC, першим чотирьом членам гомологічного ряду алканів присвоєні їх історично утворені назви – метан, етан, пропан, бутан. Назви останніх алканів з нормальним, тобто нерозгалуженим, карбоновим ланцюгом складаються їз грецьких або латин-ських назв чисельника, що відповідає числу атомів карбону в ланцюгу, з добавленням суфіксу –ан. Так, грецька назва чисельника 5 – „пента”, тому вуглеводень С5Н12 називається пентан. Для тієї ж сполуки можна зустріти назву н-пентан, що підкреслює наявність нормального ланцюгу. Почина-ючи з бутану і далі для кожного нормального алкана існують структурні ізомери з розгалуженим ланцюгом. Структурна ізомерія обумовлює різноманітність вуглеводневих радикалів. Останній отримується, якщо від молекули алкану відібрати один атом гідрогену. Цей термін не слід плутати з поняттям „вільний радикал”, що характеризує атом з неспареним електроном. Назва радикала походить від назви відповідного алкану із заміною суфіксу -ан на суфікс -іл. Загалом, радикали, що походять від аліфатичних вуглеводнів, називають алкільними і позначають через R. Ізомерія радикалів починається з пропану, для якого можливі два ізомерних радикали. Якщо атом гідрогену відняти від первинного атому карбону, то отримаємо радикал пропіл (н-пропіл), якщо від вторин-ного – буде радикал ізопропіл.
Фізичні властивості. В звичайних умовах перші чотири члени гомологічного ряду алканів (С1—С4)— гази. Нормальні алкани від пентану до гептадекану (С5—С17) – рідини, починаючи з С18 і вище – тверді речовини. Із збільшенням кількості атомів карбону в ланцюгу, тобто з ростом від-носної молекулярної маси, підвищуються температури кипіння і плавління алканів. При однаковій кількості атомів карбону в молекулі алкани з розгалуженою будовою мають більш низькі темпера-тури кипіння, ніж нормальні алкани. Алкани практично нерозчинні в воді, оскільки їх молекули малополярні і не взаємодіють з молекулами води. Рідкі алкани легко змішуються один з одним. Вони добре розчиняються в неполярних органічних розчинниках, таких як бензол, тетрахлорметан та ін.
Отримання. Метан широко розповсюджений у природі. Він є головною складовою частиною багатьох горючих газів як природних (90-98 %), так і штучних, що виділяються при сухій перегонці деревини, торфу, кам”яного вугілля, а також при крекінгу нафти. Природні гази, особливо супутні гази нафтових родовищ, окрім метану містять етан, пропан, бутан і пентан. Метан виділяється із дна болот та кам”яновугільних пластів в копальнях, де він утворився в умовах повільного розкладу рослинних залишків при відсутності кисню. Тому метан часто називають болотним або рудничним газом.
1. Отримання із ненасичених вуглеводнів.
Взаємодія алканів з гідрогеном відбувається в присутності металевих каталізаторів (Ni, Pd) при нагріванні:
![]()
2. Отримання із галогенпохідних
При нагріванні моногалогензаміщених алканів з металевим натрієм отримують алкани з подвійною кількістю атомів карбону (реакція Вюрца):
![]()
Подібну реакцію не проводять з двома різними галогензаміщеними алканами, оскільки при цьому утворюється суміш трьох різних алканів.
3. Отримання із солей карбонових кислот.
В результаті сплавлення безводних солей карбонових кислот з лугами отримують алкани, які містять на один атом карбону менше в порівнянні з карбоновим ланцюгом вихідних карбонових кислот:
![]()
4. Отримання метану
В електричній дузі, що горить в атмосфері гідрогену, утворюється значна кількість метану:
![]()
Така ж реакція йде при нагріванні карбону в атмосфері гідрогену до 400-500 оС при підвищеному тиску в присутності каталізатору. В лабораторних умовах метан часто отримують із карбіду алюмінію:
![]()
Хімічні властивості. У звичайних умовах алкани хімічно інертні. Вони є сталими до дії багатьох реагентів: не взаємодіють з концентрованими сірчаною і азотною кислотами, з концентрованими і розплавленими лугами, не окиснюються сильними окисниками – перманганатом калію і т.д. Хімічна сталість алканів пояснюється високою міцністю -зв”язків С – С і С – Н , а також їх неполярністю. Неполярні зв”язки С – С і С – Н в алканах не схильні до іонного розриву, але здатні до гомолітичного розщеплення під дією активних вільних радикалів. Тому для алканів характерні радикальні реакції, в результаті яких отримуються сполуки, де атоми гідрогену заміщені на інші атоми або групи атомів. Алкани вступають в реакції, які плинуть по механізму радикального заміщення (позначаються символом SR (від англ. substitution radicalic). За цим механізмом легше всього йде заміщення атомів гідрогену у третинних, потім у вторинних і первинних атомів карбону.
1. Галогенування При взаємодії алканів з галогенами (хлором і бромом) під дією УФ-випромінювання або високої температури утворюється суміш продуктів від моно- до полігалогензаміщених алканів. Загальна схема такої реакції показана на прикладі метана:
![]()
-
Нітрування (реакція Коновалова).
При дії розбавленої
азотної кислоти на алкани при 140 оС
і невеликому тиску йде радикальна
реакція;
![]()
-
Ізомерізація.
Нормальні алкани за певних
умов можуть перетворюватись в алкани
з розгалуженим ланцюгом:
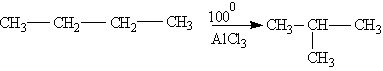
Окиснення.
При м”якому окисненні метану киснем повітря в присутності різних каталізаторів можуть бути отримані метиловий спирт, формальдегід, мурашина кислота:
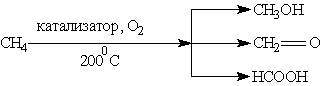
У повітрі алкани згоряють до СО2 і Н2О.
Застосування алканів. Воно досить різноманітне. Завдяки великій теплотворній здатності метан в значних об”ємах витрачається в якості палива (в побуті – побутовий газ і в промисловості). Широко застосовуються і речовини, що отримуються з нього – гідроген, ацетилен, сажа. Він служить вихід-ною сировиною для отримання формальдегіду, метилового спирту, а також різних синтетичних продуктів.
Велике промислове значення має окиснення вищих насичених вуглеводнів – парафінів з числом атомів карбону 20-25. У такий спосіб отримують синтетичні жирні кислоти з різною довжиною ланцюгу, які використовують для виробництва мил, різних миючих засобів, мастильних матеріалів, лаків, емалей. Рідкі вуглеводні використовують як паливо (вони входять у склад бензину і гасу). Алкани широко використовують в органічному синтезі.
Циклоалкани – Загальна формула гомологічного ряду циклоалканів С2Н2n. Такою ж формулою описується гомологічний ряд алкенів, з чого витікає, що для кожного циклоалкану існує ізомер – відповідний алкен – це приклад так званої „міжкласової” ізомерії. Структурні формули цикло-алканів зазвичай записують у скороченому вигляді, використовуючи геометричну форму циклу і відкидаючи символи атомів карбону і гідрогену.

Структурна ізомерія циклоалканів обумовлена розміром циклу (наприклад, циклобутан і метил-циклопропан – ізомери) і положенням замісників в циклі (наприклад, 1,1- і 1,2-диме-тилбутан). Для циклоалканів характерний ще один вид ізомерії – просторова ізомерія, що зв”язана з різним розта-шуванням замісників відносно площини циклу. При їх розташуванні з одної сторони від площини циклу отритмується цис-ізомер, з різних сторін – транс-ізомер.
Фізичні властивості. Перші два члени цього ряду – гази, С5—С16 — рідини, починаючи з С17 і вище – тверді речовини. Температури кипіння і плавління циклоалканів дещо вище, ніж у алканів при однаковій кількості атомів карбону.
Отримання.
Загальним способом отримання циклоалканів є дія металів на дігалогенопохідні алканів:
![]()
Сполуки ряду
циклогексану отримують гідруванням
ароматичних вуглеводнів, наприклад:
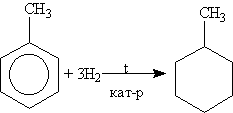
Хімічні властивості. В будові циклоалканів існує ряд особливостей, що визначають їх хімічні властивості. Малі цикли (особливо циклопропан) нестійкі і здатні до розриву, тому вони схильні до реакцій приєднання, що нагадує ненасичені сполуки. Так, циклопропан приєднує бром з розривом циклу, утворюючи 1,3-дібромпропан:
![]()
Звичайні цикли дуже стійкі і вступають тільки в реакції заміщення, подібно алканам:
![]()
