Змістовний модуль 4. „Органічна хімія. Полімери”
ПН.22: Полімерні матеріали в енергетиці
Тема 16. Основні поняття органічної хімії
Карбон (вуглець) виділяється серед всіх елементів тим, що його атоми можуть з”єднуватися один з одним в довгі ланцюги або цикли. Саме ця властивість дозволяє карбону створювати мільйони сполук, вивченню яких присвячена ціла область – органічна хімія. Декілька причин сприяли проявленню карбоном таких властивостей. Доведено, що енергія зв”язку С – С (міцність зв”язку) може бути порівнена з міцністю зв”язків С – О. Вуглець має можливість виявляти не один, а три різновиди гібридизації орбіталей: у випадку sp3- гібридизації утворюється чотири гібридних орбіталі, що мають тетраедричну орієнтацію; з їх допомогою створюються прості ковалентні зв”язки. У випадку sp2- гібридизації утворюються три гібридні орбіталі, орієнтовані в одній площині, і за їх допомогою створюються подвійні кратні зв”язки. Зрештою, за допомогою двох sp-гібридизованих орбіталей, що мають лінійну орієнтацію, між атомами карбону виникають потрійні кратні зв”язки. Добре відомо, що атоми карбону здатні утворювати прості, подвійні і потрійні зв”язки не тільки одне з одним, але і з іншими елементами.
Теорія хімічної будови А.М.Бутлєрова. Сучасна теорія будови молекул пояснює велику кількість органічних сполук і залежність їх властивостей від хімічної будови. Вона також повністю підтверджує основні принципи теорії хімічної будови, що була розроблена відомим російським вченим А.М.Бутлєровим. Основні положення цієї теорії (іноді її називають структурною):
1)атоми в молекулах з”єднані між собою в певному порядку хімічними зв”язками згідно з їх валентністю; 2)властивості речовини визначаються не лише якісним складом, але і її будовою , взаємним впливом атомів, як зв”язаних між собою хімічними зв”язками, так і не зв”язаних безпосередньо; 3)будова молекул може бути визначена на основі вивчення їх хімічних властивостей. Важливим наслідком цієї теорії був висновок про те, що кожна органічна сполука повинна мати одну хімічну формулу, що відображає її будову. Такий висновок є теоретичним обгрунтуванням добре відомого вже тоді явища ізомерії – існування речовин з однаковим молекулярним складом, але з різними властивостями.
Структурні формули. Наявність ізомерів вимагає використання не тільки простих молекулярних формул, але і структурних формул, які відбивають порядок зв”язку атомів в молекулі кожного ізомеру. В структурних формулах ковалентний зв”язок показано рисочкою. Як і в структурних формулах неорганічних речовин, кожна рисочка означає загальну електронну пару, що зв”язує атоми в молекулі.
Структурна формула - зображення хімічних зв”язків між атомами в молекулі із врахуванням їх валентності. Класифікація органічних сполук. Для класицікації органічних сполук за типами і побудови їх назв в молекулі органічної сполуки прийнято виділяти вуглецевий скелет і функціональні групи. Карбоновий скелет представляє собою послідовність хімічно зв”язаних один з одним атомів вуглецю. Функціональні групи утворюють всі атоми, крім гідрогену,або групи атомів, які зв”язані з атомом карбону. Типи карбонових скелетів. Карбонові скелети розподіляють на ациклічні (що не містять циклів), циклічні і гетероциклічні. В гетероциклічному скелеті в карбоновий цикл включається один або декілька атомів, відмінних від карбону. Такі гетероатоми розглядають не як функціональні групи, а вважають їх частиною карбонового скелету.
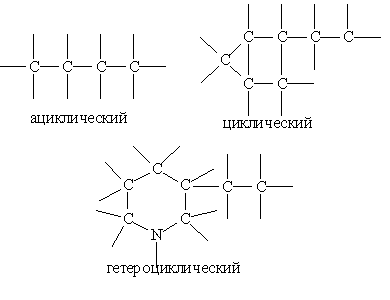
В самих карбонових скелетах треба класифікувати окремі атоми карбону за числом хімічно зв”язаних з ними атомів карбону. Якщо даний атом карбону зв”язаний з одним атомом карбону, то його називають первинним, з двома – вторинним, трьома – третинним, з чотирма – четвер-тинним. Оскільки атоми карбону можуть утворювати між собою не тільки одинарні, але і кратні (подвійні і потрійні) зв”язки, то сполуки, що містять тільки одинарні зв”язки С – С , називають насиченими, сполуки з кратними карбон – карбоновими зв”язками – ненасиченими. Сполуки, в яких атоми карбону зв”язані тільки з атомами гідрогену, називають вуглеводнями. Вуглеводні визнані родоначальними в органічній хімії. Різноманітні сполуки розглядаються як похідні вугле-воднів, отримані введенням в них функціональних груп. Функціональні групи. Більшість органічних сполук, окрім атомів карбону і гідрогену, містять атоми інших елементів (що не входять до скелету). Ці атоми або їх групи, які багато в чому визначають хімічні і фізичні властивості органічних сполук, називають функціональними групами. За ознакою таких груп сполуки відносяться до того, чи іншого класу.
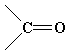
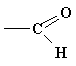
Найважливіші функціональні групи
|
Функциональні групи |
Клас сполуки |
|
|
позначення |
назва |
|
|
F, Cl, Br, I |
галоген |
Галогенпохідні вуглеводнів |
|
OH |
гідроксил |
спирти, феноли |
|
|
карбоніл |
альдегіди, кетони |
|
|
карбоксил |
карбонові кислоти |
|
NH2 |
аміногрупа |
аміни |
|
NO2 |
нітрогрупа |
нітросполуки |
Сполуки, які містять декілька функціональних груп, називають поліфункціональними. Гомологічний ряд – це поняття дуже корисне для опису органічних сполук. Гомологічний ряд утворюють сполуки, які відрізняються одна від одної на групу —СН2— і мають подібні хімічні властивості. Групи СН2 називаються гомологічною різницею. Прикладом гомологічного ряду може бути ряд насичених вуглеводнів (алканів). Простіший представник – метан СН4. Гомологами метану є: етан С2Н6, пропан С3Н8, бутан С4Н10, пентан С5Н12, гексан С6Н14, гептан С7Н16 і т. д. Формула любого наступного гомологу може бути отримана додаванням гомологічної різниці до формули попереднього вуглеводня. Розглянутий гомологічний ряд насичених вуглеводнів описується загальною формулою СnН2n+2, де п — число атомів вуглеводню.
Номенклатура органічних сполук. В наш час є визнаною систематична номенклатура IUРАС (Міжнародний союз теоретичної та прикладної хімії). Серед її варіантів найбільш розповсюдженою є замісна номенклатера: в сполуці виділяється певна основа, в якій здійснено заміщення атомів гідрогену на інші атоми або групи. Правила IUРАС дозволяють використовувати назви органічних сполук, що побудовані на основі застарілих тривіальної та раціональної номенклатур. За цими правилами назва органічної сполуки складається із назви головного ланцюгу, що утворює корінь слова, і назв функцій, які використовують в якості приставок або суфіксів. Для правильної побудови назви треба провести вибір головного ланцюгу і нумерацію атомів карбону в ньому. Замісник – це будь-який атом, або група атомів, які заміщують атом гідрогену в родоначальній структурі. Функціональна група – це атом або група атомів невуглеводневого характеру, які визначають належність сполуки до певного класу. Характеристична група — це функціональна група, яка зв”язана з родоначальною структурою.
Префікси і суфікси для позначення деяких характеристичних груп
|
Характеристична група |
Префікс |
Суфікс |
|
(С)OOH* СООН SO3H (С)H O СH O
OH SH NH2 |
карбокси сульфо- оксо- форміл- оксо- гидрокси- мерканто- аміно- |
-ова кислота -карбонова кислота -сульфокислота -аль -карбальдегід -он -ол -тіол -амін |
|
NO2 OR F, Cl, Br, I ( Hal) |
нітро- алкокси- фтор-, хлор-, бром-, йод- (галоген-) |
|
-
Атом карбону, що заключений в дужки, входить до складу головного карбонового ланцюгу.
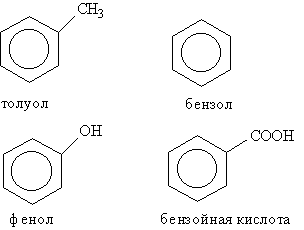
Як видно із таблиці, деякі характеристичні групи, а саме галогени, нітро- і алкоксигрупи, відображені в загальній назві тільки у вигляді префіксів, наприклад бромметан, етоксиетан, нітробензол. Нумерацію атомів вуглецю в головному ланцюгу починають з того його кінця, ближче до якого знаходиться старша група. В групі циклічних вуглеводнів особливо виділяються ароматичні вуглеводні, для яких характерна наявність в молекулі бензольного кільця. Деякі найбільш відомі представники ароматичних вуглеводнів та їх похідні мають тривіальні назви, дозволені правилами IUРАС: бензол, толуол, фенол, бензойна кислота.
Утворення назви органічної сполуки. Основу назви сполуки складає корінь слова, яке позначає насичений вуглеводень з тим же самим числом атомів, що і головний ланцюг(мет-, ет-, проп-, бут-, пент-, гекс- і т.д.). Після цього йде суфікс, що характеризує ступінь насиченості, -ан, якщо в молекулі немає кратних зв”язків, -ен при наявності подвійних зв”язків та –ин для потрійних зв”язків (наприклад ентан, пентен, пентин). Якщо кратних зв”язків в молекулі декілька, то в суфіксі зазначають число таких зв”язків: -діен, -триен, а після суфіксу обов”язково арабськими цифрами вказується положення кратного зв”язку (наприклад, бутен-1, бутен-2, бутадіен-1,3):
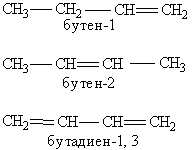
Далі в суфікс виноситься назва найстаршої характеристичної групи в молекулі і відмічається її положення цифрою. Інші замісники зазначають за допомогою приставок. Положення замісника відображається цифрою перед приставкою, наприклад: 3-метил; 2-хлор і т.п. Якщо в молекулі є декілька однакових замісників, то перед назвою відповідної групи їх кількість вказують словом (діметил-. трихлор- і т.д.). Вуглеводневі радикали мають свої назви.
Насичені вуглеводневі радикали:
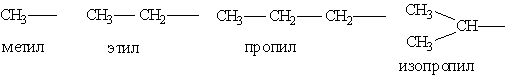
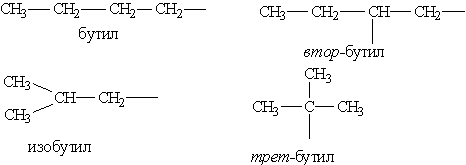
Ненасичені вуглеводневі радикали:
![]()
Ароматичні вуглеводневі радикали:
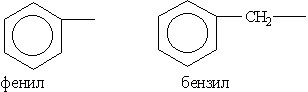
В якості прикладу
наведемо наступну сполуку:
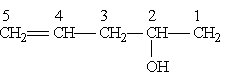
1) Вибір ланцюгу однозначний; отже, корінь слова – пент; далі йде суфікс –ен, який вказує на наявність кратного зв”язку; 2) порядок нумерації забезпечує старшій групі (-ОН) найменший номер; 3) повна назва сполуки закінчується суфіксом, що означає старшу групу (в даному випадку суфікс –ол вказує на наявність гідроксильної групи); положення подвійного зв”язку і гідроксильної групи вказується цифрами. Отже, наведена сполука називається пентен-4-ол-2.
Тривіальна номенклатура представляє собою сукупність несистематичних назв органічних сполук, що виникли історично (приклад: ацетон, оцтова кислота, формальдегід і т.д.).
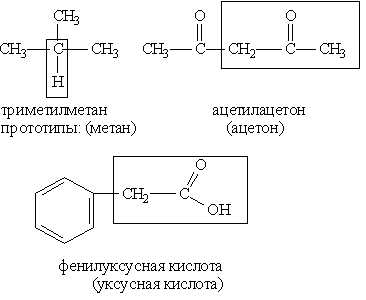
Раціональна номенклатура дозволяє будувати назву речовини на основі її структури з більш простою сполукою, вибраною в якості прототипу. Спосіб такої побудови ілюструють такі прик-лади:
Ізомерія. Вище було показано, що здатність атомів карбону до утворення чотирьох ковалентних зв”язків, в т.ч. і з іншими атомами карбону, відкриває можливість існування декількох сполук одного елементного складу – ізомерів. Всі ізомери поділяють на два великих класи – структурні ізомери і просторові ізомери. Структурні ізомери – ті, що відповідають різним структурним формулам органічних сполук (з різним порядком сполучення атомів). Просторові ізомери мають однакові замісники у кожного атома карбону і відрізняються лише їх взаємним розташуванням у просторі. Структурні ізомери. Згідно з наведеною вище класифікацією органічних сполук за типом, серед структурних ізомерів виділяють три групи: 1) сполуки, що вміщують різні функціональні групи і відносяться до різних класів органічних сполук:
![]()
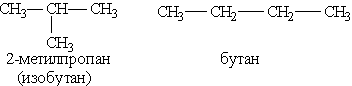
2) сполуки, що відрізняються карбоновими скелетами:
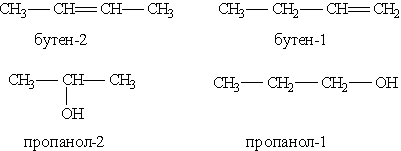
3) сполуки, що відрізняються розташуванням замісника або кратного зв”язку в молекулі:
Просторові ізомери (стереоізомери). Стереоізомери можна розподілити на два типи: геометричні ізомери і оптичні ізомери.
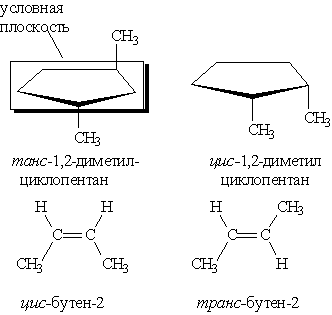
Геометрична ізомерія характерна для сполук, які мають подвійний зв”язок, або цикл. В таких молекулах часто можливо провести умовну площину таким чином, що замісники у різних атомів карбону можуть опинитися з однієї сторони (цис-) або з різних сторін (транс-) цієї площини. Якщо зміна орієнтації цих замісників відносно площини можлива лише за рахунок розриву одного з хімічних зв”язків, то говорять про наявність гометричних ізомерів. Вони відрізняються своїми фізичними і хімічними властивостями.
Оптичні ізомери - молекули, зеркальні відображення яких несумісні одне з одним. Така властивість притаманна молекулам, що мають асиметричний центр – атом карбону, зв”язаний з чотирма різними замісниками. Наприклад, у вигляді двох оптичних ізомерів існує молекула молочної кислоти СН3СН(ОН)—СООН, яка містить один асиметричний центр.
Взаємний вплив атомів в молекулі. Молекула органічної сполуки представляє собою сукуп-ність атомів, зв”язаних певним чином, як правило, ковалентними зв”язками. При цьому, зв”язані атоми можуть відрізнятися за величиною електронегативності. Від величини останньої в значній мірі залежать такі найважливіші характеристики зв”язку, як полярність і міцність (енергія утво-рення). В свою чергу, полярність і міцність зв”язків в молекулі визначають можливості молекули вступати в ті чи інші хімічні реакції. Електронегативність атому карбону залежить від стану його гібридизації. Це зв”язано з долею s -орбіталі в гибридній орбіталі: вона менше у sp3- і більше у sp2- і sp-гібридизованих атомів. Всі атоми, що складають молекулу, існують у взаємозв”язку і знахо-дяться під взаємним впливом. Цей вплив передається в основному через систему ковалентних зв”язків за допомогою так званих електронних ефектів.
Електронними ефектами називають зміщення електронної щільності в молекулі під впли-вом замісників. Атоми, що зв”язані полярним зв”язком, несуть часткові заряди, які позначають грецькою літерою “дельта” ( ). Атом, який „відтягує” електронну щільність -зв”язку у свій бік, придбає негативний заряд - . При розгляданні пари атомів з ковалентним зв”язком, більш електро-негативний атом, називають елетроноакцептором. Його партнер по -зв”язку відповідно буде мати рівний за величиною дефіцит електронної щільності, тобто частковий позитивний заряд + і буде називатись електронодонором. Зміщення електронної щільності по ланцюгу -зв”язків називається індуктивним ефектом і позначується I. Індуктивний ефект передається із згасан-ням. Напрям зміщення електронної щільності всіх -зв”язків позначують прямими стрілками. В залежності від того, чи віддаляється електронна щільність від атому карбону, що розглядається, чи наближається до нього, індуктивний ефект називають негативним (-I) або позитивним (+I). Знак і величина індуктивного ефекту визначаються різницею в електронегативності між атомом карбону, який розглядається, і групою, що його викликає. Електроноакцепторні замісники, тобто атом чи група атомів, які зміщують електронну щільність -зв”язку від атому карбону, виявляють нега-тивний індуктивний ефект (- І-ефект). Електронодонорні замісники, тобто атом чи група ато-мів, які зміщують електронну щільність до атома карбону, проявляють позитивний індуктивний ефект (+ І-ефект). +I-ефект проявляють аліфатичні вуглеводневі радикали, тобто алкільні ради-кали (метил, етил, і т.д.). Більшість функціональних груп проявляють -I-ефект: галогени, аміно-група, гідроксильна, карбонільна, карбоксильна групи. Індуктивний ефект виявляється і у випадку, коли зв”язані атоми карбону різні за станом гібридизації. Так, в молекулі пропена метильна група проявляє +I-ефект, оскільки атом карбону в ній знаходиться в sp3- гібридному стані, а sp2- гібри-дизований атом (при подвійному зв”язку) виступає в ролі электроноакцептора тому, що має більш високу електронегативність:
![]()
При передачі індуктивного ефекту метильної групи на подвійний зв”язок в першу чергу її вплив відчуває більш рухливий -зв”язок. Вплив замісника на розподілення електронної щільності, яка передається по -зв”язкам, називають мезомерним ефектом (М). Цей ефект також може бути негативним чи позитивним. В структурних формулах його відображають зігнутою стрілкою, яка починається у центра електронної щільності і завершується в тому місці, куди зміщується електронна щільність. Наявність електронних ефектів веде до перерозподілу електронної щіль-ності в молекулі і появі часткових зарядів на окремих атомах. Це визначає реакційну здатність молекули.