
Лабораторна робота № 5
на тему: “Вимірювання швидкості корозії електрохімічним методом
в присутності інгібітору”.
Мета роботи: Вивчення впливу інгібітору на швидкість корозії.
1 Теоретичні основи
Інгібіторами корозії називають речовини, які при додаванні їх в корозійне середовище в незначній кількості помітно знижують швидкість електрохімічної корозії металу або сплаву. По своїй природі інгібітори корозії бувають іонними (катіонового типу – катанін, 4М; аніонового типу – тіосечовина), або молекулярними сполуками. За механізмом гальмівної дії на електрохімічний процес корозії інгібітори діляться на анодні, катодні, екрануючі (плівкоутворювачі) і мішані.
Інгібітори, адсорбуючись на поверхні металу, гальмують протікання анодного або катодного процесу електрохімічної корозії, або утворюючи екрануючу плівку, ізолюють метал від електроліту.
За складом розрізняють неорганічні та органічні інгібітори корозії.
Анодними інгібіторами електрохімічної корозії металів є окислювачі -(пасиватори): кисень, нітриди, хромати та ін. При недостатній концентрації анодних інгібіторів для настання повної пасивності металу (особливо в присутності активаторів корозії), вони є небезпечними, тому що вони можуть прискорити загальну або місцеву корозію, діючи як катодні деполяризатори. Катодні інгібітори електрохімічної корозії металів – це речовини, які підвищують перенапругу катодного процесу при їх адсорбції на катодних ділянках поверхні кородуючого металу.
Максимальна ефективність інгібування досягається при комбінуванні катодного і інгібіторного захисту, коли поєднується застосування катодної поляризації і гальмівників катодного типу.
Екрануючі інгібітори електрохімічної корозії металів, адсорбуючись на металі, утворюють хемосорбційний шар або захисну плівку нерозчинних продуктів. Прикладом змішаних інгібіторів електрохімічної корозії може бути каталін або нітрати амінів, які пасивують поверхню сталі, що утворюється при їх гідролізі азотистою кислотою, а амін, який вивільнився, зв’язує вуглекислоту, яка поступає із повітря.
Ефективність дії інгібіторів електрохімічної корозії металів прийнято характеризувати величиною захисної дії М, % або захисного ефекту:
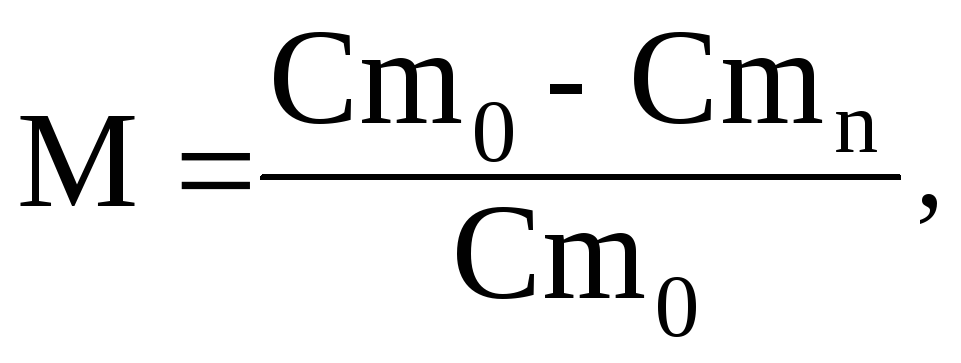 (1)
(1)
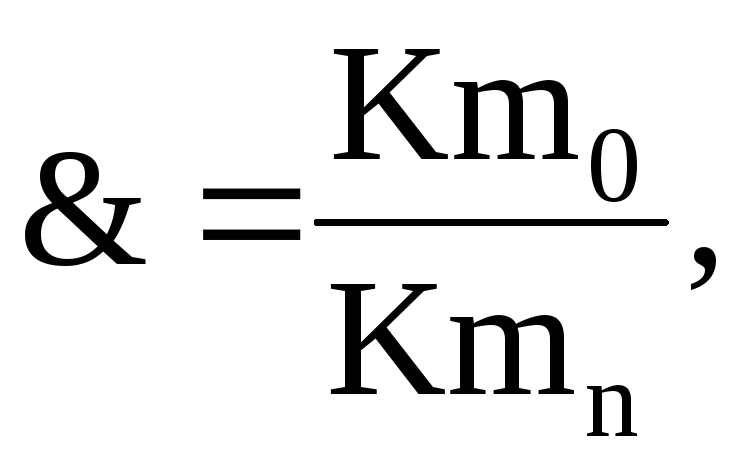 (2)
(2)
де Сmо - швидкість розчинення металу без інгібітору;
С mn- швидкість розчинення металу з інгібітором.
У наш час випускаються і використовуються інгібітори ІКБ-2, ІКБ-4, ІКН-4, мідноаміачний комплекс (кронос – С), катанід (КПІ-9. КПІ – 9Т), уротропін та ін.
Інгібітори марки УКБ-2 призначені для захисту обладнання від корозії сірководнем і хлористим воднем. Ефект захисту при його використанні складає в окремих випадках 98%. Але як показала практика, при роботі з ним на поверхні обладнання утворюються важкорозчинні смолисті речовини, які знижують процеси масообміну, зменшують прохідні діаметри трубопроводів, а також в якійсь мірі можливе забруднення продукції.
Інгібітор ІКБ-4 водорозчинного типу використовується для захисту обладнання від корозії сірководнем, хлористим воднем і систем, які контактують з оборотною водою. Мідно-аміачний комплекс з содою – інгібітор нейтралізуючого типу. Перевагою цього інгібітору є відсутність утворення шкідливих домішок, але ефект захисної дії порівняно невеликий (близько 60%).
Позитивний результат був одержаний при спільному введенні в системну інгібіторів ІКБ-4 і КРОНОС-С. В цьому випадку удалося знизити дозування ІКБ-2 вдвічі (при збереженні високого ефекту захисну -98%).
2. Посуд та обладнання
- мірний стакан ємкістю 250 см3;
- піпетка Мора ємкістю 10 см3;
- вимірювач швидкості корозії Р-5035.
3. Розчини, та допоміжні матеріали
- кислота соляна, розчин з масовою часткою 15%;
- уротропін;
- вода дистильована;
- спирт етиловий нерозбавлений;
- папір наждачний;
- папір фільтрувальний;
- салфетка бязева.
4 Опис лабораторної установки
Лабораторна установка для вимірювання швидкості корозії складається із двох металевих електродів (1), розмішених у вимірювальному стакані (2) з розчином соляної кислоти. Електроди розміщені паралельно на відстані 0,5 см, та сполучені з вимірювачем швидкості корозії Р-5035 (3) за допомогою електричного дроту через вивідні контактні пристрої.
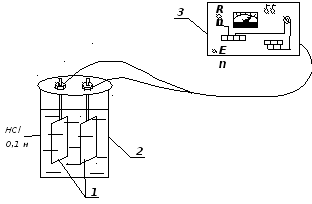

1 – залізні електроди; 2 – вимірювальний стакан; 3 – вимірювач швидкості корозії Р-5035.
Рисунок 1 – Схема лабораторної установки для вимірювання швидкості корозії металів
5 Послідовність виконання роботи
Проводимо зачищення металевих електродів наждачним папером до повного зникнення слідів корозії, вимірюємо площу їх поверхні, знежирюємо поверхню етиловим спиртом та розміщуємо їх у вимірювальному стакані. За допомогою піпетки Мора заливаємо 30 см3 розчину соляної у вимірювальний стакан, після чого вводимо інгібітор корозії у кількості 1 г/л. Перемішуємо розчин і проводимо вимірювання та розрахунки, як у визначенні швидкості корозії без додавання інгібітору. Поверхня електродів повинна повністю покритися розчином кислоти. Вмикаємо прилад Р-5035 натисканням кнопки "Вкл". Вмикаємо перший піддіапазон вимірювання натисканням кнопки "0,1". Виконуємо компенсацію опору розчину "Кр", для чого натискуємо кнопку "^" і, повертаючи ручку "Rр", досягаємо нульового положення стрілки індикатора. Проводимо компенсацію початкової ЕРС корозійного датчика, для чого: натискаємо кнопку "+" або "–", натискуємо кнопку "компенсація Ен", за допомогою ручок "грубо" і "точно" досягаємо нульового розміщення стрілки індикатора. Проводимо вимірювання поляризаційного опору "Rп", для чого повертаємо кнопку "компенсація Ен" в початкове положення повторним натисненням кнопки. Повертаючи ручку "Кп", досягаємо нульового положення стрілки індикатора, натискаємо кнопку "компенсація "Ен" і переконуємося, що стрілка індикатора знаходиться на нулі. Проводимо відлік виміряного поляризаційного опору по рахуючому пристрою "Rп" з урахуванням множника діапазону "0,1".
6 Опрацювання результатів
За формулами 1 – 4 виконати розрахунки поляризаційного опору процесу корозії металу та швидкості корозії за відсутності та за присутності в розчині інгібітору.
Зробити висновок про корозійну стійкість зразка металу.
7 Контрольні запитання
1. Назвати найбільш поширені інгібітори, які застосовуються в нейтральних середовищах.
2. Визначте класифікація інгібіторів корозії в нейтральних середовищах.
3. Вкажіть механізм гальмування корозії інгібіторами в нейтральних середовищах.
4. Назвіть небезпечні та безпечні інгібітори.
8. Список рекомендованої літератури
1. Жук Н.П. Курс коррозии и защита металлов. - М.: Металлургия, 1968. - 408 с.
2. Улиг Г.Г.,. Реви Р.У. Коррозия и борьба с ней. Введение в коррозионную науку и технику. - Ленинград: Химия, 1989. - 454с.
3. Рачев Х и др. Справочник по коррозии / Пер. с болг. - М.: Мир, 1982. –
