
Лабораторна робота №1
на тему “Визначення швидкості корозії ваговим методом
в розчинах кислот”.
Мета роботи: Практичне ознайомлення в лабораторних умовах з методами визначення швидкості корості ваговим методом.
1 Теоретичні основи
Корозія металів в електролітах називається електрохімічною корозією. Чим чистіший метал, тим гірше він розчиняється в кислотах. Процес корозії металів в розчинах з виділенням водню, в яких Д*Н+, називається водневою деполяризацією, або перенапруженням з виділенням водню. Воднева деполяризація – це катодна деполяризація, яка здійснюється водневими іонами за реакцією:
Н+
Н2О
+ ē = Н+
+ Н2О
=
![]() Н2
Н2О
(1)
Н2
Н2О
(1)
З водневою деполяризацією кородують метали, які торкаються з, розчинами кислот, наприклад,сталеві залізничні цистерни, в яких перевозять кислоти, металеві баки та різні апарати на хімічних заводах, металеве обладнання травильних відділень прокатних цехів та цехів гальванічних покриттів, в яких виконується кислотне травлення окалини та іржі, металеві вироби, що травляться в кислотах.
Принципова можливість протікання процесу електрохімічної корозії металу визначаться співвідношенням оборотного потенціалу металу в даних умовах та оборотного потенціалу катодного процесу в даних умовах.
Довільне протікання електрохімічного корозійного процесу можливо, якщо:
(Va) обор. = (VМе) обор. < (Vк) обор., (2)
де (Va) обор , (VМе) обор. , (Vк) обор.- оборотні потенціали катодної та
анодної реакції в цих умовах, та металу, В.
Таким чином, для електрохімічного розчинення металу необхідна присутність в електроліті окислювача – деполяризатора, оборотний окислювально-відновний потенціал якого більш позитивний, ніж оборотний, потенціал металу в цих умовах.
Процес електрохімічної корозії термодинамічно можливий при дотриманні такої умови:
∆GT <0. ET >0 (3)
де ∆GT – змінна ізобарно-ізотермічного потенціалу цього
корозійного пронесу, кал/г-атом Ме;
ЕТ - е.р.с. гальванічного елементу, В.
Електрорушійні сили гальванічного елементу визначаються за формулою:
ЕТ = (Vк)обор. – (Va)обор. (4)
Протікання процесу корозії металу з водневою деполяризацією можливе якщо
(VМе) обор. < (Vа) обор., (5)
![]() (6)
(6)
Де
![]() - оборотний потенціал водневого електроду
в них умовах, В.
- оборотний потенціал водневого електроду
в них умовах, В.
Таблиця 1 - Стандартні-окислювально-відновні потенціали у водних розчинах при 250 С по відношенню до нормального водневого електроду.
|
Електродний процес |
Eº, В |
Електродний процес |
Eº, В |
|
Iі+ + ē = Іi |
-3,050 |
Те+ + ē = Те |
– 0,336 |
|
К+ + ē = К |
-2,930 |
Со2+ +2ē = Со |
– 0,277 |
|
Ва 2+ + 2ē = Ва |
-2,910 |
Ni2+ + 2ē = Ni |
– 0,250 |
|
Са 2+ + 2ē= Са |
-2,870 |
In2+ +2ē = In |
– 0,136 |
|
Nа+ + ē= Na |
-2,710 |
Рb2+ + 2ē Pb |
– 0,126 |
|
Mg2++2ē = Мg |
-2,370 |
2Н+ + 2ē = Н2 |
– 0,000 |
|
АІ3+ + Зē = АІ |
-1,660 |
Сu2+ + 2ē = Сu |
+ 0,337 |
|
Мn2++ 2ē = Мn |
-1,180 |
Сu+ + ē = Сu+ |
+0,512 |
|
Zn2+ + 2ē = Zn |
-0,763 |
Аg+ + ē = Аg |
+ 0,800 |
|
Сr3+ + Зē = Сr |
-0,740 |
Нg2+ + 2ē = Hg |
+ 0,854 |
|
Fe2+ + 2ē=Fе |
-0,440 |
Рt2+ + 2ē = Pt |
+ 1,188 |
|
Сd2+ +2ē = Сd |
-0,403 |
АuЗ+ +Зē = Аu |
+ 1,500 |
Катодний процес водневої деполяризації у кислих середовищах :складається із слідуючих стадій:
1) дифузії та міграції гідратованих іонів водню Н+Н2О до катодних ділянок поверхні кородуючого металу%;
2) розряду водневих іонів:
Н+Н2О + ē = Н адс + Н2О (7)
3) розчинення та дифузії частини Надс - атомів у металі
4) рекомбінація (молізація) водневих атомів
Н адс + Н адс = Н2 (8)
або електрохімічної десорбції
Надс + Н+ІІ2О +ē = Н2 +Н2О (9)
5) дифузії та переносу конвекцією водню від катодних ділянок в
глибину розчину, а потім його дифузії у повітря
6) утворення та відриву бульбашки водню від поверхні металу
Н2+ Н2 + Н2 +... = nН2↑ (10)
В лужних розчинах, в яких концентрація іонів Н+Н2О вкрай мала, корозія металів з виділенням водню іде за рахунок відновлення водню із молекули води
Н2О + е- = Наяс + ОН-, (11)
внаслідок чого з'являється додаткова стадія відводу іонів ОН- в глибину розчину.
Корозія металів ті водневою деполяризацією має свої властивості:
1) декілька менша по зрівнянню з кисневою деполяризацією, залежність від перемішування електроліту, особливо в розчинах кислот;
2) велика залежність від рН розчину, так як із зменшенням рН (VН2)обор. стає позитивнішим, перенапруга в кислих розчинах знижується, а в лужних - зростає;
3) велика залежність від природи та вмісту катодних домішок або структурних складових сплаву:чим нижча перенапруга водню на катодних домішках або структурних складових сплаву і чи»» більший їх вміст, тим більша швидкість корозійного процесу;
4) велика залежність швидкості корозії від адсорбції на кородуючому металі різних речовин, які впливають на будову подвійного електричного тату та величину перенапруги водню на металі;
5) протікання процесу з прискоренням, тобто із збільшенням швидкості корозії в часі, це пов'язано з тим, що проходження катодної реакції розряду водневих іонів полегшується в результаті збільшення числа мікрокатодів на поверхні кородуючого металу за рахунок відкриття нових катодних ділянок по мірі розчинення металу;
6) більша можливість появлення водневої крихкості металів
2 Опис лабораторної установки.
Лабораторна установка для вивчення швидкості корозії ваговим методом складається із 12 конічних колб ємкістю V = 100 см3 (1), в яких розміщуємо металеві зразки (2) алюмінію, та заліза і заливаємо їх розчинами кислот.
Металеві зразки можна розміщувати в розчинах за допомогою фторопластової стрічки (3).
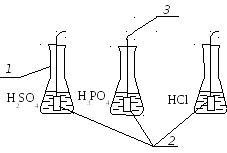
1 - колба конічна ємкістю V = 100 см;
2 - металеві зразки;
3 - стрічка фторопластова
Рисунок 1 – Схема лабораторної установки для вивчення швидкості корозії ваговим методом
3 Засоби вимірювання
- Ваги лабораторні тнщ ВЛР - 200,2 класу точності, похибки при масі вантажу 0 - 25 г ±0,25 мг, - 1 шт;
- Колба конічна ємкістю 100 см3 ТХС. - 12 шт;
- Циліндр вимірний ємкістю 50 см3 - 3 шт.
4 Реактиви та розчини
- Кислота сірчана ( Н2SO4), розчини з масовими частками 15% і 30%;
- Солена кислота, розчини є масовими частками 15% і 30%;
- Фосфорна кислота (H3PO4), розчини е масовими частками 15% і 30%;
- Спирт етиловий з масовою часткою С = 96 % мас;
- Ацетон.
5 Допоміжні матеріали
- Зразки металів (Fe, Al,Сu) або інші за завданням викладача)
- Стрічка фторопластова,
- Папір наждачний.
- Папір фільтрувальний.
6 Методика проведення робіт
Беремо 6 зразків заліза та 6 зразків алюмінію. Вимірюємо їх площу і зачищаємо наждачним папером до повного видалення слідів іржі та зняття з них оксидної плівки. Потім зразки знежирюємо етиловим спиртом, та зважуємо на аналітичних вагах до четвертого знаку після коми.
Всі зразки розміщуємо у конічних колбах ємкістю 100 см3 і наливаємо в кожну циліндром по 50 см3 І5%-го та 30%-го розчинів НСІ, Н2SO4 та Н3РО4. Такиv чином, зразки заліза та зразки алюмінію будуть знаходиться одночасно як в 15%-них, так і в 30%-них розчинах кислот.
Розміщуємо в колбах металеві зразки поклавши їх на дно колби. Та витримуємо в кислотах на протязі 30 хвилин. Потім їх дістаємо за допомогою пінцету, промиваємо дистильованою водою, висушуємо фільтрувальним папером і зважуємо на аналітичних вагах. Після цього зразки знову розміщуємо в тих самих колбах і залишаємо на 24 години. Через 24 години зразки металів знову дістаємо із колб, промиваємо, просушуємо і зважуємо.
7 Обробка результатів дослідів
Показник зміни маси:
![]() (7)
(7)
де Δm - втрата маси металу за час випробування після видалення продуктів корозії, г; т - час випробування, год;
S - площа зразку, м2.
Втрата маси металу визначається як різниця між початковою масою та масою зразка після досліду m1 (m2, m3, ..., mn):
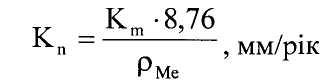 (8)
(8)
де рМе - щільність металу, г/см3.
Результати розрахунків занести до таблиці 2.
Таблиця 2 – Вихідні і дослідні дані та результати розрахунків
|
Найменування |
Умовні позначки |
Роз |
Величина |
|||||||
|
I |
II |
III |
IV |
V |
VI |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
||
|
Лабораторна робота №1 |
||||||||||
|
1 Площа зразку: |
S |
м2 |
|
|
|
|
|
|
||
|
- залізного; |
|
|
|
|
|
|
|
|
||
|
- алюмін.; |
|
|
|
|
|
|
|
|
||
|
- мідного. |
|
|
|
|
|
|
|
|
||
|
2 Маса залізного зразку: |
||||||||||
|
- початкова; |
m0 |
г |
|
|
|
|
|
|
||
|
- після І зваж.; |
m1 |
г |
|
|
|
|
|
|
||
|
- після ІІ зваж. |
m2 |
г |
|
|
|
|
|
|
||
|
3 Маса алюмінієвого зразку: |
||||||||||
|
- початкова; |
m0 |
г |
|
|
|
|
|
|
||
|
- після І зваж.; |
m1 |
г |
|
|
|
|
|
|
||
|
- після ІІ зваж. |
m2 |
г |
|
|
|
|
|
|
||
|
4 Маса мідного зразку: |
||||||||||
|
- початкова; |
m0 |
г |
|
|
|
|
|
|
||
|
- після І зваж.; |
m1 |
г |
|
|
|
|
|
|
||
|
- після ІІ зваж. |
m2 |
г |
|
|
|
|
|
|
||
|
5
Показник зміни маси зразків при 15%-ому
розчині кислот ( |
||||||||||
|
5.1 HCl |
|
|
|
|
|
|
|
|
||
|
- залізний; |
|
|
|
|
|
|
|
|
||
|
- алюмінієвий; |
|
|
|
|
|
|
|
|
||
|
- мідний. |
|
|
|
|
|
|
|
|
||
|
5.2 H2SO4 |
|
|
|
|
|
|
|
|
||
|
- залізний; |
|
|
|
|
|
|
|
|
||
|
- алюмінієвий; |
|
|
|
|
|
|
|
|
||
|
- мідний. |
|
|
|
|
|
|
|
|
||
|
5.3 H3РO4 |
|
|
|
|
|
|
|
|
||
|
- залізний; |
|
|
|
|
|
|
|
|
||
|
- алюмінієвий; |
|
|
|
|
|
|
|
|
||
|
- мідний. |
|
|
|
|
|
|
|
|
||
|
|
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
||
|
6
Показник зміни маси зразків при 30%-ому
розчині кислот ( |
||||||||||
|
6.1 HCl |
|
|
|
|
|
|
|
|
||
|
- залізний; |
|
|
|
|
|
|
|
|
||
|
- алюмінієвий; |
|
|
|
|
|
|
|
|
||
|
- мідний. |
|
|
|
|
|
|
|
|
||
|
6.2 H2SO4 |
|
|
|
|
|
|
|
|
||
|
- залізний; |
|
|
|
|
|
|
|
|
||
|
- алюмінієвий; |
|
|
|
|
|
|
|
|
||
|
- мідний. |
|
|
|
|
|
|
|
|
||
|
6.3 H3РO4 |
|
|
|
|
|
|
|
|
||
|
- залізний; |
|
|
|
|
|
|
|
|
||
|
- алюмінієвий; |
|
|
|
|
|
|
|
|
||
|
- мідний. |
|
|
|
|
|
|
|
|
||
|
7
Глибинний показник корозії зразків
при 15%-ому розчині кислот ( |
||||||||||
|
7.1 HCl |
|
|
|
|
|
|
|
|
||
|
- залізний; |
|
|
|
|
|
|
|
|
||
|
- алюмінієвий; |
|
|
|
|
|
|
|
|
||
|
- мідний. |
|
|
|
|
|
|
|
|
||
|
7.2 H2SO4 |
|
|
|
|
|
|
|
|
||
|
- залізний; |
|
|
|
|
|
|
|
|
||
|
- алюмінієвий; |
|
|
|
|
|
|
|
|
||
|
- мідний. |
|
|
|
|
|
|
|
|
||
|
7.3 H3РO4 |
|
|
|
|
|
|
|
|
||
|
- залізний; |
|
|
|
|
|
|
|
|
||
|
- алюмінієвий; |
|
|
|
|
|
|
|
|
||
|
- мідний. |
|
|
|
|
|
|
|
|
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
||
|
8
Глибинний показник корозії зразків
при 30%-ому розчині кислот ( |
||||||||||
|
8.1 HCl |
|
|
|
|
|
|
|
|
||
|
- залізний; |
|
|
|
|
|
|
|
|
||
|
- алюмінієвий; |
|
|
|
|
|
|
|
|
||
|
- мідний.
|
|
|
|
|
|
|
|
|
||
|
8.2 H2SO4 |
|
|
|
|
|
|
|
|
||
|
- залізний; |
|
|
|
|
|
|
|
|
||
|
- алюмінієвий; |
|
|
|
|
|
|
|
|
||
|
- мідний.
|
|
|
|
|
|
|
|
|
||
|
8.3 H3РO4 |
|
|
|
|
|
|
|
|
||
|
- залізний; |
|
|
|
|
|
|
|
|
||
|
- алюмінієвий; |
|
|
|
|
|
|
|
|
||
|
- мідний. |
|
|
|
|
|
|
|
|
||
|
9 Група корозійної стійкості та бал залізного зразка |
||||||||||
|
15%-ий р-н: |
|
|
|
|
|
|
|
|
||
|
- HCl; |
|
|
|
|
|
|
|
|
||
|
- H2SO4; |
|
|
|
|
|
|
|
|
||
|
- H3РO4. |
|
|
|
|
|
|
|
|
||
|
30%-ий р-н: |
|
|
|
|
|
|
|
|
||
|
- HCl; |
|
|
|
|
|
|
|
|
||
|
- H2SO4; |
|
|
|
|
|
|
|
|
||
|
- H3РO4. |
|
|
|
|
|
|
|
|
||
|
10 Група корозійної стійкості та бал алюмінієвого зразка |
||||||||||
|
15%-ий р-н: |
|
|
|
|
|
|
|
|
||
|
- HCl; |
|
|
|
|
|
|
|
|
||
|
- H2SO4; |
|
|
|
|
|
|
|
|
||
|
- H3РO4. |
|
|
|
|
|
|
|
|
||
|
30%-ий р-н: |
|
|
|
|
|
|
|
|
||
|
- HCl; |
|
|
|
|
|
|
|
|
||
|
- H2SO4; |
|
|
|
|
|
|
|
|
||
|
- H3РO4. |
|
|
|
|
|
|
|
|
||
|
11 Група корозійної стійкості та бал мідного зразка |
||||||||||
|
15%-ий р-н: |
|
|
|
|
|
|
|
|
||
|
- HCl; |
|
|
|
|
|
|
|
|
||
|
- H2SO4; |
|
|
|
|
|
|
|
|
||
|
- H3РO4. |
|
|
|
|
|
|
|
|
||
|
30%-ий р-н: |
|
|
|
|
|
|
|
|
||
|
- HCl; |
|
|
|
|
|
|
|
|
||
|
- H2SO4; |
|
|
|
|
|
|
|
|
||
|
- H3РO4. |
|
|
|
|
|
|
|
|
||
По величині глибинного показника Кп визначити групу і бал корозійної стійкості зразків металів згідно з десятибальною шкалою швидкості.
Побудувати графіки залежності зміни маси (Am) зразків Fe, Al, Cu віднесеної до одиниці поверхні (S), від часу (т) для різних корозійних середовищ.
8 Контрольні запитання
1. Наведіть основні статті збитків, що наносяться корозією металів при експлуатації обладнання.
2. Що таке хімічна корозія металів та за яких умов вона протікає?
3. Що таке електрохімічна корозія металів та за яких умов вона протікає?
4. Класифікація процесів корозії металів.
5. Як класифікуються процеси корозії металів за видом корозійних руйнувань?
6. Як класифікуються процеси корозії металів за умовами протікання ?
7. Дати характеристику основних показників корозійного процесу.
9. Список рекомендованої літератури
Список літератури
1. Жук Н.П. Курс коррозии и защита металлов. - М.: Металлургия, 1968. - 408 с.
2. Улиг Г.Г.,. Реви Р.У. Коррозия и борьба с ней. Введение в коррозионную науку и технику. - Ленинград: Химия, 1989. - 454с.
3. Рачев Х и др. Справочник по коррозии / Пер. с болг. - М.: Мир, 1982. - 520 с.
