
- •1. Предмет коллоидной химии. Почему поверхностные явления и дисперсные системы изучают в рамках одной дисциплины -коллоидной химии? Значение коллоидной химии для технологии.
- •2. Признаки объектов коллоидной химии: гетерогенность и дисперсность.
- •3. Классификация дисперсных систем по размерам частиц дисперсной фазы.
- •5. Классификация дисперсных систем по взаимодействию дисперсной фазы и дисперсионной среды.
- •7. Классификация поверхностных явлений.
- •9. Поверхностное натяжение, его определения и размерности.
- •10. Метод избыточных величин Гиббса. Вывод фундаментального уравнения Гиббса для свободной энергии системы с плоской границей раздела фаз.
- •11. Вывод фундаментального уравнения Гиббса для свободной энергии плоского поверхностного слоя, его анализ.
- •12. Понятие об адсорбции. Причины адсорбции. Количественные характеристики адсорбции.
- •13. Вывод адсорбционного уравнения Гиббса для разбавленных растворов, его анализ.
- •14. Поверхностная активность по Ребиндеру. Графическое определение поверхностной активности.
- •15. Сталагмометрический и тензиометрический методы исследования поверхностного натяжения.
- •16. Переход от изотермы поверхностного натяжения к изотерме адсорбции графическим методом, расчет величины Гмах с помощью уравнения Ленгмюра.
- •17. Влияние на адсорбцию на границе раствор-газ строения и размера молекул пав. Правило Траубе, его аналитическое выражение и физическое обоснование.
- •18. Уравнение Шишковского, связь с его помощью уравнений Ленгмюра и Гиббса.
- •20. Строение адсорбционных пленок на жидкой поверхности. Диаграммы строения поверхностных пленок.
- •21. Вывод уравнения состояния двухмерного газа. Уравнение Фрумкина для реального двухмерного газа.
- •22. Адсорбция на границе твердое тело-газ. Теория мономолекулярной адсорбции Ленгмюра. Вывод и анализ уравнения изотермы мономолекулярной адсорбции Ленгмюра.
- •23. Линейная форма уравнения Ленгмюра. Нахождение констант уравнения Ленгмюра графическим методом. Определение удельной поверхности адсорбента.
- •24. Адсорбция как обратимый экзотермический процесс. Интегральная и дифференци-альная теплота адсорбции.
- •25. Сравнительная характеристика физической адсорбции и хемосорбции.
- •26. Кривые потенциальной энергии для физической адсорбции и хемосорбции.
- •27. Природа адсорбционных сил. Уравнение Леннарда-Джонса.
- •28. Теория полимолекулярной адсорбции бэт, предпосылки теории. Уравнение изотермы адсорбции бэт, его анализ.
- •29. Линейная форма уравнения бэт. Нахождение констант уравнения бэт графическим методом. Определение удельной поверхности адсорбента.
- •30. Кинетика адсорбции. Динамическое уравнение адсорбции. Уравнение Френкеля. Кинетические кривые адсорбции при разных температурах.
- •31. Смачивание. Краевой угол и теплота смачивания. Уравнение Юнга. Влияние пав на смачивание.
- •32. Когезия и адгезия. Характер разрушения адгезионного соединения. Условие адгезионного разрушения. Уравнение Дюпре для работы адгезии.
- •33. Условие растекания жидкостей. Коэффициент растекания по Гаркинсу. Эффект Марангони.
- •34. Связь адгезии и смачивания. Вывод уравнения Дюпре-Юнга, его анализ.
- •35. Межфазное натяжение на границе между взаимно насыщенными жидкостями. Правило Антонова.
- •36. Адсорбция на границе раздела твердое тело-раствор. Обращение правила Траубе при адсорбции из водных и углеводородных растворов. Правило уравнивания полярностей Ребиндера.
- •37. Ионная адсорбция. Влияние радиуса и валентности иона на величину адсорбции.
- •38. Классификация пав по химическому строению.
- •39. Коллоидные поверхностно-активные вещества. Мицеллообразование, строение мицелл в водной и углеводородной среде.
- •40. Две модели мицеллообразования.
- •41. Термодинамика образования прямых и обратных мицелл.
- •42. Критическая концентрация мицеллообразования (ккм). Методы определения ккм в полярных и неполярных средах. Влияние различных факторов на величину ккм в полярных и неполярных средах.
- •43. Солюбилизация в растворах мицеллообразующих пав. Механизмы солюбилизации в мицеллах пав. Влияние различных факторов на солюбилизацию.
- •44. Влияние температуры на растворимость ионогенных пав. Диаграммы состояния системы. Точка Крафта.
- •45. Влияние температуры на растворимость неионогенных пав. Точка помутнения и точка высаливания.
- •46. Полиморфные превращения мицелл коллоидных пав. Лиотропные жидкие кристаллы.
- •47. Количественные характеристики свойств пав, Числа глб. Расчет чисел глб по методу Дэвиса.
- •48. Методы диспергирования. Уравнение Ребиндера для работы измельчения.
- •49. Адсорбционное понижение прочности(эффект Ребиндера). Прочность как поверхностное свойство материалов.
- •50. Конденсационное образование лиофобных дисперсных систем. Термодинамические основы гомогенного зародышеобразования. Уравнение для работы образования критического зародыша.
- •51. Химические и физические методы создания метастабильности в системе. Зависимость размера частиц от различных факторов.
- •52. Гетерогенная конденсация.
- •53. Причины построения мицелл ионностабилизованных золей. Привести примеры.
- •54. Пептизация как физико-химический метод получения коллоидных систем. Механизмы пептизации. Правило осадков Оствальда.
- •55. Получение лиофильных коллоидных систем путем самопроизвольного диспергирования. Вывод уравнения Ребиндера-Щукина.
- •56. Броуновское движение, его причины и общенаучное значение.
- •57. Соотношение между средне квадратичным сдвигом и коэффициентом диффузии. Вывод уравнения Эйншнеина-Смолуховского.
- •58. Понятие о диффузии. Первый и второй законы Фика. Физический смысл коэффициента диффузии, его размерность.
- •59. Диффузионно-седиментационное равновесие. Вывод гипсометрического закона.
- •61. Интегральные и дифференциальные кривые распределения частиц полидисперсных систем по размерам.
- •62. Седиментация в центробежном поле. Определение массы частиц методом скоростного ультрацентрифугирования.
- •67. Виды рэлеевского рассеяния света и его условия. Физическая сущность рассеяния света.
- •68. Индикатрисы рассеяния поляризованного и неполяризованного света большими и малыми частями.
- •69. Уравнение Рэлея, условия его применения анализ.
- •70.Оптические методы исследования дисперсных систем. Нефелометрия. Схема нефелометра. Определение размера коллоидных частиц методом нефелометрии.
- •71. Определение размера коллоидных частиц методом турбодиметрии.
- •72. Микроскопия. Предел разрешения светового и электронного микроскопов. Формирование изображения в световом и электронном микроскопе.
- •73. Принцип темнопольной микроскопии. Щелевой ультрамикроскоп, конденсор темного поля. Определение численной концентрации и размера коллоидных частиц.
- •74. Поглощение света дисперсными системами. Уравнение Бугера-Ламберта-Бера для истинных растворов. Чему равны оптическая плотность, мутность и светопропускание растворов?
- •75. Фиктивная абсорбция света в коллоидных системах.
- •76. Причины и механизмы возникновения заряда на поверхности частиц.
- •77. Связь электрического потенциала с поверхностным натяжением. Вывод уравнения Липмана, его анализ.
- •78. Электрокинетические явления, их классификация по причинно-следственной связи и по объектам исследования.
- •79. Строение двойного электрического слоя(дэс). Количественная модель Гуи-Чепмена.
- •80. Модель Штерна(внутренняя часть дэс).
- •1) Изоэлектрическая точка возникает при полной помперсации заряда поверхности
- •82. Действие неиндеферентного электролита на дэс.
- •83. Влияние разбавления, температуры и неиндеферентного электролита на дэс.
- •84. Вывод формулы Гельмгольца-Смолуховского для определения величины электрокинетического потенциала по данным электроосмоса или электрофореза.
- •85. Агрегативная и седиментационная устойчивость коллоидных систем. Стабилизаторы, и их роль в придании коллоидной системе временной агрегативной устойчивости.
- •86. Факторы устойчивости коллоидных систем.
- •88. Зависимость скорости коагуляции от концентрации электролита, быстрая и медленная коагуляция.
- •89. Кривые потенциальной энергии для систем с различной степенью агрегативной устойчивости.
- •90. Кинетика коагуляции по Смолуховскому. Вывод уравнения для концентрации частиц через время коагуляции τ. Константы скорости быстрой и медленной коагуляции.
- •91. Правила коагуляции электролитами с точки зрения строения дэс.
- •92. Концентрационная и нейтрализационная коагуляция.
- •93. Расклинивающее давление, его компоненты.
- •94. Идеальные модели реологии. Модели Гука, Ньютона, Сен-Венана-Кулона.
- •95. Принципы моделирования реологических свойств. Модель упругого тела Максвелла, Вывод уравнения, являющегося его математической моделью.
- •96. Модель вязкопластического тела Бингама. Пластическая вязкость.
- •97. Причина неподчинения дисперсных систем закону Ньютона. Кривые течения реальных дисперсных систем. Уравнение Оствальда – Вейля.
- •98. Вязкость жидкообразных агрегативно устойчивых дисперсных систем. Уравнение Эйнштейна. Причины неподчинения коллоидных систем уравнению Эйнштейна.
- •99. Зависимость вязкости дисперсных систем от напряжения сдвига.
- •100. Механизмы гибкости полимерной цепи: поворотно-изомерных и персистентный.
- •101. Размеры и форма макромолекул в растворе. Свойства гауссова клубка.
- •102. Термодинамическое сродство полимера к растворителю. Количественные критерии его характеризующие.
- •103. Набухание как первая стадия растворения полимеров. Причины органического набухания полимеров.
- •104. Термодинамика набухания и растворения.
- •106. Межмолекулярные и внутримолекулярные взаимодействия в растворах полимеров. Температура Флори(θ).
- •108. Термодинамическая равновесность растворов полимеров. Фазовая диаграмма раствора полимера.
25. Сравнительная характеристика физической адсорбции и хемосорбции.
|
физическая адсорбция |
хемосорбция |
|
Ван-дер-Вальсовы силы(ориентационные, дисперсионные, индукционные) |
Химические природные силы |
|
Не специфична. Sуд-решающая величина |
Специфическая. Энергетический-решающий фактор |
|
Обратима |
Необратима |
|
Qa=10-40 кДж/моль |
Qa=100-400 кДж/моль |
|
С ↑Т ↓А |
С ↑Т ↑А |
|
Не локализована |
Локализавана |
26. Кривые потенциальной энергии для физической адсорбции и хемосорбции.
Адсорбция двухатомного газа на металле(х2)
U-энергия межмолекулярного взаимодействия. 1-физическая адсорбция х2=х+х
по 2 1 2-хемосорбция Θ=0
вер Qха(Θ80)
хно
сть Е
ад r-расстояние от пов-ти
сор
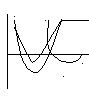 бен Qха(Θ0)
бен Qха(Θ0)
та
27. Природа адсорбционных сил. Уравнение Леннарда-Джонса.
Природа адсорбционных сил- физическая адсорбция происходит под действие межмолекулярных Ван-дер-Вальсовых сил. 1)ориентационные(полярный адсорбент-полярный адсорбтив) 2)дисперсионные( неполярный адсорбент-неполярный адсорбтив) 3)индукционные(неполярный адсорбент-полярный адсорбтив, полярный адсорбент-неполярный адсорбтив). Наиболее распространены дисперсионные силы, они имеют квантовую природу, проявляются между мгновенными диполями, возникают при сближении молекул за счет флуктуации электрической плотности. Uмежмол взаим=Uор+Uдисп+Uинд. Адсорбционные силы являются дальнодействующими и распространяются на расстояние 10-7м. энергия межмолекулярного дисперсионного притяжения:Uпр=-С/r6, «-» условный. Энергия борновского отталкивания: Uотт=В/r12. Энергия дисперсионного взаимодействия для одной молекулы U= С/r6+ В/r12- у-ние Леннарда-Джонса. Полная энергия взаимодействия: U= СΣ1/r6+ ВΣ1/r12-тк идет суммирование сил адсорбции силы являются дальнодействующими.
И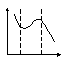 зобара
адсорбции.
зобара
адсорбции.
А Р=const
1 2 3 1-физическая адсорбция 2- переход от физической к хемосорбции
3-разложение адсорбционного комплекса.
Т
28. Теория полимолекулярной адсорбции бэт, предпосылки теории. Уравнение изотермы адсорбции бэт, его анализ.
БЭТ(Брунауэр, Эммет, Теллер).
А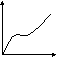 Предпосылки: 1)на поверхности
адсорбента имеется определенное число
активных
Предпосылки: 1)на поверхности
адсорбента имеется определенное число
активных
центров 2)пренебрегаем взаимодействием между соседними молекулами в
адсорбционном слое 3)каждая молекула1-ого слоя представляет собой возможный
центр для адсорбции и образования 2-ого слоя 4)предполагается что все молекулы
2-ого и всех последующих слоев имеют такую же Σ статистических состояний, как в
Р/Рs в жидком и отличаются от состояния 1-ого слоя.
Авторы рассматривали адсорбцию как серию квазистатических реакций образования единичных комплекс. Молекула газа+активный центр→единичный комплекс;
молекула газа+ единичный комплекс→двойной комплекс и тд. Q1>Q последующих слоев.
![]() ;
с=КРS- const
полимолекулярной адсорбции. КL-
const объемной конденсации.
Уравнение БЭТ:
;
с=КРS- const
полимолекулярной адсорбции. КL-
const объемной конденсации.
Уравнение БЭТ:![]() PS-давление
насыщенного пара, P/PS-относительное
давление пара.
PS-давление
насыщенного пара, P/PS-относительное
давление пара.
![]()
