
- •1. Предмет коллоидной химии. Почему поверхностные явления и дисперсные системы изучают в рамках одной дисциплины -коллоидной химии? Значение коллоидной химии для технологии.
- •2. Признаки объектов коллоидной химии: гетерогенность и дисперсность.
- •3. Классификация дисперсных систем по размерам частиц дисперсной фазы.
- •5. Классификация дисперсных систем по взаимодействию дисперсной фазы и дисперсионной среды.
- •7. Классификация поверхностных явлений.
- •9. Поверхностное натяжение, его определения и размерности.
- •10. Метод избыточных величин Гиббса. Вывод фундаментального уравнения Гиббса для свободной энергии системы с плоской границей раздела фаз.
- •11. Вывод фундаментального уравнения Гиббса для свободной энергии плоского поверхностного слоя, его анализ.
- •12. Понятие об адсорбции. Причины адсорбции. Количественные характеристики адсорбции.
- •13. Вывод адсорбционного уравнения Гиббса для разбавленных растворов, его анализ.
- •14. Поверхностная активность по Ребиндеру. Графическое определение поверхностной активности.
- •15. Сталагмометрический и тензиометрический методы исследования поверхностного натяжения.
- •16. Переход от изотермы поверхностного натяжения к изотерме адсорбции графическим методом, расчет величины Гмах с помощью уравнения Ленгмюра.
- •17. Влияние на адсорбцию на границе раствор-газ строения и размера молекул пав. Правило Траубе, его аналитическое выражение и физическое обоснование.
- •18. Уравнение Шишковского, связь с его помощью уравнений Ленгмюра и Гиббса.
- •20. Строение адсорбционных пленок на жидкой поверхности. Диаграммы строения поверхностных пленок.
- •21. Вывод уравнения состояния двухмерного газа. Уравнение Фрумкина для реального двухмерного газа.
- •22. Адсорбция на границе твердое тело-газ. Теория мономолекулярной адсорбции Ленгмюра. Вывод и анализ уравнения изотермы мономолекулярной адсорбции Ленгмюра.
- •23. Линейная форма уравнения Ленгмюра. Нахождение констант уравнения Ленгмюра графическим методом. Определение удельной поверхности адсорбента.
- •24. Адсорбция как обратимый экзотермический процесс. Интегральная и дифференци-альная теплота адсорбции.
- •25. Сравнительная характеристика физической адсорбции и хемосорбции.
- •26. Кривые потенциальной энергии для физической адсорбции и хемосорбции.
- •27. Природа адсорбционных сил. Уравнение Леннарда-Джонса.
- •28. Теория полимолекулярной адсорбции бэт, предпосылки теории. Уравнение изотермы адсорбции бэт, его анализ.
- •29. Линейная форма уравнения бэт. Нахождение констант уравнения бэт графическим методом. Определение удельной поверхности адсорбента.
- •30. Кинетика адсорбции. Динамическое уравнение адсорбции. Уравнение Френкеля. Кинетические кривые адсорбции при разных температурах.
- •31. Смачивание. Краевой угол и теплота смачивания. Уравнение Юнга. Влияние пав на смачивание.
- •32. Когезия и адгезия. Характер разрушения адгезионного соединения. Условие адгезионного разрушения. Уравнение Дюпре для работы адгезии.
- •33. Условие растекания жидкостей. Коэффициент растекания по Гаркинсу. Эффект Марангони.
- •34. Связь адгезии и смачивания. Вывод уравнения Дюпре-Юнга, его анализ.
- •35. Межфазное натяжение на границе между взаимно насыщенными жидкостями. Правило Антонова.
- •36. Адсорбция на границе раздела твердое тело-раствор. Обращение правила Траубе при адсорбции из водных и углеводородных растворов. Правило уравнивания полярностей Ребиндера.
- •37. Ионная адсорбция. Влияние радиуса и валентности иона на величину адсорбции.
- •38. Классификация пав по химическому строению.
- •39. Коллоидные поверхностно-активные вещества. Мицеллообразование, строение мицелл в водной и углеводородной среде.
- •40. Две модели мицеллообразования.
- •41. Термодинамика образования прямых и обратных мицелл.
- •42. Критическая концентрация мицеллообразования (ккм). Методы определения ккм в полярных и неполярных средах. Влияние различных факторов на величину ккм в полярных и неполярных средах.
- •43. Солюбилизация в растворах мицеллообразующих пав. Механизмы солюбилизации в мицеллах пав. Влияние различных факторов на солюбилизацию.
- •44. Влияние температуры на растворимость ионогенных пав. Диаграммы состояния системы. Точка Крафта.
- •45. Влияние температуры на растворимость неионогенных пав. Точка помутнения и точка высаливания.
- •46. Полиморфные превращения мицелл коллоидных пав. Лиотропные жидкие кристаллы.
- •47. Количественные характеристики свойств пав, Числа глб. Расчет чисел глб по методу Дэвиса.
- •48. Методы диспергирования. Уравнение Ребиндера для работы измельчения.
- •49. Адсорбционное понижение прочности(эффект Ребиндера). Прочность как поверхностное свойство материалов.
- •50. Конденсационное образование лиофобных дисперсных систем. Термодинамические основы гомогенного зародышеобразования. Уравнение для работы образования критического зародыша.
- •51. Химические и физические методы создания метастабильности в системе. Зависимость размера частиц от различных факторов.
- •52. Гетерогенная конденсация.
- •53. Причины построения мицелл ионностабилизованных золей. Привести примеры.
- •54. Пептизация как физико-химический метод получения коллоидных систем. Механизмы пептизации. Правило осадков Оствальда.
- •55. Получение лиофильных коллоидных систем путем самопроизвольного диспергирования. Вывод уравнения Ребиндера-Щукина.
- •56. Броуновское движение, его причины и общенаучное значение.
- •57. Соотношение между средне квадратичным сдвигом и коэффициентом диффузии. Вывод уравнения Эйншнеина-Смолуховского.
- •58. Понятие о диффузии. Первый и второй законы Фика. Физический смысл коэффициента диффузии, его размерность.
- •59. Диффузионно-седиментационное равновесие. Вывод гипсометрического закона.
- •61. Интегральные и дифференциальные кривые распределения частиц полидисперсных систем по размерам.
- •62. Седиментация в центробежном поле. Определение массы частиц методом скоростного ультрацентрифугирования.
- •67. Виды рэлеевского рассеяния света и его условия. Физическая сущность рассеяния света.
- •68. Индикатрисы рассеяния поляризованного и неполяризованного света большими и малыми частями.
- •69. Уравнение Рэлея, условия его применения анализ.
- •70.Оптические методы исследования дисперсных систем. Нефелометрия. Схема нефелометра. Определение размера коллоидных частиц методом нефелометрии.
- •71. Определение размера коллоидных частиц методом турбодиметрии.
- •72. Микроскопия. Предел разрешения светового и электронного микроскопов. Формирование изображения в световом и электронном микроскопе.
- •73. Принцип темнопольной микроскопии. Щелевой ультрамикроскоп, конденсор темного поля. Определение численной концентрации и размера коллоидных частиц.
- •74. Поглощение света дисперсными системами. Уравнение Бугера-Ламберта-Бера для истинных растворов. Чему равны оптическая плотность, мутность и светопропускание растворов?
- •75. Фиктивная абсорбция света в коллоидных системах.
- •76. Причины и механизмы возникновения заряда на поверхности частиц.
- •77. Связь электрического потенциала с поверхностным натяжением. Вывод уравнения Липмана, его анализ.
- •78. Электрокинетические явления, их классификация по причинно-следственной связи и по объектам исследования.
- •79. Строение двойного электрического слоя(дэс). Количественная модель Гуи-Чепмена.
- •80. Модель Штерна(внутренняя часть дэс).
- •1) Изоэлектрическая точка возникает при полной помперсации заряда поверхности
- •82. Действие неиндеферентного электролита на дэс.
- •83. Влияние разбавления, температуры и неиндеферентного электролита на дэс.
- •84. Вывод формулы Гельмгольца-Смолуховского для определения величины электрокинетического потенциала по данным электроосмоса или электрофореза.
- •85. Агрегативная и седиментационная устойчивость коллоидных систем. Стабилизаторы, и их роль в придании коллоидной системе временной агрегативной устойчивости.
- •86. Факторы устойчивости коллоидных систем.
- •88. Зависимость скорости коагуляции от концентрации электролита, быстрая и медленная коагуляция.
- •89. Кривые потенциальной энергии для систем с различной степенью агрегативной устойчивости.
- •90. Кинетика коагуляции по Смолуховскому. Вывод уравнения для концентрации частиц через время коагуляции τ. Константы скорости быстрой и медленной коагуляции.
- •91. Правила коагуляции электролитами с точки зрения строения дэс.
- •92. Концентрационная и нейтрализационная коагуляция.
- •93. Расклинивающее давление, его компоненты.
- •94. Идеальные модели реологии. Модели Гука, Ньютона, Сен-Венана-Кулона.
- •95. Принципы моделирования реологических свойств. Модель упругого тела Максвелла, Вывод уравнения, являющегося его математической моделью.
- •96. Модель вязкопластического тела Бингама. Пластическая вязкость.
- •97. Причина неподчинения дисперсных систем закону Ньютона. Кривые течения реальных дисперсных систем. Уравнение Оствальда – Вейля.
- •98. Вязкость жидкообразных агрегативно устойчивых дисперсных систем. Уравнение Эйнштейна. Причины неподчинения коллоидных систем уравнению Эйнштейна.
- •99. Зависимость вязкости дисперсных систем от напряжения сдвига.
- •100. Механизмы гибкости полимерной цепи: поворотно-изомерных и персистентный.
- •101. Размеры и форма макромолекул в растворе. Свойства гауссова клубка.
- •102. Термодинамическое сродство полимера к растворителю. Количественные критерии его характеризующие.
- •103. Набухание как первая стадия растворения полимеров. Причины органического набухания полимеров.
- •104. Термодинамика набухания и растворения.
- •106. Межмолекулярные и внутримолекулярные взаимодействия в растворах полимеров. Температура Флори(θ).
- •108. Термодинамическая равновесность растворов полимеров. Фазовая диаграмма раствора полимера.
9. Поверхностное натяжение, его определения и размерности.
Поверхностное натяжение- изменение свободной энергии приходящееся на единицу площади. Σ- расстояние по обе стороны от границы раздела фаз за пределами которого св-ва слоя перестают отличаться от свойств объемных фаз; сила действующая на единицу длинны контура, направленная тангенсально к нему и стремящаяся этот контур сократить. (Дж /м2б Н/м), (эрг/см2, дин/см).
10. Метод избыточных величин Гиббса. Вывод фундаментального уравнения Гиббса для свободной энергии системы с плоской границей раздела фаз.
2 понятия. Разделяющая поверхность- фиктивная разделяющая поверхность, на которой происходит разрыв непрерывно в плоскостях( m, S, F). Поверхность разрыва –толщина поверхностного слоя.
Предпосылки: α и β включают в себя часть поверхностного слоя и считается однородным вплоть до раздела поверхности. Разделяющая поверхность- это гетерогенная поверхность, воспроизводящая форму поверхности разрыва и параллельная ей. Каждая точка разделяющей поверхности находится в одинаковых условиях, положение поверхности фиксировано по величине адсорбции, разность между экстенсивными величинами в реальной и идеальной системе представляет собой избыточную величину, которую относят к разделяющей поверхности.
В ывод:
ывод:
Г, α dV α
Ж, β dS
β
![]()
![]() Для
поверхностной энергии:
Для
поверхностной энергии:![]()
Для открытой системы:![]() ;
;
Для открытой системы:![]()
11. Вывод фундаментального уравнения Гиббса для свободной энергии плоского поверхностного слоя, его анализ.
δ<<R(называем слой плоским если его толщина много меньше радиуса кривизны)
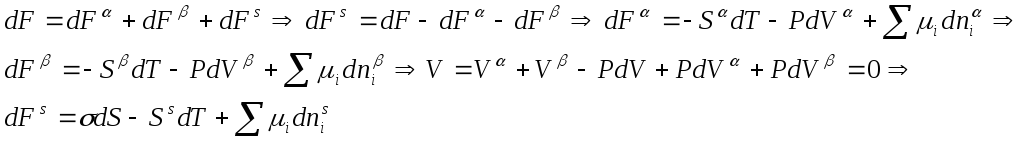
σdS -работа увеличения единицы поверхности; SdT –связанная энергия слоя;
Σμidnis- вещественный обмен между фазами и поверхностным слоем.
Анализ уравнения Гиббса для плоского
поверхностного слоя: 1)![]()
Поверхностное натяжение-изменение
свободной энергии приходящейся на
единицу площади.![]()
2)![]() при ↑T(dσ/dT)<0,
(dFs/dT)<0,
a Ss↑
3)
при ↑T(dσ/dT)<0,
(dFs/dT)<0,
a Ss↑
3)
![]() Химический потенциал- мольное приращение
свободной энергии при постоянном объеме
при переходе i-ого компонента
в поверхностный слой.
Химический потенциал- мольное приращение
свободной энергии при постоянном объеме
при переходе i-ого компонента
в поверхностный слой.
12. Понятие об адсорбции. Причины адсорбции. Количественные характеристики адсорбции.
Адсорбция- процесс выравнивания
химических потенциалов между поверхностью
и объектом, приводящий к изменению
концентрации компонента на поверхности.
Адсорбция- сгущение( концентрирование)
вещества на границе раздела фаз. dF>0,
F. Причина адсорбции-
уменьшение поверхностной энергии dF
и Σμidni.
Условия адсорбции: выходит на поверхность
компонент, который приводит к уменьшению
поверхностного натяжения. Тs=Tα=Tβ
![]() .
Адсорбция отличается от диффузии тем,
что она идет в сторону расхождения
концентраций. Фаза на которой происходит
адсорбция называется адсорбент. 3 вида
адсорбции: 1) на границе газ-тв. тело
2)раствор-газ 3)раствор-тв тело.
.
Адсорбция отличается от диффузии тем,
что она идет в сторону расхождения
концентраций. Фаза на которой происходит
адсорбция называется адсорбент. 3 вида
адсорбции: 1) на границе газ-тв. тело
2)раствор-газ 3)раствор-тв тело.
Количественные характеристики адсорбции: а (моль/г), (кмоль/кг)-емкость монослоя
Α (моль/см2), (кмоль/м2)-поверхностная концентрация. Г- гибсовская адсорбция =ni/S (кмоль/м2), показывает избыток числа молей компонента в поверхностном слое по сравнению с содержанием в объеме.
