
- •Денної форми навчання за напрямом
- •6.050201 – “Системна інженерія”
- •(Розділи “фізичні основи механіКи", "основи молекулярНої фізиКи і термодинаміКи”)
- •Укладач к.Ф.-м.Н., доц. О.В. Сукачов
- •Кафедра фізики
- •Заступник голови методичної ради __________________ доц. С.А. Сергієнко
- •1 Фізичні основи механіки програма розділу
- •Основні закони і формули
- •Загальні вказівки
- •Приклади розв’язування типових задач
- •2 Основи молекулярної фізики і термодинаміки програма розділу
- •2.1 Макроскопічні стани речовини. Молекулярно-кінетична теорія газів
- •2.2 Статистичні розподіли
- •2.3 Основи термодинаміки
- •2.4 Реальні гази, рідини і тверді тіла
- •Основні закони і формули
- •Загальні вказівки
- •Список літератури
- •Табличні дані
- •Робочої навчальної програми з фізики
- •Укладач к.Ф.-м.Н., доц. О.В. Сукачов
- •39600, М. Кременчук, вул. Першотравнева, 20
2 Основи молекулярної фізики і термодинаміки програма розділу
2.1 Макроскопічні стани речовини. Молекулярно-кінетична теорія газів
Макроскопічні параметри газового стану речовини. Рівняння стану ідеального газу. Дослідні закони ізопроцесів ідеального газу, дослідне обгрунтування молекулярно-кінетичної теорії (МКТ). Тепловий рух. Основне рівняння МКТ ідеального газу. Молекулярно-кінетичний зміст термодинамічної абсолютної температури. Середня довжина вільного пробігу молекул. Поняття про вакуум. Методи отримання вакууму, властивості розріджених газів.
Явища переносу в термодинамічно нерівноважних системах: дифузія, теплопровідність, в'язкість. Закони Фіка, Фур'є, Ньютона.
2.2 Статистичні розподіли
Поняття про статистичні розподіли у фізиці. Закон Максвелла для функції розподілу молекул газів за швидкостями та енергіями теплового руху. Статистичний зміст функції розподілу. Найбільш імовірна, середня арифметична і середня квадратична швидкості молекул.
Закон Больцмана для розподілу молекул за енергіями у гравітаційнім полі. Барометрична формула. Альтиметрична формула.
2.3 Основи термодинаміки
Ступені вільності газових молекул, закон Больцмана рівномірного розподілу енергії за ступенями вільності молекул. Середня кінетична енергія молекул. Внутрішня енергія ідеального газу і засоби її зміни: робота і теплопередача. Перший закон термодинаміки і його застосування до ізопроцесів ідеального газу. Теплоємність газу при сталому об'ємі та тиску. Адіабатичний процес у газах. Політропні процеси, показник політропи, рівняння Пуассона.
Прямі, оборотні та необоротні теплові процеси. Колові процеси (цикли). ККД теплового двигуна. Цикл Карно для ідеального газу і його ККД. Поняття про ентропію. Статистичний зміст ентропії та її зв’язок з термодинамічною ймовірністю. Другий закон термодинаміки. Третій закон термодинаміки – теорема Нернста.
2.4 Реальні гази, рідини і тверді тіла
Фазові рівноваги і перетворення. Сили взаємодії молекул і розміри молекул. Рівняння Ван-дер-Ваальса. Ізотерми реального газу. Критична точка. Фазові переходи 1 і 2-го роду. Внутрішня енергія реального газу. Ефект Джоуля-Томсона, скраплення газів. Фазові переходи першого і другого роду. Діаграма стану речовини.
Будова кристалів. Типи кристалів. Кристалографічні ознаки кристалів. Види фізичних зв'язків атомів у кристалах: іонний, металічний, атомний, молекулярний. Макродефекти у кристалах. Мікродефекти: точкові й лінійні. Теплоємність твердих тіл. Закон Дюлонга і Пті.
Основні закони і формули
-
Кількість речовини
![]() ,
,
де N – кількість молекул;
NA – число Авогадро;
т – маса газу;
M – молярна маса газу.
-
Mолярна маса газу
M = (n1A1 + n2A2 +…)10-3 кг/моль,
де nі – число атомів відповідного елементу, який входить до складу молекули даної речовини;
Aі – відносна атомна маса цього елементу.
-
Закон Бойля-Маріотта для ізотермічного процесу (Т = const, m = const):
РV = const.
-
Закон Гей-Люссака для ізобарного процесу (Р = const, m = const)
![]() .
.
-
Закон Шарля для ізохорного процесу (V = const, m = const)
![]() .
.
-
Універсальний газовий закон (m = const)
![]() .
.
-
Закон Дальтона для тиску суміші ідеальних газів
Р = Р1 + Р2 +…
де Рi – парціальний тиск і-го компонента суміші.
-
Рівняння стану ідеального газу (рівняння Клапейрона - Менделєєва)
РV = RT,
де = m/M – кількість молів речовини;
R – молярна газова стала;
M – молярна маса газу.
-
Залежність тиску газу від концентрації молекул і температури
Р = nkT ,
де k – стала Больцмана (k = R/NA),
n = N / V – концентрація молекул.
-
Основне рівняння молекулярно-кінетичної теорії ідеальних газів
![]() ,
,
де
![]() – середня
квадратична швидкість молекул;
– середня
квадратична швидкість молекул;
т0 – маса однієї молекули;
![]() – середня кінетична енергія
поступального руху молекули газу.
– середня кінетична енергія
поступального руху молекули газу.
-
Середня кінетична енергія поступального руху молекули ідеального газу
![]()
-
Барометрична формула
![]()
де Р – тиск повітря на висоті h;
Р – атмосферний тиск (h = 0).
-
Розподіл Больцмана для газу у зовнішньому потенціальному полі
![]()
або
![]()
де п і п0 – концентрація молекул відповідно на висоті h і h = 0;
Wn = m0gh – потенціальна енергія молекули у полі тяжіння.
-
Середня кінетична енергія молекули
![]() ,
,
де і – число ступенів вільності молекули (і = іпост + іоб).
-
Внутрішня енергія ідеального газу
![]() .
.
-
Молярні теплоємності газу при постійному об’ємі й постійному тиску
![]()
-
Рівняння Майера
Cp - CV = R.
-
Зв’язок між молярною Сm і питомою с теплоємностями газу
Сm= c·M.
-
Перший закон термодинаміки
![]()
де Q12 – кількість теплоти, яка надана системі (газу);
ΔU12 – зміна її внутрішньої енергії;
![]() – робота, яка виконується
системою (газом) проти зовнішніх сил.
– робота, яка виконується
системою (газом) проти зовнішніх сил.
-
Робота розширення газу
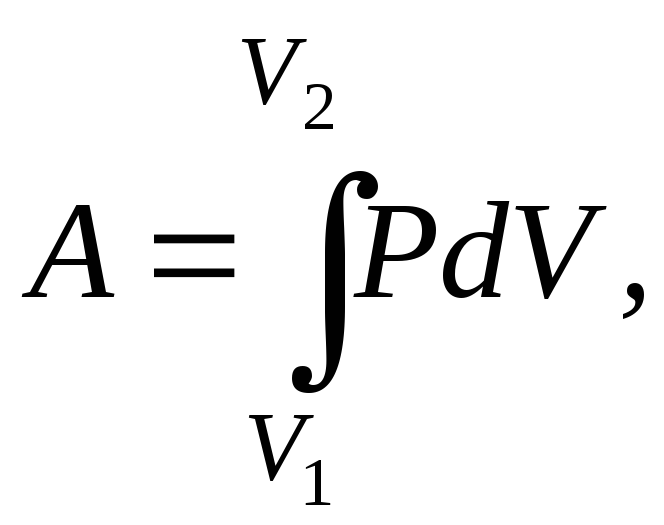
де V1 і V2 – відповідно, початковий і кінцевий об’єми газів.
-
Робота газу
в ізобарному процесі
![]() або
або
![]() ;
;
в ізотермічному процесі
![]() або
або
![]() ;
;
в адіабатному процесі (![]() =
0)
=
0)
![]()
-
Рівняння адіабатного процесу (рівняння Пуассона)
РVγ = const, TVγ–1 = const, TγР1–γ = const,
де
![]() – показник адіабати.
– показник адіабати.
-
Термічний коефіцієнт корисної дії для колового процесу (циклу)
![]()
де Q1 – кількість теплоти, яка отримана системою;
Q2 – кількість теплоти, яка віддана системою;
А – корисна робота, яка виконується за цикл.
-
Термічний коефіцієнт корисної дії циклу Карно
![]()
де T1 – температура нагрівача;
T2 – температура охолоджувача.
