
- •Паливно-мастильі та інші експлуатаційні матеріали. Практикум
- •6.100102 – Процеси, машини та обладнання агропромислового виробництва
- •Теоретичний курс
- •1. Експлуатаційні властивості та застосування палив для енергетичних засобів сільськогосподарського виробництва.
- •1.1. Класифікація, властивості та загальний склад
- •1.2. Теплота згоряння палива
- •1.3. Горіння палива
- •2. Способи отримання рідких палив і масел
- •2.1 Нафта – основна сировина для одержання рідких палив і масел
- •2.2. Основні способи одержання палив і масел з нафти
- •2.3. Способи очистки нафтопродуктів
- •2.4 Загальні показники фізико-хімічних і експлуатаційних властивостей нафтопродуктів
- •3. Експлуатаційні властивості та використанн автомобільних бензинів
- •3.1. Сумішоутворюючі властивості бензинів
- •3.2. Нормальне і детонаційне згоряння
- •4. Експлуативні властивості та використання дизельних палив
- •4.1. Умови застосування і основні вимоги до дизельних палив
- •4.2. Прокачувальна здатність і сумішоутворюючі властивості дизельних палив
- •4.3 Займання та згоряння дизельного палива
- •4.4. Стабільність і схильність до утворення відкладень
- •4.5. Корозійні властивості
- •4.6. Асортимент палив для дизельних двигунів і область їх застосування
- •5. Експлуатаційні властивості та використання газоподібних палив
- •5.1 Загальні відомості і класифікація
- •5.2. Характеристика і асортимент палив
- •5.3. Застосування газоподібного палива в двз
- •5.4. Закордонні класифікації газоподібних палив
- •Лабораторна робота №1 оцінка якості нафтопродуктів найпростішими методами
- •Лабораторне устаткування і матеріали
- •Хід виконання роботи Визначення води і механічних домішок
- •Визначення фактичних смол
- •Визначення неграничних вуглеводнів
- •Визначення в'язкості оливи
- •Лабораторна робота №2 визначення щільності нафтопродуктів і мінеральних водорозчинних кислот і лугів
- •Лабораторне устаткування і матеріали
- •Хід виконання роботи Визначення щільності нафтопродуктів
- •Визначення мінеральних водорозчинних кислот і лугів
- •Лабораторна робота №3 визначення фракційного складу палива
- •Лабораторне устаткування і матеріали
- •Хід виконання роботи
- •Визначення вмісту води в дизельному паливі
- •Лабораторне устаткування і матеріали
- •Хід виконання роботи
- •Лабораторна робота №5 температура спалаху та застигання дизельного палива
- •Лабораторне устаткування і матеріали
- •Хід виконання роботи Визначення температури спалаху дизельного палива
- •Визначення температури помутніння і застигання дизельного палива
- •Помутніння та застигання
- •6. Експлуатаційні властивості та використання мастильних матеріалів
- •6.1. Призначення мастильних матеріалів і вимоги до них
- •6.2. Загальні поняття про тертя та спрацьовування
- •6.3. Класифікація мастильних матеріалів
- •7. Масла для двигунів внутрішнього згоряння
- •7.1. Умови роботи й вимоги до якості масел
- •7.2. Класифікація моторних масел
- •7.4. Класифікація та асортимент трансмісійних масел
- •7.5. Індустріальні масла
- •Лабораторна робота №6 Визначення в’язкості палива та оливи
- •Лабораторне устаткування і матеріали
- •Хід виконання роботи Визначення в'язкості палива
- •Одиниці вимірювання вязкості в різних системах
- •Визначення в'язкості оливи
- •Лабораторна робота №7 Контроль якості картерної оливи за методом паперової хроматографії
- •Лабораторне устаткування і матеріали
- •Хід виконання роботи
- •Лабораторна робота №8 визначення температури плавлення пластичних мастил
- •Лабораторне устаткування і матеріали
- •Хід виконання роботи
- •8. Технічні рідини
- •8.1. Охолодні та мастильно-охолодні рідини
- •8.2. Гальмівні рідини
- •Температура замерзання водно-етиленгліколевої суміші
- •Асортимент та рекомендації щодо використання холодильних рідин
- •Характеристика розповсюджених холодильних рідин
- •Фізико-хімічні характеристики нхр виробництва провідних фірм
- •Фізико-хімічні показники нхр за ту 88 у 264-08-93
- •Характеристика розповсюджених гальмівних рідини
- •Вимоги різних специфікацій до основних показників гальмівних рідин
- •9. Додатки
- •Характеристика автомобільних бензинів за гост 2084-77
- •Характеристика автомобільних бензинів
- •Характеристика бензинів моторних сумішевих за гсту
- •Середній компонентний склад автомобільних бензинів
- •Характеристика автомобільних бензинів за гост р 51105-97
- •Параметри класів випарності автомобільних бензинів
- •Загальні технічні вимоги до автомобільних бензинів (гост р 51313-99)
- •Характеристика бензинів з поліпшеними екологічними показниками
- •Дизельні палива
- •Характеристика дизельного палива за дсту 3868-99
- •Характеристика дизельних палив за гост 305-82
- •Характеристика дизельного палива обважненого фракційного складу
- •Характеристика дизельного експортного палива
- •Газоподібні палива
- •Характеристика скраплених газів (гост 20448-80)
- •Фізико-хімічні показники скраплених (гост 27578-87)
- •Характеристика стиснутих газів
- •Моторні оливи
- •Класи в'язкості моторних олив (гост 17479-85)
- •Класифікація моторних олив за призначенням та експлуатаційними властивостями (гост 17479-85)
- •Характеристика моторних олив за гост 10541-78
- •Характеристика моторних олив групи «леол»
- •Характеристика оливи «леол» м-3042
- •Характеристика олив маст за ту у 22409155.01-2000
- •Характеристика олив групи д2
- •Класифікація sае моторних олив за в'язкістю
- •Умови використання моторних олив за арі
- •Класи моторних олив рекомендовані для автомобільних двигунів в Російській Федерації
- •Класифікація aaи моторних олив за експлуатаційними властивостями
- •Орієнтовна відповідність класів в'язкості вітчизняних і закордонних олив
- •Трансмісійні оливи
- •Класи в'язкості трансмісійних олив
- •Групи трансмісійні оливи за експлуатаційними властивостями та рекомендованою сферою застосування
- •Відповідність позначення олив за стандартом і нтд
- •Характеристики основних трансмісійних олив за гост 23652-79
- •Характеристика трансмісійних олив за ту у 13932946.018-98
- •Характеристика трансмісійної оливи Ольвіт т-3-18
- •Класи в'язкості трансмісійних олив за sае j 306с та din 51 5512
- •Групи трансмісійних олив за в'язкістю арі
- •Орієнтовна відповідність вітчизняних і імпортних трансмісійних олив
- •Гідравлічні оливи
- •Класи кінематичної в'язкості гідравлічних олив
- •Групи гідравлічних олив за експлуатаційними властивостями та рекомендованою сферою застосування
- •Відповідність позначення гідравлічних олив за стандартом і нтд
- •Класи кінематичної в'язкості гідравлічних рідин за іsо
- •Орієнтовна відповідність груп вітчизняних і імпортних гідравлічних олив за експлуатаційними властивостями
- •Специфікації відомих виробників сільськогосподарської техніки для олив категорій тнр і sтоu
- •Технічні рідини
- •Температура замерзання водно-етиленгліколевої суміші
- •Характеристика розповсюджених холодильних рідин
- •Фізико-хімічні характеристики нхр виробництва провідних фірм
- •Фізико-хімічні показники нхр за ту 88 у 264-08-93
- •Характеристика розповсюджених амортизаційних рідин
- •Характеристика амортизаційних рідин для імпортної техніки
- •Характеристика розповсюджених гальмівних рідини
- •Вимоги різних специфікацій до основних показників гальмівних рідин
- •Густина електроліту для свинцевих батарей
- •Заправні місткості
- •Заправні місткості тракторів
- •Заправні місткості автомобілів
- •Заправні місткості автомобілів
- •Використання паливно-мастильних матеріалів в сільськогосподарській техніці
1.2. Теплота згоряння палива
Цінність будь-якого палива перш за все визначають за кількістю теплової енергії, що є в одиниці його маси або одиниці об'єму.
Кількість теплоти, яка виділяється під час повного згоряння одиниці маси (1 кг рідкого або твердого) або одиниці об'єму (1 м3 газоподібного) палива, називають питомою теплотою згоряння (теплотворністю) палива (надалі у тексті просто теплота згоряння).
При згорянні вода, яка міститься в паливі та утворюється від згоряння водню, перетворюється в пару. На пароутворення води витрачається теплота. Теплоту згоряння називають вищою (QB) у тому випадку, коли пари води конденсуються і теплота, що затрачена на пароутворення, звільняється. Якщо ж пари води виносяться з димовими або відпрацьованими газами, частина теплоти втрачається і таку теплоту називають нижчою (QH).
На практиці найчастіше для визначення теплоти згоряння застосовують формули Д.І.Менделєєва. Відповідно до них теплоту згоряння рідких і твердих палив, кДж/кг, визначають так:
-
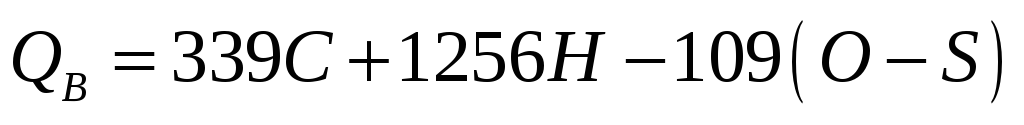
(1.2)
-
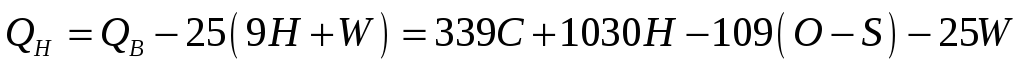 ,
,(1.3)
де С, Н, О, S, W, елементний склад палива, відсотки за масою; 25 – коефіцієнт, який враховує втрати теплоти, що виноситься продуктами згоряння в атмосферу (1 кг пари при виносі в атмосферу забирає 2500 кДж/кг); 9Н – число масових частин води, що утворюється при згорянні однієї масової частини водню; W – вміст води.
Теплоту згоряння газоподібного палива, кДж/м3, у розрахунку на суху масу визначають за формулами:
-
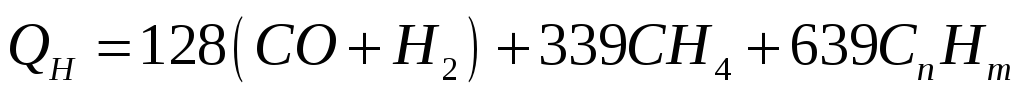
(1.4)
-
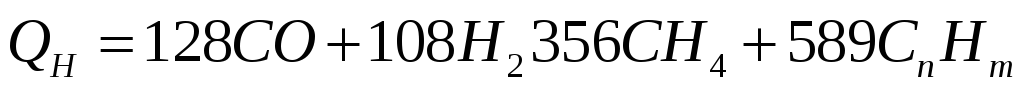
(1.5)
де СО, Н2, СН4, СnНm – склад газоподібного палива, проценти за об'ємом при нормальних умовах (0°С, тиск 760 мм рт. ст.).
Теплоту згоряння робочої маси газоподібного палива, що містить вологу, підраховують за формулами:
![]() (1.6)
(1.6)
-
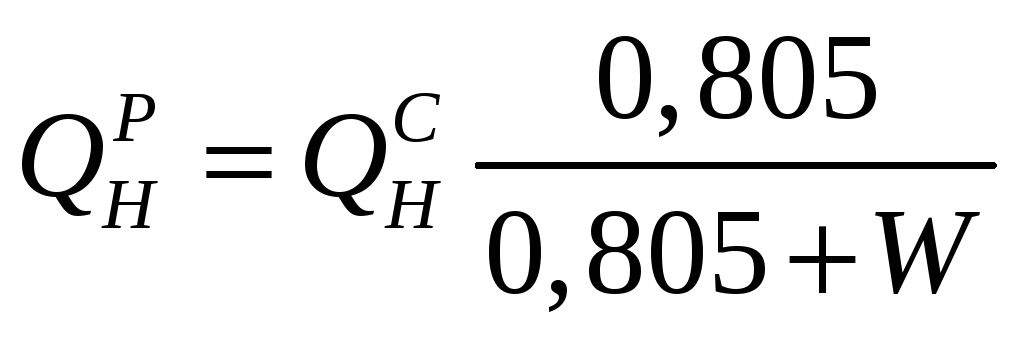
(1.7)
де 0,805 – маса 1 м3 газу, кг.
Для порівняння різних видів палива, а також для обліку загальних запасів палива і складання замовлень встановлений еталон – умовне паливо, теплота згоряння якого для твердого і рідкого палива рівна 29307 кДж/кг, а для газоподібного – 29307 кДж/м3. При порівнянні палив визначають їх теплові (калорійні) еквіваленти, які є відношенням теплоти згоряння будь-якого палива до теплоти згоряння умовного:
-
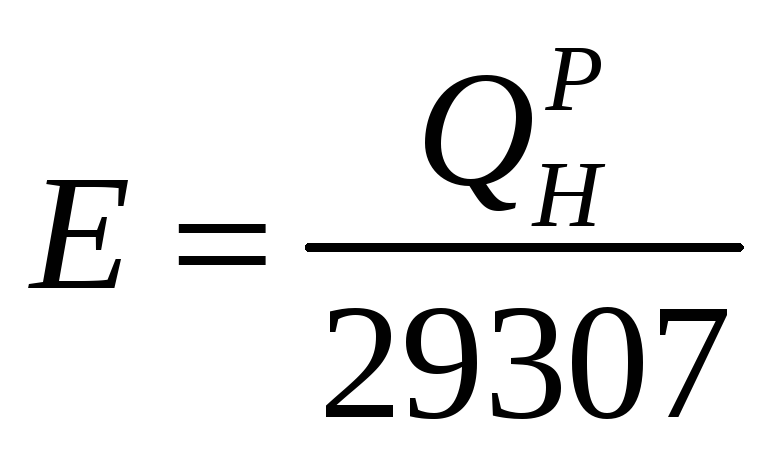
(1.8)
Щоб перерахувати фактичне паливо в умовне потрібно його масову кількість помножити на тепловий еквівалент.
1.3. Горіння палива
Горінням називають швидкоплинну реакцію, яка супроводжується виділенням теплоти і випромінюванням світла. Як правило, це процес окислення, сполучення палива з киснем повітря (іноді з чистим киснем) або з іншим окислювачем. Характерною особливістю цього процесу є велика швидкість протікання реакції, при якій тепло, що виділяється, не встигає розсіюватися, внаслідок чого різко підвищується температура
Горіння – складний процес, при якому хімічні реакції супроводжуються фізичними явищами: перемішуванням палива і повітря, дифузією, теплообміном тощо.
Розрізняють горіння:
-
гомогенне горіння, коли паливо і окислювач знаходяться в газоподібному стані;
-
гетерогенне, коли речовини знаходяться в різному агрегатному стані, наприклад, рідкі і газоподібні та вибухове.
Температура, при якій хімічний процес різко прискорюється при зіткненні з відкритим вогнем і речовина займається, називається температурою займання. Якщо займання речовини відбувається без стикання з відкритим вогнем, отримаємо температуру самозаймання. Далі горіння продовжується внаслідок безперервного виділення тепла, необхідного для підтримування температури на достатньо високому рівні.
Швидкість процесу горіння залежить в основному від умов сумішоутворення. Залежно від цього горіння розділяють на
-
кінетичне – процес утворення суміші палива і повітря передує горінню,
-
дифузійне – якщо процеси відбуваються одночасно.
За температуру горіння приймають температуру, до якої нагріваються газоподібні продукти згоряння внаслідок горіння палива.
Розрізняють температура горіння:
-
теоретичну – максимальна температура, яка може бути досягнута при відсутності втрат від теплообміну;
-
дійсну – температура горіння при реальних умовах. Процес горіння супроводжується теплообміном і тепловими втратами, тому продукти згоряння мають дійсну температуру, яка нижче теоретичної.
Дійсну температуру горіння розраховують за формулою:
-
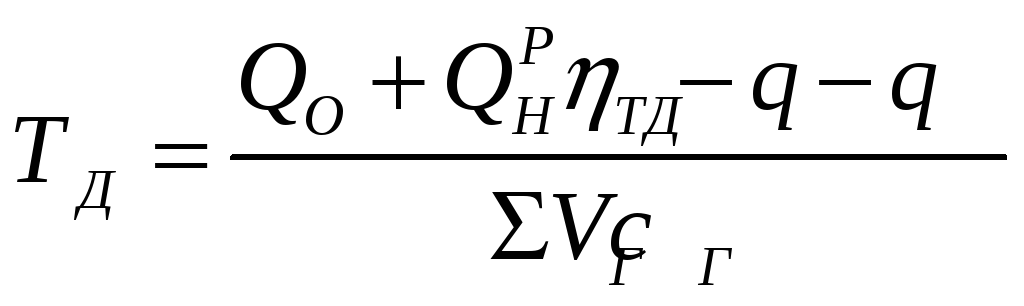
(1.9)
де QО – питома кількість теплоти, яка є в паливі і повітрі, кДж/кг;
![]() - нижня питома
кількість теплоти спалювання палива,
кДж/кг;
- нижня питома
кількість теплоти спалювання палива,
кДж/кг;
ηТ – ККД двигуна (топки);
q – питома кількість теплоти, що віддається при нагрівання поверхням нагріву, яке приходиться на одинцю маси палива, кДж/кг;
qД – питома кількість теплоти, що витрачається на реакцію дисоціації продуктів горіння палива, кДж/кг;
VГ – об'єм окремих компонентів продуктів горіння, м3/кг;
сГ – об'ємні теплоємності компонентів продуктів горіння при калориметричній температурі горіння ТК, кДж/кг·град.
Співвідношення палива і окислювача, яке відповідає хімічній реакції повного окислення паливних елементів (повне згоряння) називається стехіометричним.
Кількість кисню, теоретично необхідна для спалювання 1 кг твердого або рідкого палива, можна визначити на основі стехіометричного відношення для реакцій горіння елементів горючої маси палива (С, Н, S).
Із рівнянь повного згоряння цих елементів:
С + О2 = СО2, (12 + 32 → 44),
2Н2 + О2 = 2Н2О, (4 + 32 → 36),
S + О2 = SО2, (32 + 32 → 64),
враховуючи їх атомну масу, знаходимо, що для спалювання 12 кг вуглецю потрібно 32 кг кисню, для спалювання 1 кг вуглецю потрібно 32/12 = 2,67 кг кисню. Аналогічно, для спалювання 1 кг водню потрібно 8 кг кисню, а для спалювання 1 кг сірки – 1 кг кисню.
Тоді формула для підрахунку теоретично необхідної кількості кисню, кг, для спалювання 1 кг палива буде мати вигляд:
-
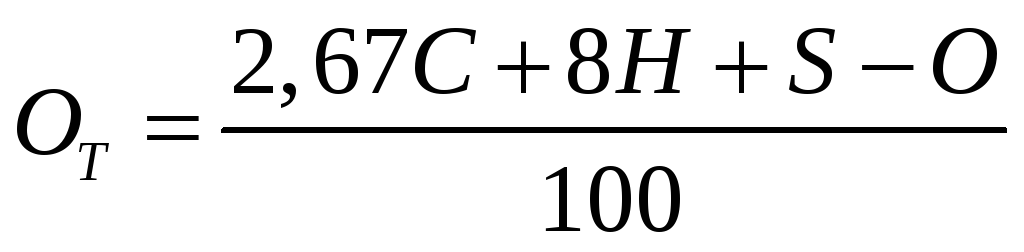
(1.10)
де С, Н, S,О – хімічні елементи горючої частини палива, % за масою.
Для спалювання палива, як правило, подається повітря, в якому кисень становить 23,2 % за масою. Тоді теоретично необхідну кількість повітря, кг, для спалювання 1 кг палива визначають за формулою:
-
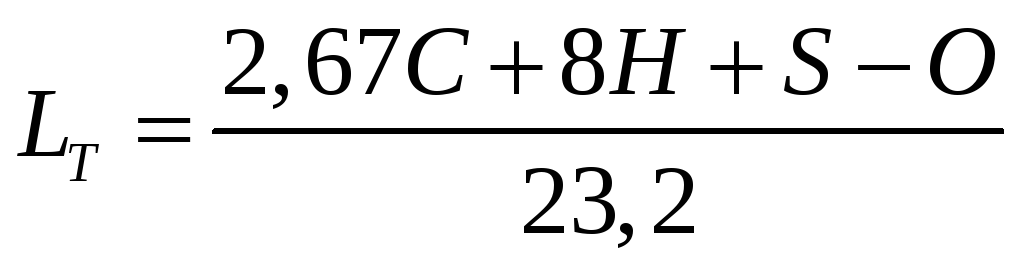
(1.11)
Кількість повітря зручніше визначати в м3/кг. Тоді формула матиме вигляд:
-
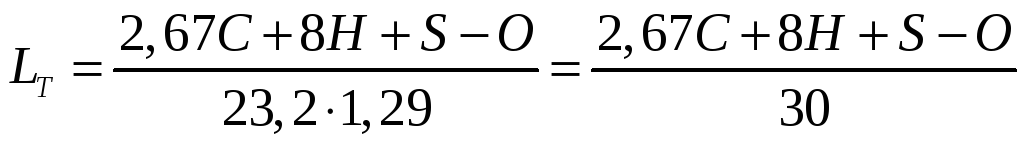
(1.12)
де 1,29 – маса 1 м3 повітря.
Для газоподібного палива кількість повітря (м3/м3) визначають за формулою:
-
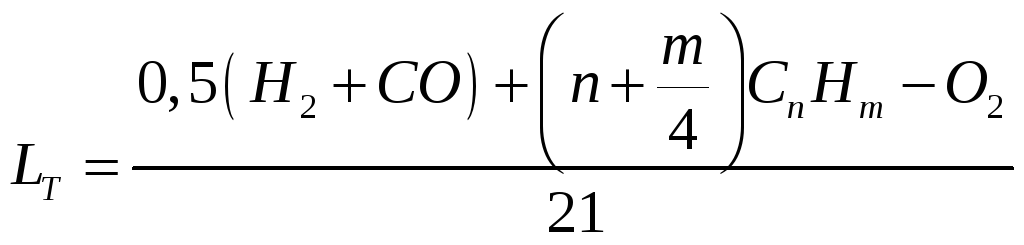
(1.13)
де n – число атомів вуглецю;
m – число атомів водню;
21 – вміст кисню у повітрі, % за об'ємом.
Склад газу у формулі наведений у процентах за об'ємом.
У виробничих умовах здійснити повне спалювання палива з теоретично необхідною (розрахунковою) кількістю повітря практично неможливо. Тому для повного спалювання, як правило, подають надлишок повітря, тобто процес відбувається не з розрахунковою, а з фактичною (дійсною) кількістю повітря LД.
Відношення дійсної витрати повітря до теоретично необхідної для спалювання 1 кг (1 м3) палива називають коефіцієнтом надлишку повітря (α):
-
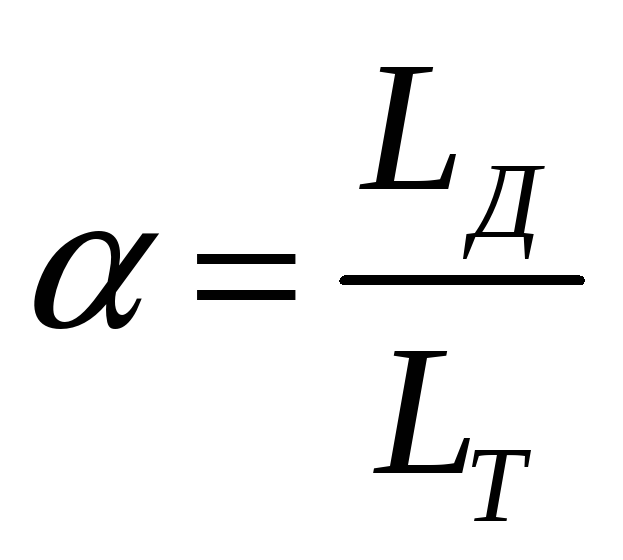
(1.14)
Суміш палива і повітря називають пальною сумішшю. Залежно від співвідношення кількості палива і повітря пальна суміш може бути:
-
нормальна а = 1,
-
бідна а > 1,
-
багата а < 1.
При значеннях близьких до одиниці – збіднена або збагачена пальна суміш.
Коефіцієнт надлишку повітря визначають за формулами:
при повному згорянні:
-
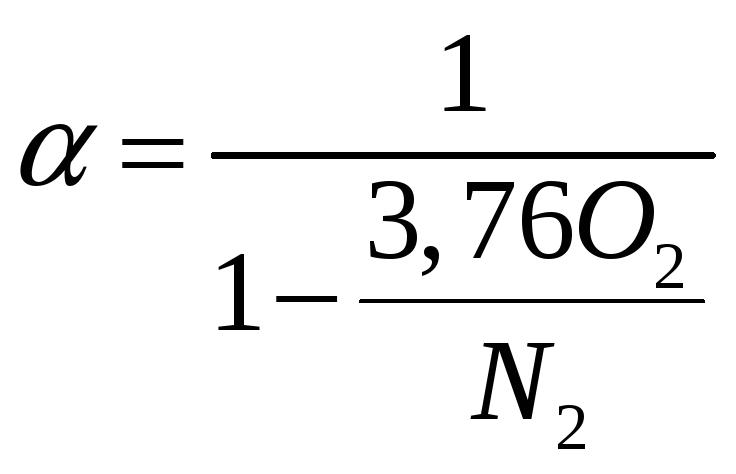
(1.15)
при неповному:
-
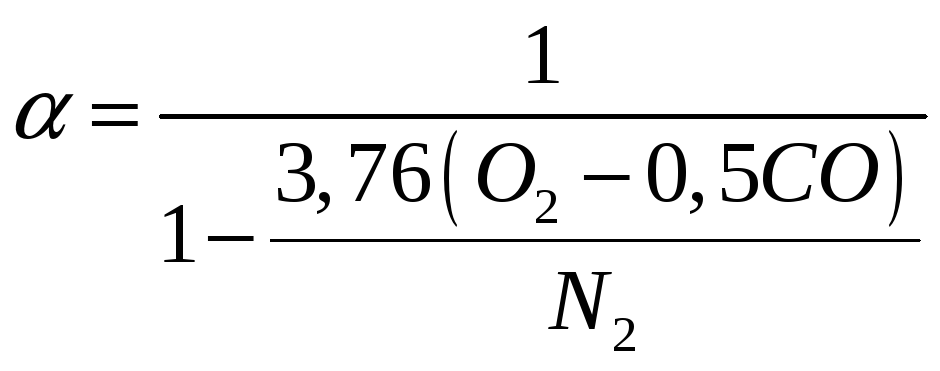
(1.16)
де О2, СО, N2 – процентний вміст за об'ємом у продуктах згоряння відповідно кисню, оксиду вуглецю (визначають за допомогою спеціальних приладів-газоаналізаторів) і азоту (підраховують за різницею N2 = 100 – (СО2 + О2 + СО).
Теплота згоряння пальної суміші (QПС) залежить від кількості теплоти, що виділяється паливом і об'єму повітря:
-
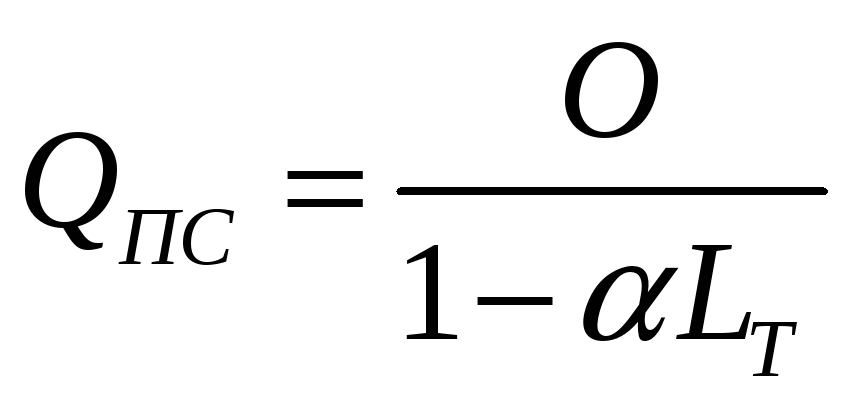
(1.17)
Для різних видів палив теплота згоряння нормальних пальних сумішей приблизно однакова – 2770 кДж/кг.
Пальну суміш, яка змішалась із залишковими газами від попереднього циклу, називають робочою. Якщо потрібно визначити її теплоту згоряння, то вносять поправку на коефіцієнт надлишкових газів. На практиці теплоту згоряння пальної і робочої суміші прирівнюють.
Характер процесу горіння можна визначити за складом продуктів згоряння палива. Для цього існують різні газоаналізатори: хімічні, електричні, магнітні, механічні.
Більш точні – це хімічні, більш зручні – автоматичні і електричні. Найпоширеніші прості хімічні газоаналізатори, які дозволяють визначати у відпрацьованих газах вміст вуглекислого газу, кисню і оксиду вуглецю. Принцип дії газоаналізаторів полягає в поглинанні розчинами певних складових елементів, відпрацьованого газу, який послідовно пропускають через ці розчини. За відповідним збільшенням об'єму знаходять процентний вміст кожного окремо поглиненого компонента.
