
- •2.2 Порядок выполнения работы
- •3 Техника безопасности и правила поведения в лаборатории при выполнении работы
- •4 Контрольные вопросы
- •5 Задачи
- •Содержание
- •1.5 Методы определения парциальных молярных величин
- •Общ. 2оби{ Хобщ.
- •2.1 Весы и взвешивание
- •240901, 240701, 240702, 260204, 260601 Всех форм обучения
Термодинамические свойства обычно подразделяют на интенсивные и экстенсивные.
К интенсивным относятся свойства, не зависящие от количества вещества и одинаковые для всей системы, такие как температура, давление, концентрация, молярный объём.
Экстенсивные свойства пропорциональны количеству вещества, зависят от массы системы. К ним относятся энтальпия, объём, теплоёмкость и т. д.
Термодинамические свойства раствора связаны между собой; если будет изменяться одно из термодинамических свойств, то одновременно будуг изменяться и другие свойства раствора.
Термодинамическая теория растворов изучает зависимость свойств растворов от состава и свойств растворителя и растворенных веществ. ■ :■--.,'•:■■' ji--A р 1п«й»1;Ш; ,3;;
1.2 Парциальные молярные величины д:«*
Чтобы установить зависимость свойств растворов от состава и свойств компонентов, пользуются парциальными молярными величинами.
Рассмотрим какое-нибудь экстенсивное, зависящее от количества раствора термодинамическое свойство.
Обозначим: а -Мт
Х-общ. ~ экстенсивное термодинамическое свойство раствора (это
может быть С0ощ., Л'общ., &$ибщл У общ., О общ. и другие величины). Для двухкомпонентного раствора
где И/ - число молей растворителя; w, «^r-^jra.-:»^ Н'""
/ъ - число молей растворенного вещества.
Так как экстенсивное свойство раствора является функцией состояния, то полный дифференциал этого свойства запишется выражением:
jv [дХобщ. 1 ,л | ЗХобщ ] | 5Аобм, | ,-.,,;,
.,;■
d^o6^_
= ,р
\
dP
+
~^Г- «" +1 ~^
i «"1
+
V дР h V оТ Jp I дп\ )PJ,ni
-о. При Р = const и r=constrfP = OH J7'=0. В этом случае
" ■ 4
Аналитические весы дают возможность взвешивать с точностью до ±0,0002, ±0.00002 г. Наиболее часто используются полуавтоматические весы АВД-200, равноплечие весы ВЛР-200.
Электронные весы предназначены для точного взвешивания и автоматической регистрации изменения массы во времени. Они разделяются на прецизионные и электронные аналитические весы.
Для получения правильных, точных результатов взвешиваний на технических и аналитических весах нужно соблюдать определенные правила.
Перед взвешиванием проверяют состояние весов, их исправность и установку по уровню внешним осмотром, подключают к электрической сети, включают тумблером сеть (если он есть) и устанавливают точку нуля. Установка весов по встроенному уровню и установка нуля являются обязательными условиями их правильных показаний. г:.! s Для технических весов установка нуля по светящейся шкале делает их готовыми к работе, то есть на чашку весов можно устанавливать взвешиваемый предмет.
Взвешиваемый предмет и гирьки можно помещать на чашки аналитических весов и снимать с них только при закрытом арретире, т.е. когда арретир опущен (весы выключены). При открытом арретире к чашкам весов прикасаться нельзя.
При взвешиваниях и проверке нуля весов стеклянные боковые шторки весов должны быть закрыты. Диск или ручку арретира следует поворачивать медленно, плавно, осторожно, без рывков. Диск арретира обычно находится в середине нижней части передней стенки весов, ручка арретира в середине нижней части боковых стенок.
Нельзя допускать при взвешивании превышения допустимой нагрузки (200 г, 500 г или 1 кг).
Взвешиваемый предмет помещают на левую чашку весов, а гирьки разновеса на правую.
Разновес аналитических весов (набор гирек для взвешивания) должен всегда храниться в футляре. Брать гирьки руками не разреша- ется. Их можно ставить на чашку весов и убирать только пинцетом.
Нельзя взвешивать горячие, слишком холодные и мокрые предметы.
Нельзя облокачиваться на подставку для весов и стол, на котором установлены весы.
Сыпучие вещества следует взвешивать на часовом стекле, фильтре, в тигле, бюксе или небольшом стаканчике.
В лаборатории физической химии используются технические весы ВЛК-500 г М 4 - класса с точностью до ±0,01 г. Аналитические ве-
13
сы АВД-200 г и ВЛР-200 г с точностью взвешивания ±0,0002 г и ±0,00002 г.
Весы АВД-200 г в верхней части имеют два лимба (диска) с цифрами. Большой лимб с цифрами 0, 1, ..... 9, которые означают десятые доли грамма взвешиваемой массы. На малом лимбе нанесены цифры 00, 10, ..., 90. Они означают сотые доли грамма определяемой массы. Около дисков с левой стороны нанесена стрелка > мг, которая показывает цифры взвешиваемой массы на дисках весов. В нижней части передней стенки находится окуляр (экран) с вертикальной чертой |, в котором при включенных весах высвечивается шкала с цифрами «-10, ..., -2, -1, 0, +1, +2, ..., +10». С правой стороны от диска включения весов располагается ручка для установки 1гуля весов. ?: .. У весов АЛР-200 г в верхней части, на панели с маркировкой весов, расположено малое окно, в котором верхней ручкой с правой стороны весов можно установить цифры 0, 1, 2, ..., 9. Они показывают десятые доли грамма определяемой массы. Рядом окно большего размера с двумя горизонтальными чертами =, в котором при включенных
весах высвечивается и перемещается шкала с цифрами « 00 -,
01 -, 02 -, ..., 99 -, 100 + + +». Эти цифры относятся к сотым и тысячным долям грамма взвешиваемого вещества (предмета). Далее окно с цифрами 00 и надписью «мг». Цифры в окне могут изменяться при повороте нижней ручки с правой стороны верхней части весов от 00, 05, 10 до 95. Они соответствуют десятитысячным и стотысячным долям грамма. Нуль весов устанавливается ручкой в верхней части на левой стенке весов. Ручка арретира с левой и с правой стороны в нижней части весов.
Для установки весов АВД-200 г на нуль нужно при включенных весах совместить поворотом ручки установки нуля вертикальную черту на окуляре (экране) с нулём светящейся шкалы.
Взвешиваемая масса на весах АВД-200 г складывается из массы разновесов в граммах; цифр большого и мшюго дисков, расположенных около стрелки на весах, и цифр, находящихся напротив вертикальной черты на окуляре. Например: на правой чашке весов масса разновесов 14 г, около стрелки большой диск показывает цифру 8, малый 50, на светящейся шкале против вертикальной черты экрана цифра +-24, значит взвешиваемый предмет (вещество) имеет массу 14,8524 г.
Взвешиваемая масса на весах АЛР-200 г также складывается из массы гирек разновесов и показаний весов. Например: если масса разновесов на правой чашке весов - 22 г, цифра в малом окне - 3, между
14
двумя параллельными чертами находится черта цифры 78 - , а в окне «мг» 65, то масса вещества имеет величину 22,37865 г.
Перед началом взвешиваний на аналитических весах устанавливается масса предмета на технических весах: например 28,64 г. Затем определяется точная масса на аналитических весах. Для этого весы подключаются к сети электрического тока. На правую чашку весов ставят гирьки разновесов, равные массе предмета в граммах, с помощью лимбов или в окне весов устанавливают цифры десятых и сотых долей грамма определяемой массы. На левую чашку весов помещают взвешиваемый предмет (вещество). Закрывают правую и левую шторки весов. Затем плавным движением ручки (на себя) или диска (в левую сторону) арретира включают весы и наблюдают за поведением высвеченных шкал. Если шкалы уходят с экрана (освещенного окна) в сторону цифр со знаком «-», то это указывает, что масса, установленная на весах (разновесами, положением дисков (лимбов) или цифр в окнах), должна быть уменьшена. В том случае, когда шкалы уходят с экрана в сторону цифр со знаком « + », масса, установленная на весах, должна быть увеличена.
Полученную массу - сумму всех положенных на чашку весов гирь - подсчитывают, записывают и тут же укладывают гири в футляр, проверяя ещё раз их сумму. .,;< ■ ■■...-■ . .,. . ,;... ;..., ,
2.2 Порядок выполнения работы
В работе нужно определить парциальные молярные объёмы веществ двухкомпонентных растворов моляльностей т 0,05, 0,1, 0,15, 0,2 моль/1000 г растворителя. Для этого приготовлены водные растворы солей K2SO4, MgSO4, Nad. Могут быть растворы и других твердых и жидких веществ.
Задание для выполнения работы выдается преподавателем - два раствора солей с указанными выше концентрациями. Для определения
объема Vt необходимо найти плотность растворов.
Плотность растворов определяется пикнометрическим методом с использованием пикнометров различных видов. Пикнометр - это стеклянный сосуд с меткой для ограничения количества залитой жидкости (раствора) и известным объёмом (рисунок 3). Объём пикнометра определяют с использованием жидкости, для которой хорошо известна зависимость плотности от температуры. Наиболее часто в качестве такой жидкости используют дистиллированную воду.
15
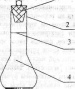
Ft \;
1 - пробка; 2 - шлиф; 3 - метка: 4 - ёмкость пикнометра -"-' Рисунок 3 - Пикнометр . .
Так как в работе исследуются два раствора, то берут два пикнометра. Для определения объёмов пикнометров взвешивают два чистых сухих пикнометра сначала на технических, а затем на аналитических весах с точностью до ±0,0002 г. После этого пикнометры заполняют дистиллированной водой до метки по нижнему мениску раствора. Если на поверхность пикнометра попала вода, то её удаляют фильтровальной бумагой. Взвешивание пикнометров с водой опять проводят сначала на технических, а затем на аналитических весах. По результатам взвешиваний пустых пикнометров и с водой на аналитических весах определяют их объём по формуле:
_ У т -
dH2O
(2.1)
где ото - масса пустого пикнометра, г; т\ -масса пикнометра с водой, г;
-- т\-т2~ масса дистиллированной воды в пикнометре, г; : r**: djf q — плотность дистиллированной воды при температуре опыта,
г/см"1. Находится из справочных данных (таблица 1).
Ж
Таблица 1 - Плотность дистиллированной воды в зависимости от температуры
|
t,°C |
16 |
17 |
18 |
19 |
20 |
|
dlbO, г/см" |
0,99897 |
0,99880 |
0.99862 |
0,99843 |
0,99823 |
|
t, °С |
21 |
22 |
23 |
24 |
25 |
|
dH2O, r/cMJ |
0,99802 |
0,99780 |
0,99756 |
0,99732 |
0,99707 |
После определения объёмов пикнометров воду выливают, пикнометры сушат и при необходимости охлаждают или нагревают до температуры дальнейших опытов. Испытуемые растворы также доводят до температуры определения их плотности. Температуру растворов измеряют термометром. Затем один пикнометр заполняют одним раствором соли, другой - вторым раствором. Опыты начинают с раствора меньшей концентрации, переходя затем к большей. Каждый раз пикнометр предварительно ополаскивают исследуемым раствором. При точных измерениях проводят термостатирование растворов с использованием термостатов. Оттермостатированные растворы с известной их температурой взвешивают опять сначала на технических, а затем на аналитических весах. Закончив взвешивание исследуемого раствора данной концентрации, его нужно вылить из пикнометра в соответствующую емкость для хранения.
т
Щ
Зная массы растворов по аналитическим весам и объёмы пикнометров, рассчитывают плотности растворов для данной концентрации по формуле:
dp-pa
р_-ра_ VU
где гПр_ра — масса раствора в пикнометре, г;
т2 и т0 - массы пикнометра с раствором и пустого пикнометра, г.
Данные взвешиваний и расчетов занести в таблицы 2 и 3. При за полнении таблиц > называть размерность величин и химическую фор мулу СОЛИ . . .. ■ -:., -
Таблица 2 - Определение объёмов пикнометров
|
Номер пикнометра |
Температура, °С |
Масса пикнометра, г |
Плотность воды, г/см'' |
Объём пикнометра, см3 |
||
|
пустого |
с водой |
|||||
|
|
|
|
|
|
|
|
*!?■
Таблица 3 - Определение плотности растворов при температуре .... °С
|
Номер раствора |
Концентрация соли, m |
Масса пикнометра, г |
Масса раствора в пикнометре, г |
Плотность раствора, dp-pa |
|
|
пустого 1 с раствором |
|||||
|
Номер, соль |
|
-■■■■? |
|
|
|
2.3 Обработка результатов экспериментов
Для всех концентраций исследуемых растворов, содержащих 1000 г воды (растворителя), рассчитать их массы по формуле:
". ,'-' ■••■-■ gp.pa=mM2 +1000, . _. (2.3)
где m — моляльность раствора, моль/1000 г р-ля; :...
М - молярная масса соли, г/моль.
; По экспериментальным данным, приведенным в таблице 3, вычислить объёмы растворов, содержащих 1000 г воды:
& р-ра
V,
р-ра
Построить графики (экспериментальные кривые Vp.pa - т) для обоих растворов в координатах Vp.pa — т., откладывая по оси ординат объём раствора, а по оси абсцисс число молей соли, содержащихся в 1000 г воды (см. рисунок 2). Для построения графиков масштабы по осям Vp-pa и моляльную концентрацию т раствора выбрать с таким расчетом, чтобы рисунок занимал половину тетрадного листа.
По экспериментальным кривым Vp.pa — m определить парциальные молярные объёмы растворенных солей в обоих растворах для всех концентраций графическим дифференцированием:
on-,
= V, = К
AV
р-ра
-f-?~ - tga, Am
(2.5)
где
а - угол наклона касательных к
экспериментальной кривой Vp-ра
— тъ точках,
отвечающих моляльным концентрациям
растворов, к
оси абсцисс.
j Для определения тангенса угла наклона касательных в названных точках нужно построить произвольный прямоугольный треугольник, найти для него значения катетов, выраженные через AV и Am, и по ним
вычислить тангенс а, а следовательно парциальный молярный объём соли (см. рисунок 2). Для определения парциального молярного объёма воды для всех растворов и концентраций растворенных веществ использовать уравнение Гиббса-Дюгема (1.13). Результаты всех графических определений и расчетов свести в таблицу 4.
|
Таблица 4 - Парциальные молярные объёмы соли и в исследуемых растворах при температуре ... С |
воды |
|
||||||
|
Моляль-ность раствора т |
Масса раствора gp-pa, Г |
Объём раствора *■' р-ра |
&Ур-ра |
Апг |
Парциальные молярные объём воды и соли, ... |
|||
|
|
|
|||||||
|
Раствор № 1 (формула соли) |
||||||||
|
0,05 |
|
|
|
1 |
|
|||
|
0,10 _^ |
|
|
|
|
|
|
||
|
0,15 |
|
|
|
|
|
|
||
|
0,20 |
|
|
|
|
|
|
||
|
Раствор № 2 (формула соли) |
||||||||
|
0,05 |
|
|
|
|
|
|
||
|
0,10 |
|
|
|
|
|
1 |
||
|
0.15 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
Для исследуемых растворов максимальной концентрации при температуре экспериментов рассчитать общий объём одного моля раствора Vad по правилу аддитивности, используя уравнение (1.20), а также изменение объёмов компонентов раствора при образовании раствора. При вычислениях молярных объёмов солей использовать справочные данные по плотности твердых солей: d(K2SO4) = 2,66, d(MgSO4) = 2,66, d(NaCl) = 2,165 г/см3.
2.4 Содержание отчета по работе .-..-■
В отчете по проделанной работе нужно привести цель работы, краткую теоретическую часть, результаты экспериментов и их обработку в соответствии с методическими рекомендациями.
Цель работы должна отражать экспериментальный метод (методику) проведения опытов, величины, которые следует определить.
В теоретической части необходимо привести основные понятия и определения термодинамических свойств растворов, парциальных мо-
19
I
лярных величин компонентов растворов, от каких факторов они зависят. Описать методы определения парциальных молярных величин. Привести формулы, которые будут необходимы при обработке результатов экспериментов. Содержание теоретической части должно являться ответами на контрольные вопросы по выполняемой работе.
Экспериментальные данные оформлять в соответствии с методическими рекомендациями. Сначала проводятся черновые расчеты по обработке данных экспериментов. После проверки их правильности преподавателем они заносятся в отчет. Все полученные величины приводить с указанием размерности. Таблицы и графики выполнять аккуратно с помощью карандаша (ручки) и линейки.
Отчет пишется на тетрадных листах бумаги. В отчете не должно быть исправлений, зачеркиваний текста и вычислений.
По данным, полученным в работе, необходимо сделать выводы. В них следует отразить, какой метод использовался в работе, какие
получены экспериментальные величины. ;
1
|
? "" "~ " 1
Ч;;г;зеЧ
Л ."'V /K
' - ' ' V.
1 . ■■- ..:■-.■-
■'* f.-3i"
