
- •Общая и неорганическая химия
- •Часть I. Общая химия
- •1. Основные понятия химии
- •2. Строение атома
- •2.1. Корпускулярно-волновой дуализм
- •2.2. Квантовые числа
- •2.3. Электронные конфигурации атомов
- •2.4. Периодический закон
- •3. Химическая связь
- •3.1. Метод валентных связей.
- •3.2. Теория молекулярных орбиталей
- •3.3. Некоторые типы химических связей Ионная связь
- •Водородная связь
- •Межмолекулярные взаимодействия
- •4. Закономерности протекания химических процессов
- •4.1. Термохимия
- •4.2. Химическая кинетика
- •4.3. Химическое равновесие
- •5.1. Концентрация растворов
- •5.2. Электролитическая диссоциация
- •5.3. Диссоциация слабых электролитов
- •5.4. Диссоциация сильных электролитов
- •5.5 Ионное произведение воды. Водородный показатель.
- •5.6. Буферные растворы.
- •5.7. Гидролиз солей
- •5.8. Протолитическая теория кислот и основания
- •6. Константа растворимости. Растворимость.
- •Условие осаждения и растворения осадка
- •Эффект общего иона
- •Солевой эффект
- •7. Окислительно-восстановительные реакции
- •Ионно-электронный метод составления овр
- •8. Координационные соединения
- •Номенклатура координационных соединений
- •Химическая связь координационных соединений
- •Диссоциация координационных соединений
- •Часть II. Неорганическая химия
- •9. Химия s-элементов
- •9.1. Химия элементов ia группы.
- •Химические свойства щелочных металлов.
- •Химические свойства соединений щелочных металлов
- •9.2. Химия элементов iia группы.
- •Химические свойства элементов
- •Химические свойства соединений
- •10. Химия р-элементов
- •10.1. Химия элементов iiia группы
- •Свойства бора и его соединений
- •Свойства алюминия и его соединений
- •10.2. Химия элементов iva группы
- •Свойства углерода и его соединений
- •Cвойства кремния и его соединений
- •Свойства соединений олова и свинца
- •10.3. Химия элементов va группы
- •Свойства азота и его соединений
- •Свойства фосфора и его соединений
- •10.4. Химия элементов via группы
- •Химия кислорода и его соединений
- •Химия серы и ее соединений
- •10.5. Химия элементов viia группы
- •Химия водорода и его соединений
- •Химия фтора и его соединений
- •Химия хлора и его соединений
- •Химия брома, иода и их соединений
- •11. Химия d-элементов
- •Химия хрома и его соединений
- •Химия марганца и его соединений
- •Химия железа и его соединений
- •Химия меди и ее соединений
- •Химия цинка и его соединений
- •Содержание
- •Часть I. Общая химия ……………………………….. 3
- •1. Основные понятия химии …………………………………… 3
- •Часть II. Неорганическая химия ………...…………. 66
5.7. Гидролиз солей
Гидролиз солей - это взаимодействие ионов соли с водой с образованием слабого электролита.
Степень гидролиза h - отношение числа гидролизованных молекул к общему числу растворенных молекул. Например:
CH3COONa
+ H2O![]() CH3COOH
+ NaOH
CH3COOH
+ NaOH
CH3COO-
+ Na+
+H2O
![]() CH3COOH
+ Na+
+ OH-
CH3COOH
+ Na+
+ OH-
CH3COO-
+ H2O
![]() CH3COOH
+ OH-
CH3COOH
+ OH-
С- h Сh Сh
K=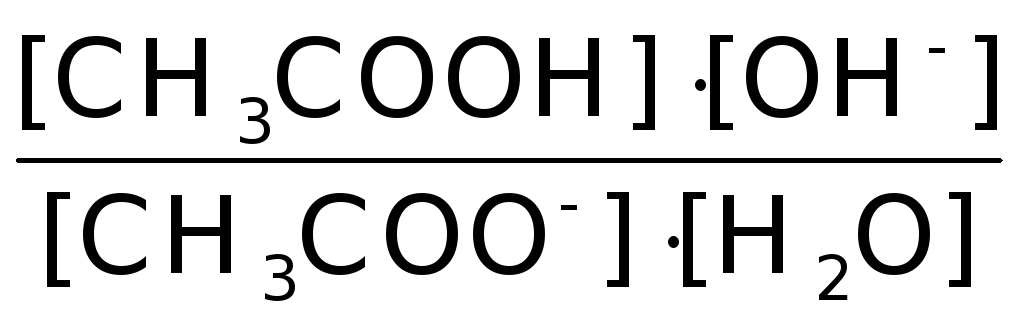 - константа равновесия;
- константа равновесия;
Поскольку [H2O] = 55,5 г/моль - постоянная величина, то имеем K[H2O] = Кг , где Кг - константа гидролиза
Кг
=
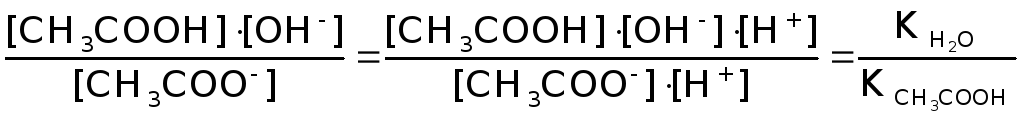
Кг
=
![]() .
Для многих солей h<<1 и 1 -h
1.
.
Для многих солей h<<1 и 1 -h
1.
Отсюда
Кг
= Сh2
и h =
![]() .
.
Из полученного выражения следует, что степень гидролиза h (то есть гидролиз) увеличивается:
а)
с увеличением температуры, так как тогда
увеличивается
![]() ;
;
б)
с уменьшением
![]() ,
чем слабее кислота, образующая соль,
тем больше гидролиз;
,
чем слабее кислота, образующая соль,
тем больше гидролиз;
в) с разбавлением, чем меньше С, тем больше гидролиз.
Примеры уравнений реакций гидролиза.
I. Соль образована сильным основанием и сильной кислотой:
KNO3 + H2O
K+ + NO3- + H2O нет гидролиза рН = 7.
II. Соль образована слабым основанием и сильной кислотой:
AlCl3
+ H2O![]() (AlOH)Cl2
+ HCl
(AlOH)Cl2
+ HCl
Al3+
+ 3Cl-
+ H2O![]() AlOH2+
+ 2Cl-
+H+
+ 3Cl-
AlOH2+
+ 2Cl-
+H+
+ 3Cl-
Al3+
H2O![]() AlOH2+
+ H+
pH < 7.
AlOH2+
+ H+
pH < 7.
По второй ступени гидролиз идет незначительно, а по третьей ступени практически не идет.
III. Соль образована сильным основанием и слабой кислотой:
Na2CO3
+ H2O![]() NaHCO3
+ NaOH
NaHCO3
+ NaOH
2Na+
+ CO32-
+ H2O
![]() 2Na+
+ HCO3-
+ OH-
2Na+
+ HCO3-
+ OH-
CO32-
+ H2O![]() HCO3-
+ OH-
pH > 7.
HCO3-
+ OH-
pH > 7.
По второй ступени гидролиз практически не идет.
IV. Соль образована слабым основанием и слабой кислотой:
CH3COONH4
+ H2O![]() CH3COOH
+ NH4OH
CH3COOH
+ NH4OH
CH3COO-
+ NH4+
+H2O![]() CH3COOH
+ NH4OH
CH3COOH
+ NH4OH
Для солей подобного типа рН вычисляется следующим способом:

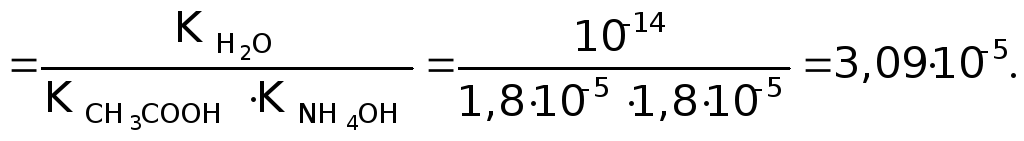
Идет частичный гидролиз, так как Кг << 1.
Степень
гидролиза равна: h =
![]() = 5,5610-3.
= 5,5610-3.
Концентрация
ионов водорода равна: [H+]
=
 = 10-7M.
= 10-7M.
В ряде случаев, когда соль образована очень слабым основаниями и кислотами идет полный гидролиз.
Al2S3 + 6H2O 2Al(OH)3 + 3H2S
Возможность полного гидролиза следует учитывать в обменных реакциях.
Al(SO4)3 + 3Na2CO3 + 3H2O 2Al(OH)3 + 3Na2SO4 + 3CO2
5.8. Протолитическая теория кислот и основания
Причина диссоциации электролитов - их взаимодействие с водой. Вода образует при диссоциации катион водорода и анион гидроксила. Катион водорода - протон - имеет малый радиус
(10-15 м) и в воде гидратирован - его обычное координационное число равно четырем. Формула гидрата протона - Н9О4+, но для простоты ее записывают как Н3О+. В растворах протоны переходят от одних соединений к другим.
HNO2
+ H2O
![]() H3O+
+ NO2-
H3O+
+ NO2-
кислота 1 основание 2 кислота 2 основание 1
Протолиз - процесс передачи протона.
Протолиты - кислоты и основания, отдающие и принимающие протоны.
Протолитическое равновесие - кислотно-основное равновесие - ионно-молекулярное равновесие, устанавливающееся после передачи протона. К протолитическим процессам относятся процессы диссоциации, ионные реакции в растворах, реакции гидролиза.
Кислота - молекула или ион, способная отдавать протон. Каждой кислоте соответствует сопряженное с нею основание. Сила кислот характеризуется константой кислоты Кк.
H2CO3
+ H2O
![]() H3O+
+ HCO3-
Kк
= 410-7.
H3O+
+ HCO3-
Kк
= 410-7.
NH4+
+ 2H2O
![]() NH3H2O
+ H3O+
Kк
= 610-10.
NH3H2O
+ H3O+
Kк
= 610-10.
[Al(H2O)6]3+
+ H2O![]() [Al(H2O)5OH]2+
+ H3O+
Kк
= 910-6.
[Al(H2O)5OH]2+
+ H3O+
Kк
= 910-6.
Основание - молекула или ион, способная принимать протон. Каждому основанию соответствует сопряженная с ним кислота. Сила оснований характеризуется константой основания Ко.
NH3H2O
(H2O)![]() NH4+
+ OH-
Ко
= 1,810-5.
NH4+
+ OH-
Ко
= 1,810-5.
C5H5N
+ H2O![]() C5H5NH+
+ OH-
Ко
= 1,810-5.
C5H5NH+
+ OH-
Ко
= 1,810-5.
Амфолиты - протолиты, способные к отдаче и к присоединению протона.
HCO3-
+ H2O
![]() H3O+
+ CO32-
HCO3-
- кислота
H3O+
+ CO32-
HCO3-
- кислота
HCO3-
+ H2O
![]() H2CO3
+ OH-
HCO3-
- основание
H2CO3
+ OH-
HCO3-
- основание
Для
воды
имеем:
H2O+
H2O![]() H3O+
+ OH-
H3O+
+ OH-
К(Н2О) = [H3O+][OH-] = 10-14 и pH = -lg[H3O+].
Константы Kк и Ко для сопряженных кислот и оснований связаны между собой.
HA
+ H2O
![]() H3O+
+ A-
Kк
=
H3O+
+ A-
Kк
=
![]()
A-
+ H2O
![]() HA + OH-
Ко
=
HA + OH-
Ко
=
![]()
Отсюда
KкКо
=
![]()
![]() = [H3O+][OH-]
= К(Н2О)
= [H3O+][OH-]
= К(Н2О)
