
- •Общая и неорганическая химия
- •Часть I. Общая химия
- •1. Основные понятия химии
- •2. Строение атома
- •2.1. Корпускулярно-волновой дуализм
- •2.2. Квантовые числа
- •2.3. Электронные конфигурации атомов
- •2.4. Периодический закон
- •3. Химическая связь
- •3.1. Метод валентных связей.
- •3.2. Теория молекулярных орбиталей
- •3.3. Некоторые типы химических связей Ионная связь
- •Водородная связь
- •Межмолекулярные взаимодействия
- •4. Закономерности протекания химических процессов
- •4.1. Термохимия
- •4.2. Химическая кинетика
- •4.3. Химическое равновесие
- •5.1. Концентрация растворов
- •5.2. Электролитическая диссоциация
- •5.3. Диссоциация слабых электролитов
- •5.4. Диссоциация сильных электролитов
- •5.5 Ионное произведение воды. Водородный показатель.
- •5.6. Буферные растворы.
- •5.7. Гидролиз солей
- •5.8. Протолитическая теория кислот и основания
- •6. Константа растворимости. Растворимость.
- •Условие осаждения и растворения осадка
- •Эффект общего иона
- •Солевой эффект
- •7. Окислительно-восстановительные реакции
- •Ионно-электронный метод составления овр
- •8. Координационные соединения
- •Номенклатура координационных соединений
- •Химическая связь координационных соединений
- •Диссоциация координационных соединений
- •Часть II. Неорганическая химия
- •9. Химия s-элементов
- •9.1. Химия элементов ia группы.
- •Химические свойства щелочных металлов.
- •Химические свойства соединений щелочных металлов
- •9.2. Химия элементов iia группы.
- •Химические свойства элементов
- •Химические свойства соединений
- •10. Химия р-элементов
- •10.1. Химия элементов iiia группы
- •Свойства бора и его соединений
- •Свойства алюминия и его соединений
- •10.2. Химия элементов iva группы
- •Свойства углерода и его соединений
- •Cвойства кремния и его соединений
- •Свойства соединений олова и свинца
- •10.3. Химия элементов va группы
- •Свойства азота и его соединений
- •Свойства фосфора и его соединений
- •10.4. Химия элементов via группы
- •Химия кислорода и его соединений
- •Химия серы и ее соединений
- •10.5. Химия элементов viia группы
- •Химия водорода и его соединений
- •Химия фтора и его соединений
- •Химия хлора и его соединений
- •Химия брома, иода и их соединений
- •11. Химия d-элементов
- •Химия хрома и его соединений
- •Химия марганца и его соединений
- •Химия железа и его соединений
- •Химия меди и ее соединений
- •Химия цинка и его соединений
- •Содержание
- •Часть I. Общая химия ……………………………….. 3
- •1. Основные понятия химии …………………………………… 3
- •Часть II. Неорганическая химия ………...…………. 66
5.5 Ионное произведение воды. Водородный показатель.
Вода - слабый электролит - диссоциирует, образуя ионы H+ и OH-. Эти ионы гидратированы, то есть, соединены с несколькими молекулами воды, но для простоты мы записывали их в негидратированной форме
H2O![]() H+
+ OH-.
H+
+ OH-.
Применяя к этому равновесию закон действия масс, имеем:
K
=
![]() = 1,810-16
(22С)
= 1,810-16
(22С)
Концентрацию молекул воды [H2O], то есть число моль в 1 л воды можно считать постоянной и равной [H2O] = 1000 г/л : 18 г/моль = 55,5 моль/л. Получаем
К[H2O] = К(H2O) = [H+][OH-] = 10-14 (22С)
Произведение концентраций [H+] и [OH-], то есть ионное произведение воды, есть величина постоянная и равная 10-14 при 22С: [H+][OH-] = 10-14
Ионное произведение воды увеличивается с увеличением температуры
|
tС |
10 |
22 |
30 |
50 |
100 |
|
K(H2O) |
0,410-14 |
1,010-14 |
1,910-14 |
5,610-14 |
7410-14 |
Соотношение между количеством ионов [H+] и [OH-] определяет характер среды:
[H+] =10-7= [OH-] - нейтральная среда
[H+] >10-7> [OH-] - кислая среда
[H+] <10-7< [OH-] - щелочная среда.
Водородный показатель рН - это отрицательный десятичный логарифм концентрации ионов водорода рН = - lg[H+].
Аналогично рOН = - lg[OH-].
Логарифмируя ионное произведение воды, получаем
pH + pOH = 14
Примеры. Если [H+] = 10-2M, то рН = 2, а [ОH-]= 10-12M.
Если [ОH-] = 10-4M, то [H+]= 10-10M, а рН = 10.
Если рН = 8, то [H+]= 10-8M, а [ОH-] = 10-6M
Если рОН = 5, то рН = 9, а [H+]= 10-9M.
Величина рН характеризует реакцию среды:
рН = 7 нейтральная среда
рН < 7 кислая среда
рН > 7 щелочная среда.
рН раствора можно определить с помощью индикаторов (лакмуса, фенолфталеина., метилоранжа и др.), универсальной индикаторной бумаги или с помощью рН-метра.
Индикатор меняет свою окраску в зависимости от рН раствора в определенном интервале рН: метилоранж в области рН=3,1-4,4; лакмус при рН=5,0-8,0; фенолфталеин в пределах рН=8,0-10,0. Индикатор - это обычно малодиссоциированная кислота или основание, имеющие в нейтральных и ионных формах разные окраски. Так например, лакмус НА - красный, а его анион А- - синий:
НА
![]() Н+
+ А-
Н+
+ А-
красный синий
В кислой среде с увеличением [Н+] равновесие сдвигается влево, индикатор имеет красный цвет. В щелочной среде, с уменьшением [Н+] равновесие сдвигается вправо, и индикатор имеет синий цвет. В области перехода в интервале рН от 5,0 до 8,0 существуют обе формы, и индикатор имеет фиолетовый цвет.
Пример 1. Найти рН 0,01 М раствора NaOH (=1)
Решение.
NaOH
![]() Na+
+ OH-
=1
Na+
+ OH-
=1
[OH-] = [NaOH] = 10-2 M, рОН=2, рН=12.
Пример 2. Найти рН 0,1 М раствора NН4OH (К=1,810-5)
Решение.
NH4OH![]() NH4+
+ OH-
NH4+
+ OH-
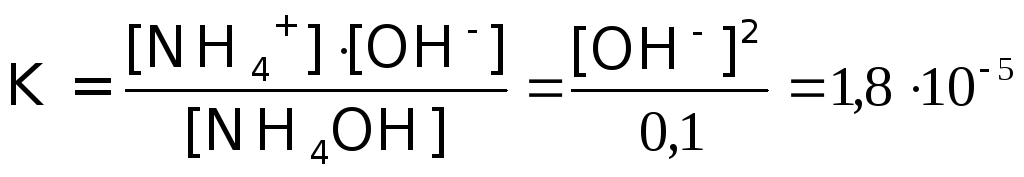
Так как [NH4OH] C(NH4OH), а [OH-]=[NH4+], имеем:
[OH-]
=
![]() = 1,3410-3
;
pOH = 2,87, pH = 11,13.
= 1,3410-3
;
pOH = 2,87, pH = 11,13.
Пример 3. 0,1 М раствор СН3СООН имеет рН = 3. Найти степень диссоциации .
Решение.
СH3СОOH
![]() СH3СОО-
+ H+
СH3СОО-
+ H+
С-С С С
Отсюда
[H+] = С
и
=
![]() = 110-2,
так как при рН=3 [H+]=10-3.
= 110-2,
так как при рН=3 [H+]=10-3.
Пример 4. Раствор НСООН (К=1,810-4) имеет рН=1,87. Найти концентрацию кислоты С.
Решение.
НСОOH![]() НСОО-
+ H+
НСОО-
+ H+
![]() ,
так как [H+]
= [HCOO-]
имеем [HCOOH] =
,
так как [H+]
= [HCOO-]
имеем [HCOOH] =
![]() ,
так как рН=1,87, то [H+]=
1,3410-2.
,
так как рН=1,87, то [H+]=
1,3410-2.
[HCOOH]
=
![]() .
.
