
Литература
-
Практические работы по физической химии / Под ред. К.П.Мищенко, А.А.Равделя, А.М.Пономаревой.-Л.:Химия,1982.-С.102-115.
-
2. Физическая химия / Под ред, К.С.Краснова.-М.: Высшая школа,
1982.-С.403-415.
РАБОТА № 13
ИССЛЕДОВАНИЕ ПРОЦЕССА РАСПРЕДЕЛЕНИЯ РАСТВОРЕННОГО ВЕЩЕСТВА МЕЖДУ ВОДНОЙ И ОРГАНИЧЕСКОЙ ФАЗАМИ
Целью работы является изучение зависимости коэффициента распределения карбоновой кислоты между водной и органической фазами от рН водной фазы и вычисление степени и константы ее диссоциации в водной фазе.
1. Теоретическая часть
1.1. Распределение растворенного вещества между несмешивающимися фазами в отсутствие его ассоциации или диссоциации
Рассмотрим систему из раствора какого-либо вещества АН в воде и органического растворителя, несмешивающегося с водой. Если общая энергия системы определяется ее энергией Гиббса (при постоянных T и p), то общая энергия системы равна сумме энергий водной и органической фаз, а также энергии растворенного в воде вещества АН:
![]() ,
,
где
![]() и
и
![]()
энергия водной и органической фаз;
энергия водной и органической фаз;
![]()
энергия растворенного вещества в водной
фазе (
энергия растворенного вещества в водной
фазе (![]()
количество молей вещества АН
в водной
фазе,
количество молей вещества АН
в водной
фазе,
![]()
его химический потенциал в воде).
его химический потенциал в воде).
Химический
потенциал вещества в растворе в общем
случае определяется его активностью
(![]() ),
то есть концентрацией:
),
то есть концентрацией:
![]() ,
,
где
![]() – стандартный химический потенциал
растворенного вещества AH,
равный его химическому потенциалу, то
есть энергии одного моля в водной фазе
при его активности, равной единице
(состояние в гипотетическом одномолярном
растворе, имеющем свойства идеального
раствора). Химический потенциал вещества
АН в органической фазе равен
– стандартный химический потенциал
растворенного вещества AH,
равный его химическому потенциалу, то
есть энергии одного моля в водной фазе
при его активности, равной единице
(состояние в гипотетическом одномолярном
растворе, имеющем свойства идеального
раствора). Химический потенциал вещества
АН в органической фазе равен
![]() (минус бесконечность), поскольку его
концентрация, а значит и активность, в
органической фазе равны нулю. Таким
образом, в рассматриваемой системе
химический потенциал растворенного в
воде вещества АН заведомо больше, чем
в добавленном органическом растворителе:
(минус бесконечность), поскольку его
концентрация, а значит и активность, в
органической фазе равны нулю. Таким
образом, в рассматриваемой системе
химический потенциал растворенного в
воде вещества АН заведомо больше, чем
в добавленном органическом растворителе:
![]() .
Это соотношение является условием для
самопроизвольного перехода вещества
AH из
водной фазы в органическую (смотри
теоретическое введение). В ходе этого
процесса происходит уменьшение энергии
всей системы. По мере перехода концентрация,
следовательно и активность АН в водной
фазе уменьшаются, а в органической фазе
увеличиваются. Соответственно этому
.
Это соотношение является условием для
самопроизвольного перехода вещества
AH из
водной фазы в органическую (смотри
теоретическое введение). В ходе этого
процесса происходит уменьшение энергии
всей системы. По мере перехода концентрация,
следовательно и активность АН в водной
фазе уменьшаются, а в органической фазе
увеличиваются. Соответственно этому
![]() уменьшается, а
уменьшается, а
![]() увеличивается. Следовательно, по мере
перехода АН в органическую фазу происходит
выравнивание химических потенциалов
АН в водной и органической фазах. Процесс
перехода прекращается с наступлением
равновесия, условием которого является
равенство химических потенциалов
вещества АН в фазах:
увеличивается. Следовательно, по мере
перехода АН в органическую фазу происходит
выравнивание химических потенциалов
АН в водной и органической фазах. Процесс
перехода прекращается с наступлением
равновесия, условием которого является
равенство химических потенциалов
вещества АН в фазах:
![]() :
:
![]() ,
,
откуда:
 .
.
Поскольку
![]() и
и
![]() при данной температуре являются
постоянными величинами, отношение
равновесных активностей вещества АН
в фазах также
является постоянной величиной, называемой
константой распределения:
при данной температуре являются
постоянными величинами, отношение
равновесных активностей вещества АН
в фазах также
является постоянной величиной, называемой
константой распределения:
 .
.
Приведенное выражение является математическим выражением закона распределения: отношение равновесных активностей распределяемого вещества в несмешивающихся фазах при данных условиях есть величина постоянная.
Величина
константы распределения, определяющая
соотношение равновесных активностей,
зависит от химической природы
распределяемого вещества и свойств фаз
(от величин
![]() и
и
![]() ),
а также от температуры.
),
а также от температуры.
На практике чаще всего определяют равновесные концентрации распределяемого вещества. Их отношение называется коэффициентом распределения, величина которого совпадает с величиной константы распределения только в достаточно разбавленных растворах, в которых коэффициенты активности равны единице:
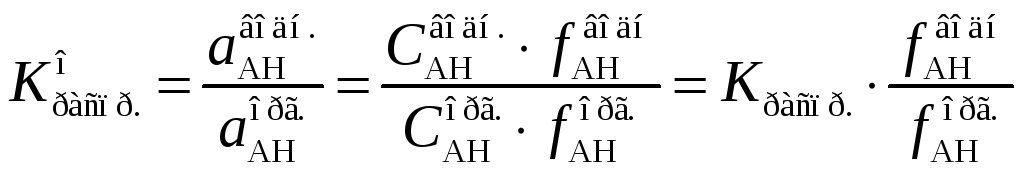
Отношение равновесных активностей, а в случае идеальных растворов, и отношение равновесных концентраций вещества в фазах не зависит от общего количества его в системе. Если растворимость распределяемого вещества в фазах низка, с увеличением его количества в системе достигается состояние, при котором в равновесии оказываются насыщенные растворы. Следовательно, коэффициент распределения малорастворимого вещества определяется отношением растворимостей его в фазах. Чем больше растворимость вещества в фазе, тем в большей степени оно переходит в эту фазу.
1.2. Распределение растворенного вещества при диссоциации его в одной из фаз
Пусть растворенное вещество является слабым электролитом, например, слабой кислотой, частично диссоциирующей в воде:
![]()
Если
в органической фазе растворенное
вещество находится в молекулярной форме
АН, то в равновесии участвует именно
молекулярная форма, общая для обеих
фаз. Ее концентрация равна общей
концентрации растворенного вещества
в органической фазе:
![]() .
В водной фазе концентрация молекулярной
формы составляет лишь некоторую часть
от концентрации АН:
.
В водной фазе концентрация молекулярной
формы составляет лишь некоторую часть
от концентрации АН:
![]() ,
где
,
где
![]()
степень диссоциации АН в воде.
Следовательно, коэффициент распределения
в этом случае зависит от степени
диссоциации распределяемого вещества:
степень диссоциации АН в воде.
Следовательно, коэффициент распределения
в этом случае зависит от степени
диссоциации распределяемого вещества:
 ,
откуда
,
откуда
 .
.
Чем
больше степень диссоциации распределяемого
вещества в водной фазе, тем больше его
относительная равновесная концентрация
в этой фазе, тем в меньшей степени оно
переходит в органическую фазу, тем
больше
![]() по сравнению с
по сравнению с
![]() .
.
Следовательно, отношение равновесных концентраций распределяемой слабой кислоты зависит от величины рН водного раствора, поскольку от него зависит степень ее диссоциации.
1.3. Экстрагирование
Извлечение
вещества из раствора подходящим
растворителем, не смешивающимся с
раствором, является самым важным
применением закона распределения.
Наиболее полно извлечение протекает
при проведении экстрагирования малыми
порциями свежего растворителя. Так,
если в объеме V
л воды находится
![]() г вещества, а при экстрагировании v
литрами растворителя в нем осталось
г вещества, а при экстрагировании v
литрами растворителя в нем осталось
![]() г вещества, то в органическом растворителе
оказалось
г вещества, то в органическом растворителе
оказалось
![]() г. Поэтому выражение для константы
распределения можно записать как:
г. Поэтому выражение для константы
распределения можно записать как:
 ,
откуда
,
откуда
 .
.
Степень экстрагирования тем больше (количество вещества, оставшегося в водной фазе тем меньше), чем больше константа распределения и объем органической фазы (v). После вторичной экстракции тем же объемом органического растворителя, в водной фазе останется:
 ,
г.
,
г.
После n-ного экстрагирования в водном растворе останется всего:
 ,
г,
,
г,
причем
будет израсходовано
![]() литров растворителя. Если экстрагирование
провести один раз объемом
литров растворителя. Если экстрагирование
провести один раз объемом
![]() ,
то количество неизвлеченного вещества
будет значительно выше и составит:
,
то количество неизвлеченного вещества
будет значительно выше и составит:
 ,
г.
,
г.
Следовательно, многократная экстракция свежими порциями растворителя оказывается значительно эффективнее однократной.
Для увеличения степени экстрагирования вещество необходимо переводить в форму, общую для обеих фаз. Так, диссоциация вещества в одной из фаз затрудняет экстрагирование из нее, а подавление диссоциации облегчает.
3. Определение константы диссоциации слабой кислоты в водной фазе
Если распределяемое вещество АН является слабой кислотой, диссоциирующей в водной фазе по уравнению
![]() ,
,
степень
его экстракции органической фазой
определяется величиной константы
распределения
![]() и степени диссоциации
и степени диссоциации
![]() .
Если считать раствор АН
в воде и
органической фазе идеальным, то :
.
Если считать раствор АН
в воде и
органической фазе идеальным, то :
![]() (1)
(1)
При
![]() степень экстракции слабой кислоты из
водной фазы максимальна, а величина
степень экстракции слабой кислоты из
водной фазы максимальна, а величина
![]() равна отношению равновесных концентраций
АН в водной и органической фазах:
равна отношению равновесных концентраций
АН в водной и органической фазах:
 (2)
(2)
Следовательно,
для определения
![]() необходимо провести экстракцию АН из
водного раствора, в котором диссоциация
распределяемого вещества подавлена
добавлением минеральной кислоты, и
определить равновесные значения
необходимо провести экстракцию АН из
водного раствора, в котором диссоциация
распределяемого вещества подавлена
добавлением минеральной кислоты, и
определить равновесные значения
![]() и
и
![]() .
Величина степени диссоциации
.
Величина степени диссоциации
![]() при известном значении рН водной фазы
легко может
быть найдена
в результате определения равновесных
значений
при известном значении рН водной фазы
легко может
быть найдена
в результате определения равновесных
значений
![]() и
и
![]() после экстракции. В этом случае отношение
равновесных концентраций будет равно
коэффициенту распределения:
после экстракции. В этом случае отношение
равновесных концентраций будет равно
коэффициенту распределения:
 (3)
(3)
Из уравнения (1) следует:
 или,
с учетом (3):
или,
с учетом (3):
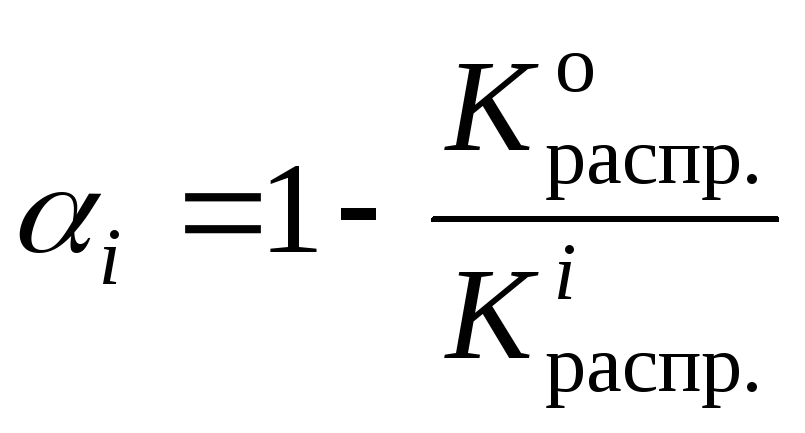 (4)
(4)
Термодинамическая константа диссоциации АН в водной фазе:
![]() или,
или,
если пренебречь неидеальностью раствора, то:
![]() .
.
Поскольку
![]() и
и
![]() ,
то для нахождения константы диссоциации
распределяемого вещества достаточно
при известном значении рН раствора
определить его степень диссоциации:
,
то для нахождения константы диссоциации
распределяемого вещества достаточно
при известном значении рН раствора
определить его степень диссоциации:
![]() . (5)
. (5)
Здесь
![]()
активность катионов гидроксония.
активность катионов гидроксония.
Таким
образом, для нахождения степени и
константы диссоциации распределяемого
вещества в водной фазе необходимо
определить равновесные концентрации
его в воде (![]() )
и органическом растворителе (
)
и органическом растворителе (![]() )
в условиях, когда диссоциация его
подавлена добавлением минеральной
кислоты и в условиях частичной его
диссоциации при нескольких значениях
рН (
)
в условиях, когда диссоциация его
подавлена добавлением минеральной
кислоты и в условиях частичной его
диссоциации при нескольких значениях
рН (![]() и
и
![]() ).
Если АН представляет собой одноцветный
индикатор, анионы которого поглощают
свет в видимой области спектра,
концентрация распределяемого вещества
легко находится фотоколориметрически,
путем измерения оптической плотности
щелочного раствора пробы водной фазы,
в котором АН диссоциирована полностью.
Согласно основному закону светопоглощения
оптическая плотность раствора
пропорциональна концентрации вещества:
).
Если АН представляет собой одноцветный
индикатор, анионы которого поглощают
свет в видимой области спектра,
концентрация распределяемого вещества
легко находится фотоколориметрически,
путем измерения оптической плотности
щелочного раствора пробы водной фазы,
в котором АН диссоциирована полностью.
Согласно основному закону светопоглощения
оптическая плотность раствора
пропорциональна концентрации вещества:
![]() ,
откуда:
,
откуда:
![]() . (6)
. (6)
Здесь
![]()
коэффициент пропорциональности, равный
оптической плотности раствора при
концентрации распределяемого вещества,
равной 1 моль/л;
коэффициент пропорциональности, равный
оптической плотности раствора при
концентрации распределяемого вещества,
равной 1 моль/л;
![]()
толщина поглощающего слоя.
толщина поглощающего слоя.
Для
определения
![]() пробу водной фазы в количестве 5 мл
разбавляют раствором щелочи до объема
25 мл,
тщательно перемешивают и определяют
оптическую плотность полученного
раствора. Если до экстракции концентрация
вещества в водной фазе составляла
пробу водной фазы в количестве 5 мл
разбавляют раствором щелочи до объема
25 мл,
тщательно перемешивают и определяют
оптическую плотность полученного
раствора. Если до экстракции концентрация
вещества в водной фазе составляла
![]() ,
а после экстракции
,
а после экстракции
![]() ,
то при равенстве объемов органической
и водной фаз
,
то при равенстве объемов органической
и водной фаз
![]() . (7)
. (7)
3.1. Ход работы и обработка полученных данных
3.1.1. Отмерить 5 мл раствора слабой кислоты (мета- или пара-нитрофенол, по заданию) в мерную колбу объемом 25 мл, долить до метки дистиллированной водой и тщательно перемешать.
3.1.2.
Проанализировать полученный раствор
слабой кислоты. Для этого отобрать
пипеткой 5 мл раствора в мерную колбу
емкостью 25 мл, долить до метки водным
раствором щелочи, тщательно перемешать
и измерить оптическую плотность
![]() при длине волны 400 нм. Исходную концентрацию
слабой кислоты (
при длине волны 400 нм. Исходную концентрацию
слабой кислоты (![]() )
вычислить по формуле (6), где
)
вычислить по формуле (6), где
![]() .
.
3.1.3. Отмерить 5 мл раствора слабой кислоты (по заданию) в мерную колбу объемом 25 мл, долить до метки раствором сильной кислоты и тщательно перемешать.
3.1.4. Полученный раствор вылить в бутыль для встряхивания, добавить 25 мл хлороформа, завинтить пробкой и поставить на 10 мин в прибор для встряхивания.
3.1.5. Вылить смесь двух фаз в делительную воронку и оставить на несколько минут для разделения. Слить нижний органический слой в бутыль для слива растворителя, а водный в коническую колбу.
3.1.6.
Отобрать 5 мл водной фазы в мерную колбу
на 25 мл, долить до метки водной щелочью,
перемешать и измерить оптическую
плотность (![]() ).
Вычислить
).
Вычислить
![]() и затем по формуле (7) величину
и затем по формуле (7) величину
![]() .
Внести полученные данные в табл.1.
.
Внести полученные данные в табл.1.
3.1.7. Приготовить три раствора слабой кислоты как в п. 3.1.1, доливая до метки компонентами буферного раствора с целью получения растворов с заданными значениями рН (табл.2).
3.1.8.
С помощью рН-метра измерить значения
рН и вылить растворы в бутыли для
встряхивания. Провести экстрагирование,
разделение фаз и анализ водных фаз, как
описано в пп. 3.1.4
3.1.6. Внести полученные значения рНi
,
![]() ,
,
![]() и
и
![]() в табл.1.
в табл.1.
3.1.9.
Вычислить
![]() ,
,
![]() ,
,
![]() и три значения
и три значения
![]() по формулам (2
5). Внести результаты в табл.1, вычислить
среднее арифметическое значение
по формулам (2
5). Внести результаты в табл.1, вычислить
среднее арифметическое значение
![]() и
и
![]() .
.
3.1.10.
По результатам работы построить графики
зависимости степени диссоциации (![]() )
и
)
и
![]() от рН.
от рН.
Контрольные вопросы к теме "Исследование процесса распределения растворенного вещества между водной и органической фазами":
1. Условия равновесия в гетерогенной системе, условие самопроизвольности протекания процесса.
2. Химический потенциал компонента раствора.
3. Константа и коэффициент распределения растворенного вещества между двумя несмешивающимися фазами, зависимость их от температуры и химической природы компонентов.
4. Процесс экстрагирования, влияние условия проведения (число экстракций, степень диссоциации) на его эффективность.
5. Определение степени и константы диссоциации слабой кислоты в водной фазе.
Таблица 1
Распределяемое вещество ………………………..
-
 ;
;
 моль/л
моль/л№
рН



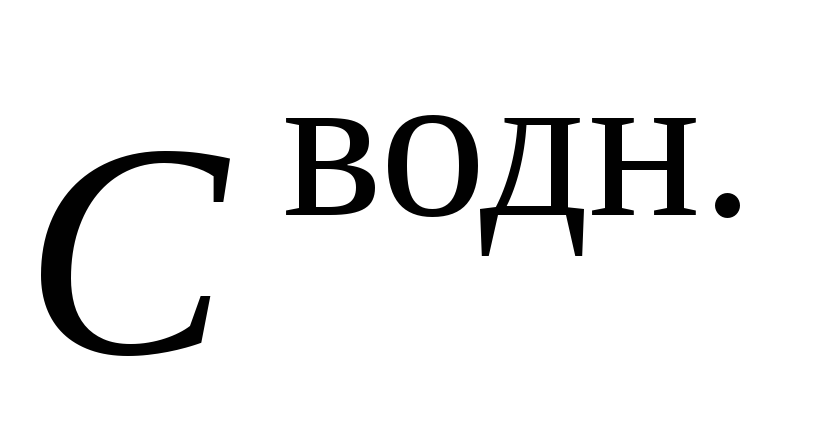 /
/

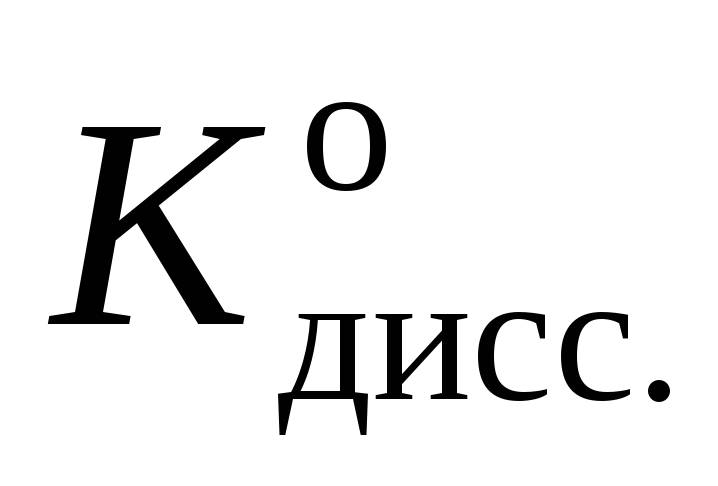
0
–
1
2
3
Таблица 2
Буферная система: 0.1 н KH2PO4 (раствор А)+ 0.05 н Na2B4O7 (раствор Б).
|
рН |
мл. |
рН |
мл. |
рН |
мл. |
рН |
мл. |
|
6.0 |
17.5 |
6.9 |
13.0 |
7.8 |
9.8 |
8.7 |
5.9 |
|
6.1 |
17.1 |
7.0 |
12.5 |
7.9 |
9.6 |
8.8 |
5.2 |
|
6.2 |
16.6 |
7.1 |
12.1 |
8.0 |
9.3 |
8.9 |
4.3 |
|
6.3 |
16.1 |
7.2 |
11.6 |
8.1 |
9.0 |
9.0 |
3.4 |
|
6.4 |
15.6 |
7.3 |
11.3 |
8.2 |
8.7 |
9.1 |
2.1 |
|
6.5 |
15.2 |
7.4 |
11.0 |
8.3 |
8.2 |
9.2 |
0.8 |
|
6.6 |
14.7 |
7.5 |
10.7 |
8.4 |
7.6 |
|
|
|
6.7 |
14.1 |
7.6 |
10.4 |
8.5 |
7.1 |
|
|
|
6.8 |
13.5 |
7.7 |
10.1 |
8.6 |
6.5 |
|
|
Для получения буферного раствора с необходимым значением рН в мерную колбу на 25 мл добавить 5 мл раствора распределяемого вещества, V мл раствора А и долить до метки раствором Б.
ЛИТЕРАТУРА
1. Практические работы по физической химии /Под ред. К.П.Мищенко, А.А.Равделя, А.М.Пономаревой. -Л.: Химия, 1982.-С. 119127.
2. Физическая химия /Под ред. К.С.Краснова. -М.: Высшая школа, 1982.-С. 426 428.
СОДЕРЖАНИЕ
|
|
стр. |
|
Теоретическое введение |
3 |
|
Работа № 10. Исследование равновеcия жидкость пар в однокомпонентной системе |
10 |
|
Работа № 11. Исследование равновесия жидкость пар в двухкомпонентной системе |
18 |
|
Работа № 12. Термических анализ сплавов двухкомпонентной системы |
30 |
|
Работа № 13. Исследование процесса распределения растворенного вещества между водной и органической фазами |
40 |
