
- •Взаимное влияние атомов в органических молекулах Электронные эффекты заместителей
- •Стереоизомерия
- •Кислотные свойства органических соединений
- •Пространственное строение органических молекул Конфигурация, конформация, хиральность
- •Олигосахариды
- •Свойства сахарозы
- •Физиологическая активность гетероциклических соединений, их строение и биологическая роль
- •Гидроксисоединения
- •Углеводы
- •Сахарные кислоты
- •Нуклеиновые кислоты
- •Липиды (жиры)
Свойства сахарозы
Сахароза подвергается гидролизу. Гидролизуется сахароза легче, чем другие дисахариды. Это связано с тем, что остаток фруктозы находится в фуранозной форме. Растворы сахарозы не обладают мутуротацией. При гидролизе сахароза превращается в смесь равных количеств глюкозы и фруктозы. Фруктоза характеризуется более сильным левым вращением, чем правое вращение глюкозы, соответственно по этому раствор гидролизованной сахарозы имеет левое вращение. В связи с изменением в процессе гидролиза правого вращения раствора на левое гидролиз сахарозы получил название инверсии (инверсия – обращение). Смесь равных количеств глюкозы и фруктозы, получающаяся в результате инверсии сахарозы, называется инвертным сахаром. Природным инвертным сахаром является мёд, состоящий в основном из глюкозы и фруктозы. Сахароза является многоатомным спиртом. Подобно моносахаридам раствор гидроксид меди (II) с образованием синего окрашивания сахарата меди, а так же образует простые и сложные эфиры.
Физиологическая активность гетероциклических соединений, их строение и биологическая роль
Гетероциклическими соединениями называются соединения, в цикле которых кроме атома углерода, содержатся другие атомы (N, O, S), называемые гетероатомами. Обобщённо можно констатировать, что ненасыщенные пяти – и шестичленные гетероциклы обладают ароматическими свойствами и способны вступать в реакцию электрофильного замещения подобно аренам и их производным. Однако, по мере накопления в гетероцикле электроотрицательных гетероатомов, например у шестичленных гетероциклов с двумя атомами азота, способность вступать в реакции электрофильного замещения резко падает, но одновременно возрастает способность к реакциям нуклеофильного замещения.
Многочисленные гетероциклические соединения играют важную роль в биологии, медицине и сельском хозяйстве. Они входят в состав важнейших природных продуктов: красящих веществ крови и растений (гемния и хлорофилла), нуклеиновых кислот, многих витаминов, антибиотиков и алкалоидов (к алкалоидам относятся гетероциклические азотсодержащие вещества растительного происхождения: значительная часть алкалоидов является биологически активными соединениями). Можно без преувеличения сказать, что почти вся фармакологическая химия является химией гетероциклических соединений.
Классификация гетероциклических соединений
Классификация основана на двух признаках:
-
число атомов в гетероцикле (трёх-, четырёх-, пяти-, шестичленные гетероциклические соединения)
-
число гетероатомов (один, два или более)
Номенклатура: гетероциклические соединения чаще всего носят тривиальные названия. Из всех гетероциклических соединений наибольшее значение имеют пяти- шестичленные гетероциклические соединения. Для них типична высокая устойчивость гетероциклического кольца, которое в большинстве случаев не изменяется при химических превращениях.
1-ая группа: 5-членные гетероциклы с 1 гетероатомом
![]()
Пиррол – слабое основание, ацидофобен, широко распространён в природе
Производные пиррола
![]()
Индол (бензопиррол). Встречается в природе в виде различных соединений, обладающих биологической активностью, к их числу принадлежит входящий в состав белков аминокислота триптофан.
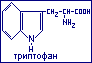
В организме триптофан претерпевает разнообразные метаболические превращения с образованием ряда соединений, участвующих в процессах жизнедеятельности. При гидроксилировании триптофан превращается в 5-окситриптофан, который при карбоксилировании преобразуется в серотонин (биогенный амин).
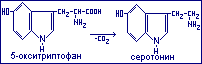
Серотонин – медиатор нервных процессов в центральной нервной системе.
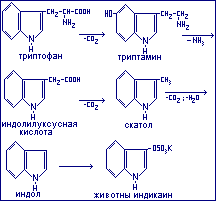
При декарбоксилировании триптофана образуется триптамин. Триптамин при окислительном дезаминировании превращается в индолилуксусную кислоту, которая является стимулятором роста растений. Если она образуется в животном организме, то выделяется с мочой. Содержание её повышено при злокачественных образованиях. При декарбоксилировании индолилуксусной кислоты образуется скатол, который затем превращается в индол. Скатол и индол окисляются в скатоксил и индоксил, которые обезвреживаются в печени и в виде животного индикана выводится из организма с мочой. По количеству индикана в моче судят о скорости гниения белков в кишечнике и о функциональном состоянии печени.
Четыре перрольных кольца образуют циклическую сопряжённую систему: называемую парфином, которая входит в состав хлорофилла, гемоглобина, цитохромов.
Состав гемоглобина
Гемоглобин эритроцитов состоит из: а) гема и б) растворимого в воде белка глобина.
Состав ГЕМА:
-
четыре перрольных цикла
-
четыре метиновых мостика (-СН)
-
четыре радикала метила (-СН3)
-
два радикала ионила (-СН=СН2)
-
два остатка пропионовой кислоты (-СН2-СН2-СООН)
-
ион железа (II) (Fe2+)
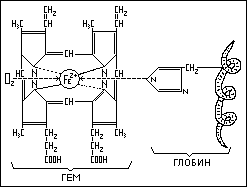
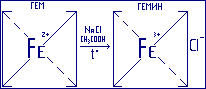
Молекула гемоглобина является природным координационным комплексом. Атом железа в гемме имеет октиэдрическую конфигурацию, т.е. железо здесь шестикоординационное. Ион Fe2+ находится в центре плоского порфиринового квадрата и связан с четырьмя атомами азота перрольных колец. Пятым лигандом является остаток аминокислоты гистидина, с атомом азота которого осуществляется координационная связь атома железа. Шестое координационное место занимает кислород. Биологическая роль гемоглобина заключается в переносе кислорода в животном организме от лёкгих тканям.
Помимо кислорода шестое координационное место занимать другие лиганды. В частности, действие оксида углерода (II) как дыхательного яда связано с тем, что он гораздо прочнее связывается с ионом Fe3+, и гем превращается в гемин–прочные красные кристаллы, содержащие ион хлора. В гемине ион Fe3+ комплексно связан с четырьмя атомами азота перрольных остатков, а ионно – с анионом хлора. Эта качественная реакция используется в судебной экспертизе.
2-ая группа: 5-членные гетероциклы с 2 гетероатомами
![]() Имидазол – более сильное основание,
чем пиррол. Имидазольное кольцо входит
в состав биологически важных веществ
– пуриновых оснований, некоторых
аминокислот и алкалоидов.
Имидазол – более сильное основание,
чем пиррол. Имидазольное кольцо входит
в состав биологически важных веществ
– пуриновых оснований, некоторых
аминокислот и алкалоидов.
![]() Тиазол
– является основой многих лекарственных
препаратов и участвует в образовании
тиамина (витамин В1).
Тиазол
– является основой многих лекарственных
препаратов и участвует в образовании
тиамина (витамин В1).
3-я группа: 6-членные гетероциклы с 1 гетероатомом азота.
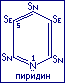 Пиридин.
За счёт атома азота пиридин проявляет
основные свойства. Ядро пиридина
содержится в молекулах некоторых
алкалоидов – никотина, витамина “РР”.
Пиридин.
За счёт атома азота пиридин проявляет
основные свойства. Ядро пиридина
содержится в молекулах некоторых
алкалоидов – никотина, витамина “РР”.
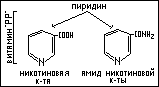
Никотиновая кислота и её амид (никотинамид) получили известность как две формы витамина “РР”, применяющегося в медицине для лечения пеллагры. Никотинамид является основной частью ферментных систем, ответственных за окислительно–восстановительные процессы в организме, а диэтиламид никотиновой кислоты (кордиамин) служит эффективным стимулятором центральной нервной системы.
4-ая группа: 6-членные гетероцтклы с 2 гетероатомами:
Представителем этой группы гетероциклических соединений является пиримидин. Производные пиримидинов объединяются в группу пиримидиновых оснований. Сюда относятся кислородные производные пиримидина: урацил, тимин, цитозин. Для кислородных производных пиримидина характерен новый вид структурной изомерии, который называется таутомерией.
Явление, при котором изомеры переходят один в другой и находятся в состоянии равновесия, называются таутомерией. А изомеры, обратимо переходящие один в другой, называются таутомерными формами. Те случаи таутомерии, в которых происходит обратимое превращение лактимной и лактамной групп, называется лактим-лактамной таутомерией. Лактамы – это оксисоединения, в которых гидроксильная группа стоит при атоме углерода с двойной связью. Такие соединения крайне неустойчивы, в них всё время происходит внутримолекулярная перегруппировка атомов: разрывается двойная связь, атом водорода из гидроксильной группы переходит к смежному по двойной связи атому азота.
![]()
Разберём это явление на примере:
А) Цитозин (4-амино-2-оксипиримидин)
Цитозин, как и другие кислородные производные пиримидина (урацил, тимин), может находиться в виде двух изомеров, один из них называется лактимной формой, другой – лактамной формой.
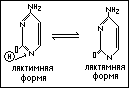
Б) Урацил (2,2-диоксипиримидин).
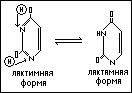
В) Тимин (5-метилурацил).
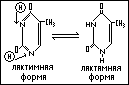
Пиримидиновые основания являются структурными компонентами нуклеиновых кислот (ДНК, РНК).
5-ая группа: конденсированные системы гетероциклов.
Гетероциклические системы, состоящие из двух гетероциклов и имеющие два общих атома углерода, называются конденсированными.
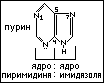
Пурин. Пуриновая группировка входит во многие вещества (нуклеиновые кислоты, нуклеотидные коферменты), участвующие в осуществлении важнейших биологических процессах живых организмов. Пуриновое ядро является фрагментом некоторых алкалоидов.
Пуриновые основания (аденин, гуанин)
Аденин (6-амниопурин).
![]()
Гуанин (2-амино-6-оксипурин).
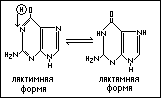
Эти вещества характеризуются высокой стабильностью и имеют исключительное значение в биологии. Аденин является составной частью АТФ. Аденин и гуанин входят в состав нуклеиновых кислот (РНК, ДНК).
Ксантин (2,6-диоксипурин).
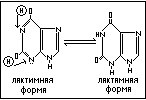
Встречается в растениях. Вместе с кофеином он содержится в чае, в организме животных (в крови, печени, мозге).
Огромное значение в медицине имеют производные ксантина – теофиллин, теобромин, и кофеин. Теофиллин обладает сильным мочегонным действием, возбуждает, стимулирует центральную нервную систему, а в небольших количествах повышает работоспособность. На этом основано широкое применение чая, кофе, какао содержащих кофеин.
Мочевая кислота (2,6,8-триоксиурин).
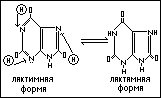
Мочевая кислота – конечный продукт метаболизма пуриновых соединений в организме. Она выделяется с мочой в количестве 0,5-1,0 грамм в сутки. Соли мочевой кислоты называются уратами. При некоторых нарушениях в организме они откладываются в суставах, например, при подагре, а так же в виде почечных камней. В этих случаях для лечения применяют неорганические соли лития (например Li2CO3), которые образуют хорошо растворимые соли мочевой кислоты, быстро выделяемые из организма.
