
- •Взаимное влияние атомов в органических молекулах Электронные эффекты заместителей
- •Стереоизомерия
- •Кислотные свойства органических соединений
- •Пространственное строение органических молекул Конфигурация, конформация, хиральность
- •Олигосахариды
- •Свойства сахарозы
- •Физиологическая активность гетероциклических соединений, их строение и биологическая роль
- •Гидроксисоединения
- •Углеводы
- •Сахарные кислоты
- •Нуклеиновые кислоты
- •Липиды (жиры)
ИЗДАНИЕ ВТОРОЕ – ДОРАБОТАННОЕ (01.2005г)
Дополнен теоретический материал, количество формул увеличилось, исправлены многие ошибки.
Введение в биоорганическую химию. Строение, классификация и принципы современной номенклатуры органических соединений.
Биоорганическая химия изучает строение и свойства, участвующих в процессах жизнедеятельности веществ, в непосредственной связи с познанием их биологических функций. Биоорганическая химия уделяет основное внимание вопросам строения и реакционной способности биологически значимых соединений, оказывает большое влияние на развитие всех дисциплин медико-биологического профиля и тесно связана с решением важных вопросов практического здравоохранения.
Без знания строения и свойств биополимеров и биорегуляторов невозможно познание сущности биологических процессов. Возможность синтетического получения аналогов природных соединений открывает пути к выяснению механизма действия химического соединения в клетке. Поэтому биоорганическая химия играет большую роль в выяснении таких важных вопросов как молекулярный механизм иммунитета, процессов зрения, памяти, нервной проводимости, а так же механизм действия ферментов и лекарственных веществ.
В живом организме протекает множество химических реакций. Совокупность этих реакций называется обменом веществ, или метаболизмом. Метаболизм включает: катаболизм и анаболизм. Катаболизм – реакции распада веществ, подающихся в организм с пищей. Анаболизм – синтез сложных молекул из более простых, в результате которого осуществляется образование и обновление структурных компонентов живого организма.
Классификация органических соединений
Огромное количество органических соединений, которых в настоящий момент насчитывается около 7 млн., классифицируют с учётом строения углеродной цепи (углеродного скелета) и присутствующих в молекуле функциональных групп. В зависимости от строения углеродной цепи органические соединения делятся на ациклические и циклические.
Ациклические соединения – соединения с открытой (незамкнутой) углеродной цепью. Их простейшими представителями являются алифатические углеводороды. Алифатические углеводороды содержат только атомы углерода и водорода, и могут быть насыщенными (алканы) и ненасыщенными (алкены, алкадиены, алкины).
Циклические соединения – соединения с замкнутой углеродной цепью. В зависимости от природы атомов, составляющих цикл, различают карбоциклические и гетероциклические соединения.
Карбоциклические соединения содержат в цикле только атомы углерода и делятся на две группы: алифатические циклические и ароматические соединения.
Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов – гетероатомов – кислород, азот, серу.
Органические соединения можно рассматривать как углеводороды или их производные, полученные путём введения в углеводороды функциональных групп.
Функциональная группа – атом или группа атомов, определяющие принадлежность соединения к определённому классу и ответственные за его химические свойства.
Номенклатура органических соединений
Номенклатура представляет собой систему правил, позволяющих дать однозначное название каждому индивидуальному соединению. В настоящее время общепринятой является систематическая номенклатура ИЮПАК. Однако, в органической химии, сохраняются и тривиальные (обыденные) названия, использовавшиеся ещё до того, как становилось известным строение вещества.
Для пользования систематической номенклатурой ИЮПАК необходимо знать содержание ряда номенклатурных терминов: родоначальная структура, характеристическая группа, заместитель и органический радикал.
Родоначальная структура – химическая структура, составляющая основу называемого соединения, например, в качестве родоначальной структуры рассматриваются главная углеродная цепь в ациклических соединениях и цикл в карбоциклических и гетероциклических соединениях.
Характеристическая группа – функциональная группа, связанная с родоначальной структурой или частично входящая в её состав.
Заместитель – любой атом или группа атомов, замещающие в исходном соединении атом водорода.
Органический радикал – остаток молекулы, из которой удалены один или несколько атомов водорода, при этом остаются свободными одна или несколько валентностей.
Взаимное влияние атомов в органических молекулах Электронные эффекты заместителей
.
азывается
П-избыточной системмочной системмойее
электроотрицательному атому азота.
![]() -
и П-связи,
которые могут быть полярными и неполярными.
-
и П-связи,
которые могут быть полярными и неполярными.
Неполярные
ковалентные возникают между атомами с
одинаковыми величинами электроотрицательности,
например: в пропане СН3-СН2-СН3.
В молекулах органических соединений
атом углерода может быть соединён с
атомами: О,N,Cl,Br,F
и другими гетероатомами, имеющими более
высокое значение электроотрицательности
по сравнению с атомами углерода. Это
приводит к поляризации ковалентной
связи, например: в молекуле 1-хлорпропана
(CH3-CH2-CH2-Cl).
Гетероатом или заместитель вызывает
поляризацию не только "своей"
![]() -связью,
но и передаёт своё влияние на соседние
-связью,
но и передаёт своё влияние на соседние
![]() -связи
проявляя индуктивный эффект:
-связи
проявляя индуктивный эффект:
Индуктивный
эффект
- это передача электронного влияния
заместителя по цепи
![]() -связей.
-связей.
Индуктивный
эффект
обозначается I
или знаком "![]() ",
причём остриё стрелки направлено в
сторону более электроотрицательного
элемента. Действие индуктивного эффекта
наиболее значительно проявляется на
двух ближайших атомах углерода, а через
3-4 связи он затухает. Заместители,
смещающие электронную плотность по
цепи
",
причём остриё стрелки направлено в
сторону более электроотрицательного
элемента. Действие индуктивного эффекта
наиболее значительно проявляется на
двух ближайших атомах углерода, а через
3-4 связи он затухает. Заместители,
смещающие электронную плотность по
цепи
![]() -связей
в свою сторону, проявляют отрицательный
индуктивный эффект (-I).
Это так называемые электроноакцепторные
заместители (ЭА-заместители), например:
-OH,
-NH2,
-F,
-Cl,
-Br
и др. Заместители, смещающие электронную
плотность от себя, повышая её в цепи,
проявляют положительный индуктивный
эффект (+I).
Это электронно-донорные заместители
(ЭД-заместители), например: -CH3,
-C2H5,
-Na,
-K
и др. В молекулах органических соединений
наряду с индуктивным эффектом заместителей
также проявляется мезомерный эффект,
который действует в сопряжённых системах.
-связей
в свою сторону, проявляют отрицательный
индуктивный эффект (-I).
Это так называемые электроноакцепторные
заместители (ЭА-заместители), например:
-OH,
-NH2,
-F,
-Cl,
-Br
и др. Заместители, смещающие электронную
плотность от себя, повышая её в цепи,
проявляют положительный индуктивный
эффект (+I).
Это электронно-донорные заместители
(ЭД-заместители), например: -CH3,
-C2H5,
-Na,
-K
и др. В молекулах органических соединений
наряду с индуктивным эффектом заместителей
также проявляется мезомерный эффект,
который действует в сопряжённых системах.
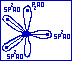
Сопряжёнными называются системы с чередующимися простыми и двойными связями (...-С=С-С=С-...), или системы, в которых у соседнего, с двойной связью, гетероатома имеется рz-орбиталь с неподелённой парой электронов.
![]()
Сопряжённые системы делятся на открытые и замкнутые.
Открытые сопряжённые системы
Примером может служить бутадиен-1,3 СН2=СН-СН=СН2. Рассмотрим на этом примере возникновение П,П-сопряжения.
![]()
В молекуле бутадиена-1,3 атомы углерода находятся в состоянии sp2-гибридизации.
Атомы
углерода, соединяясь между собой
![]() -связями,
образуют сигма-скелет молекулы. Рz
атомные орбитали каждого атома
располагаются перпендикулярно плоскости
-связями,
образуют сигма-скелет молекулы. Рz
атомные орбитали каждого атома
располагаются перпендикулярно плоскости
![]() -скелета
и параллельно друг другу, что создаёт
условия для их взаимного перекрывания.
-скелета
и параллельно друг другу, что создаёт
условия для их взаимного перекрывания.
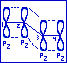
Происходит перекрывание рz-орбиталей атомов С1иС2, С2иС3, С3иС4. В результате него возникает единое сопряженное П-электронное облако, равномерно распределенное (делокализованное) по всей системе. Так возникает П,П-сопряжение при взаимодействии рz-орбиталей и пи-связью.
Р,П-сопряжённие возникает при взаимодействии рz-орбитали гетероатома, имеющего не поделённую пару электронов, с П-связью. Рассмотрим на примере дивинилового эфира.

Замкнутые сопряжённые системы
При определённых условиях в циклических молекулах могут возникать замкнутые сопряжённые системы, например: в молекуле бензола С6Н4. В молекуле бензола атомы углерода находятся в состоянии sp2-гибридизации. Система связей С-С и С-Н образует плоский сигма-скелет молекулы (бензольный цикл).
![]()
Рz
атомные орбитали каждого атома
располагаются перпендикулярно плоскости
![]() -скелета
и параллельно друг другу, что создаёт
условия для их взаимного перекрывания.
-скелета
и параллельно друг другу, что создаёт
условия для их взаимного перекрывания.
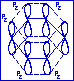
В результате взаимного перекрывания р2-орбиталей атомов углерода возникает единое замкнутое сопряженное р-электронное облако, делокализованное на всех атомах цикла. Такая система называется ароматической.
Хюккель установил критерии ароматичности (1931г):
1.Молекула имеет циклическое строение.
2.Все
атомы цикла, находясь в состоянии
sp2-гибридизации,
соединяясь между собой
![]() -связями,
образуют плоский сигма-скелет молекулы.
Рz-орбитали
каждого атома располагаются перпендикулярно
плоскости
-связями,
образуют плоский сигма-скелет молекулы.
Рz-орбитали
каждого атома располагаются перпендикулярно
плоскости
![]() -скелета
и параллельно друг другу, что создаёт
условия для их взаимного перекрывания.
-скелета
и параллельно друг другу, что создаёт
условия для их взаимного перекрывания.
3.Врезультате взаимного перекрывания взаимного перекрывания рz-орбиталей возникает единое замкнутое сопряжение - П-электоронное облако, делокализованное на всех атомах цикла и содержащее в соответствии с правилом Хюккеля (4n+2) пи-электроны, где n-любое натуральное число (1,2,3...). Для бензола n=1, отсюда ароматическая система бензола содержит (4*1+2)=6 пи-электронов, или ароматический секстет.
Критериям ароматичности также отвечают конденсированные бензоидные соединения, например: нафталин,
![]()
природные гетероциклические соединения, например: пиррол,
![]()
имидазол.
![]()
Рассмотрим критерии ароматичности на примере имидазола,
![]()
где 1-пиррольный атом азота, 2-пиридиновый атом азота.
Молекула имидазола отвечает всем трём критериям ароматичности. Для имидазола n=1, следовательно, система имидазола содержит (4*1+2)=6 П-электронов. В ароматический секстет имидазола поставляют по одному электрону три атома углерода и пиридиновый атом азота. Пиррольный атом азота поставляет два электрона (цикл имидазола с П-орбиталями).
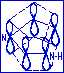
Пиррольный
атом азота
находится в состоянии sp2-гибридизации.
Три гибридные орбитали пиррольного
азота участвуют в образовании
![]() -связей
с соседними атомами углерода и водорода.
Четвёртая негибридная рz-орбиталь
участвует в образовании ароматического
секстета, поставляя в него неподелённую
пару электронов.
-связей
с соседними атомами углерода и водорода.
Четвёртая негибридная рz-орбиталь
участвует в образовании ароматического
секстета, поставляя в него неподелённую
пару электронов.
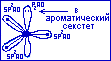
Две
гибридные атомные орбитали пиридинового
атома азота
участвуют в образовании
![]() -связей
с соседними атомами углерода. Третья
гибридная атомная орбиталь с неподелённой
парой электронов лежит в плоскости
-связей
с соседними атомами углерода. Третья
гибридная атомная орбиталь с неподелённой
парой электронов лежит в плоскости
![]() -скелета,
обуславливая свойства пиридинового
атома азота как основания, т.е. способность
присоединять протон Н+.
-скелета,
обуславливая свойства пиридинового
атома азота как основания, т.е. способность
присоединять протон Н+.
Четвёртая негибридная рz-атомная орбиталь участвует в образовании ароматического секстета,
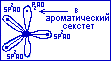
доставляя в него один электрон. В молекулах имидазола 6-электронное П-облако делокализованно на пяти атомах цикла.
![]()
Такая система называется П-избыточной системой.
В молекуле другого гетероциклического соединения – пиридина – электронная плотность 6-электронного П-облака смещена к более электроотрицательному атому азота. Такая система называется П-недостаточной.
![]()
Образование сопряжённой системы приводит к выравниванию длин связей, равномерному распределению электронной плотности в молекуле, снижению энергетического уровня системы. Всё это способствует стабилизации молекулы. О термодинамической устойчивости сопряжённой системы судят по величине энергии сопряжения, которая рассчитывается по формуле:
![]() Е=Ен-Ес,
где
Е=Ен-Ес,
где
![]() Е
– энергия сопряжения
Е
– энергия сопряжения
Ен – полная П-электронная энергия несопряжённой системы
Ес – полная П-электронная энергия сопряжённой системы
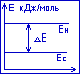
Энергия напряжения равна энергии стабилизации – это та энергия, которая выделяется при образовании сопряжённой системы из несопряжённой системы. В открытых сопряжённых системах чем длиннее цепь сопряжения, тем выше энергия сопряжения и стабильнее система. Замкнутые сопряжённые системы более стабильны, чем открытые.
Мезомерный эффект – это передача электронного влияния заместителя по системе сопряжённых связей в сопряжённой системе. Мезомерный эффект обозначается М или графически стрелкой, начало которой указывает какие р- или П-электроны смещаются, а конец – связь или атом, к которому смещается электронная плотность. Мезомерный эффект заместителей проявляется как в открытых так и в замкнутых сопряжённых системах.
Мезомерный эффект в открытых сопряжённых системах
(пентадиен-2,4-аль с эффектами)
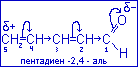
Альдегидная группа и другие заместители, содержащие кратные связи, (например: -СООН, -SO3H2, -NO2) вступая в П,П-сопряжение с сопряжённой системой, оттягивают на себя электронную плотность, понижая её в сопряжённой системе. Они проявляют отрицательный мономерный эффект (-М).
В молекуле этого альдегида также проявляется индуктивный эффект заместителя, который направлен к более электроотрицательному атому кислорода.
Для прогнозирования свойств органических соединений необходимо учитывать результирующее влияние электронных эффектов заместителей. Для этого дают характеристику заместителю с учётом проявляемых эффектов.
Для альдегидной группы: -CHO (-I,-M,ЭА). Под влиянием ЭА-заместителя в молекуле пентадиен-2,4-аля электронная плотность смещается к заместителю и подвижна в углеродной цепи.
Мезомерный эффект в замкнутой сопряжённой системе
Рассмотрим на примере фенола С6Н5ОН (фенол с эффектами).
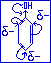
Гидроксогруппа –:ОН, -:NH2, и другие заместители, содержащие неподелённую пару электронов у гетероатома, вступая в р,П-сопряжение с сопряжённой системой, поставляют в ней неподелённую пару электронов, повышая в неё электронную плотность. Они проявляют положительный мезомерный эффект (+М). Это ЭД-заместители.
-:ОН (-I,+M; +M>>-I, ЭД)
Под влиянием ЭД-заменителя (гидроксогруппы) в молекуле фенола и положениях 2,4,6 (орто- и пара-) появляются реакционные центры, несущие частично отрицательные заряды – нуклеофильные реакционные центры. Заместитель гидроксогруппа относится к ориентам первого рода, т.к. непроявляет последующее замещение в орто- и пара-положения.
Рассмотрим молекулу бензольной кислоты (бензольная кислота с эффектами).
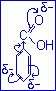
-СООН (-I,-M; ЭА).
Под влиянием ЭА заместителя в молекуле бензольной кислоты в метаположении проявляются реакционные нуклеофильные центры. Заместитель СООН – группа относится к ориентантам второго рода, т.к. направляет последующие заместители в метаположение.
В молекулах ряда органических соединений индуктивный и мезомерный эффекты заместителей действуют одновременно. При этом они могут быть либо однонаправленными, либо противоположно направленными. В большинстве случаев мезомерный эффект преобладает над индуктивным. У галогенов преобладающим является индуктивный эффект. Учитывая перераспределение электронной плотности, происходящее в молекулах органических соединений под влиянием электронных эффектов заместителей, могут прогнозироваться свойства органических соединений.
