
- •Взаимное влияние атомов в органических молекулах Электронные эффекты заместителей
- •Стереоизомерия
- •Кислотные свойства органических соединений
- •Пространственное строение органических молекул Конфигурация, конформация, хиральность
- •Олигосахариды
- •Свойства сахарозы
- •Физиологическая активность гетероциклических соединений, их строение и биологическая роль
- •Гидроксисоединения
- •Углеводы
- •Сахарные кислоты
- •Нуклеиновые кислоты
- •Липиды (жиры)
Кислотные свойства органических соединений
Кислотность и основность – важнейшие понятия, определяющие многие физико-химические свойства органических соединений. Слабые кислоты и основания – обычные компоненты биологических систем, играющие важную роль в метаболизме и его регуляции. По теории электролитической диссоциации Аррениуса, кислота – электролит, диссоциирующий с образованием ионов водорода и кислотного остатка. Основание – электролит, диссоциирующий с образованием гидроксид ионов. Эти положения справедливы для процессов, протекающих в водных растворах, и они не объясняют поведение веществ в неводных растворах. Исследование диссоциации вещества в неводных растворителях расширило представление о веществах, представляющих кислотные и основные свойства.
Большинство органических соединений можно рассматривать как кислоты, т.к. в их молекулах имеются связи атомов водорода с атомами С, О, N, S. Органические соединения классифицируют по кислотным центрам на С–Н, О–Н, N–H, S–H кислоты.
Кислотный центр – это элемент и связанный с ним атом водорода. На кислотные свойства органических соединений оказывает влияние стабильность аниона, образующегося при отдаче протона Н+. На стабильность аниона оказывают влияние следующие факторы:
-
природа элемента в кислотном центре
а. электроотрицательность элемента в кислотном центре
СН3-СН2ОН (этанол), рКа=18; СН3-СН2-HNH (этаномин) рКа=30.
Чем ниже рКа, тем сильнее кислота. Поскольку О2 является более электроотрицательным элементом, чем N2, то связь О-Н более полярная, чем связь N-H, атом водорода в О-Н кислотном центре будет более подвижным, чем в N-H центре.
Исходя из величины рК этанол проявляет более выраженные кислотные свойства по сравнению с этаномином, т.к. образующийся при отщеплении протона алкоксид-ион СН3-СН2О- будет обладать более высокой стабильностью по сравнению с алкиламид-ионом CH3-CH2-NH-. Это объясняется тем, что более электроотрицательный кислород в алкоксид-ионе способен в гораздо большей степени нести отрицательный заряд по сравнению с атомом N в алкиламид-ионе.
б. неполяризуемость элементов в кислотном центре
СН3-СН2-ОН (этанол) рКа = 18; CH3-CH2-SH (этантиол) рКа = 10,5.
Исходя из величины рКа, этантиол проявляет более выраженные кислотные свойства по сравнению с этанолом. Если брать во внимание электроотрицательность элемента в кислотном центре, то этанол должен быть более сильной кислотой по сравнению с этантиолом, но в данном случае преобладает не фактор электроотрицательности, а фактор поляризуемости.
Поляризуемость атома – это мера смещения, рассредоточения электронного облака атома под действием внешнего электронного поля. Поляризуемость атома возрастает с увеличением числа электронов и энергетических уровней. Атом серы более поляризуем, чем атом кислорода, т.е. атом серы имеет три энергетических уровня, а атом кислорода – два. Образующийся при отщеплении протона меркаптид-ион CH3-CH2-S- будет обладать более высокой стабильностью по сравнению с алкоксид-ионом СН3-СН2-О-, т.к. в связи с более высокой поляризуемостью атома серы отрицательный заряд в меркаптид-ионе делокализован в гораздо большем объёме. Поэтому этантиол проявляет более выраженные кислотные свойства по сравнению с этанолом.
-
стабилизация аниона за счёт сопряжения
С2Н5-ОН
(этанол) рКа
=18; С6Н5-ОН
(фенол) рКа
=9,9 (этанол с эффектами).
Исходя из величины рКа фенол проявляет более выраженные кислотные свойства по сравнению с этанолом. Для объяснения этого факта рассмотрим влияние электронных эффектор заместителей в молекулах этих соединений.
Род влиянием указанных электронных эффектов заместителей в молекуле этанола электронная плотность смещена к атому кислорода. Образующийся при отщеплении протона алкоксид-ион СН3-СН2-О- будет обладать низкой стабильностью, т.к. отрицательный заряд в этом анионе практически не делокализован по всей системе, а сосредоточен на атоме кислорода, поэтому этанол проявляет слабо выраженные кислотные свойства.
В
молекуле же фенола (фенол с эффектами)
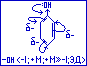 под влиянием ЭД-заместителя ОН группы
электронная плотность смещена от
заместителя и делокализована по
ароматическому кольцу. Образующийся
при отщеплении протона фенокси-ион
СН6-Н5-О-
являясь сопряжённой системой, будет
обладать более высокой стабильностью
по сравнению с алкоксид-ионом СН3-СН2О-,
который не является сопряжённой системой.
Таким образом, образование сопряжённой
системы способствует делокализации
заряда в анионе, что повышает его
стабильность и усиливает кислотные
свойства вещества.
под влиянием ЭД-заместителя ОН группы
электронная плотность смещена от
заместителя и делокализована по
ароматическому кольцу. Образующийся
при отщеплении протона фенокси-ион
СН6-Н5-О-
являясь сопряжённой системой, будет
обладать более высокой стабильностью
по сравнению с алкоксид-ионом СН3-СН2О-,
который не является сопряжённой системой.
Таким образом, образование сопряжённой
системы способствует делокализации
заряда в анионе, что повышает его
стабильность и усиливает кислотные
свойства вещества.
-
Влияние радикала на стабильность аниона
При одинаковых кислотных центрах появление в радикалах электроноакцепторных заместителей способствует делокализации отрицательного заряда в анионе, что повышает его стабильность и усиливает кислотные свойства вещества. Рассмотрим на примере: СН3-СН2-СООН (пропионовая кислота), рКа =4,9; молочная кислота рКа =3,83.
Исходя
из величины рКа
молочная кислота
![]() будет более сильной, чем пропионовая
кислота, т.к. наличие в радикале этой
кислоты электроноакцепторного заместителя
ОН группы способствует делокализации
отрицательного заряда в лакта-анион
СН3-СН(ОН)-СОО-,
что повышает его стабильность по
сравнению с пропионат-ионом СН3-СН2СОО-,
радикал которого не содержит такого
заместителя. Поэтому молочная кислота
проявляет выраженные кислотные свойства
по сравнению с пропионовой.
будет более сильной, чем пропионовая
кислота, т.к. наличие в радикале этой
кислоты электроноакцепторного заместителя
ОН группы способствует делокализации
отрицательного заряда в лакта-анион
СН3-СН(ОН)-СОО-,
что повышает его стабильность по
сравнению с пропионат-ионом СН3-СН2СОО-,
радикал которого не содержит такого
заместителя. Поэтому молочная кислота
проявляет выраженные кислотные свойства
по сравнению с пропионовой.
-
Влияние растворителя на стабильность аниона.
В водных растворах анионы гидратируются, что повышает их стабильность и усиливает кислотные свойства вещества. Чем меньше радиус аниона, тем он более гидротирован и стабилен, а, следовательно, будет выше кислотные свойства вещества.
НСООН (муравьиная кислота) рКа=3,7; СН3СООН (уксусная кислота) рКа=4,76; СН3-СН2-СООН (пропионовая кислота) рКа=4,9.
Исходя из величины рКа в этом ряду кислот наиболее сильной является муравьиная кислота. Это объясняется тем, что формат-ион НСОО- имел малые размеры, наиболее гидротирован и стабилен по сравнению с ацетат-ионом СН3-СОО- и пропионат-ионом СН3-СН2-СОО-.
