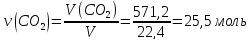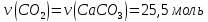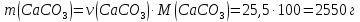- •Основные классы неорганических соединений. Типы оксидов и гидроксидов, их свойства (основные, кислотные, амфотерные) на примере реакций.
- •Понятие эквивалента элемента и закон эквивалентов. Расчет молярной массы эквивалента для элементов и соединений ( кислоты, основания, соли) и в реакциях.
- •Квантовые числа. Атомные орбитали, энергетические уровни и подуровни. Формы s-p-d- орбиталей.
- •Способы выражения концентраций растворов. Перечислить 6 способов.
- •Водородная связь. Условия образования. Примеры водородной связи и свойства веществ с таким типом связи.
- •Металлическая связь. Зонная теория.
- •Газовые законы. Константы Авогадро.
- •Типы кристаллических решеток, свойства соединений с атомной, молекулярной, ионной и металлической связью.
- •1.Что такое ангидрид кислоты? Какими свойствами он обладает? Напишите формулы ангидридов кислот:h2so4, hno3, h3po4, hClO3, hMnO4,
- •2. Определите формулу соединения, содержащего 80% углерода и 20% водорода, относительная плотность которогопо водороду равна 15. Какие законы химии вы используете для рассчетов.
- •5. Какую массу железа можно получить из 2 т руды, содержащей 94% Fe2o3. Составьте уравнение реакции. Как называется такой метод? Какие законы химии вы использовали для расчетов?
- •6. Показать валентные возможности атомов. Рассмотреть на примере хлора.
- •7. У какой группы частиц электронные формулы одинаковые. Ответ поясните.
- •11. Какой тип гибридизации и строение молекулы роCl3?
1.Что такое ангидрид кислоты? Какими свойствами он обладает? Напишите формулы ангидридов кислот:h2so4, hno3, h3po4, hClO3, hMnO4,
Ангидрид —химическое соединение какого либо, элемента с кислородом, которое можно получить, отнимая воду от соответствующей кислоты.
1) Взаимодействие с водой (Кроме SiO2) приводит к образованию кислоты:
SO3 + H2O = H2SO4
2) Взаимодействуют со щелочами с образованием соли и воды:
CO2 + Ba(OH)2 = BaCO3 + H2O,
но при недостатке щелочи может образовываться кислая соль:
SO2 + KOH = KHSO3
3) Также кислотные оксиды взаимодействуют с основными оксидами, вследствие чего образуется соль:
CO2 + CaO = CaCO3
4) Взаимодействуют с солями летучей кислоты, образуется соль и кислотный оксид:
SiO2 + CaCO3 = CaSiO3 + CO2(газ) - при нагревании.
5) Взаимодействуют с амфотерными оксидами с образованием средней соли:
Al2O3 + 3SO3 = Al2(SO4)3
SO3 — ангидрид серной кислоты H2SO4;
N2O5 — ангидрид азотной кислоты HNO3;
P2O5 – ангидрид форсфорной кислоты H3PO4;
Cl2O5 - ангидрид хлорноватой кислоты HClO3
Mn2O7 - ангидрид марганцевой кислоты HMnO4....
2. Определите формулу соединения, содержащего 80% углерода и 20% водорода, относительная плотность которогопо водороду равна 15. Какие законы химии вы используете для рассчетов.
|
Дано: w (C)=80% w (H)=20% D (H2)=15 Найти: Молекулярнаяформула-?
|
Решение: 1).Определяем Mr вещества. D (H2)=Mr (вещ-ва) : Mr (H2); Mr (вещ-ва) = D(H2)*Mr(H2); Mr =15*2=30 2).Определяем, сколько по массе приходится на углерод: 30-100% x-80% x=24 (C) 3).Определяем, сколько по массе приходится на водород: m(H)=30-24=6. 4). Определяем число атомов углерода и водорода в данном веществе: n(C)=24:12=2 атома; n(H)=6:1=6 атомов. Формула вещества С2 Н6 -этан
|
В расчетах используется следствие из закона Авогадро.
3. Как можно получить углекислый газ из известняка, в котором содержится 85% СаСО3?Составьте уравнение реакции. Какая масса этого вещества потребуется для получения 571,2 л СО2 (н.у.). Какие законы химии вы использовали для расчетов?
|
Дано: ω%(СаСО3)=85 % V(CO2)=571,2 л
Найти: m(известняка) = ? |
Решение 1) Запишем уравнение получения углекислого газа из известняка при нагревании: CaCO3→CaO+CO2 2) Найдем количество моль СО2
3) По закону эквивалентов
4) Найдем массу СаСО3
5) Масса известняка равна 2550 г – 85 % Х г - 100 %
Х = 2550∙100/85 = 3000 г Ответ: m(известняка) = 3000 г |
В расчетах используется закон эквивалентов и закон сохранения массы.
4. Атомный номер элемента 55, атомная масса 133. Укажите число протонов, электронов, нейтронов, атомный номер элемента, число неспаренных электронов, семейство элементов. Напишите полную электронную, электронографическую формулу валентных электронов. Какую информацию можно получить еще, зная атомный номер элемента?
Атомный номер элемента 55, атомная масса 133 – элемент Cs цезий
Протоны – 55
Электроны – 55
Нейтроны – 78
Атомный номер – 55
Число неспаренных электронов – 1
Семейство элементов – s-элементы
Атомная масса – 133
Полная электронная формула: 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1
Внешний энергетический уровень атома цезия содержит 1 электрон, который является валентным. Возбужденного состояния нет. Энергетическая диаграмма основного состояния принимает следующий вид:
![]()