
- •Основные классы неорганических соединений. Типы оксидов и гидроксидов, их свойства (основные, кислотные, амфотерные) на примере реакций.
- •Понятие эквивалента элемента и закон эквивалентов. Расчет молярной массы эквивалента для элементов и соединений ( кислоты, основания, соли) и в реакциях.
- •Квантовые числа. Атомные орбитали, энергетические уровни и подуровни. Формы s-p-d- орбиталей.
- •Способы выражения концентраций растворов. Перечислить 6 способов.
- •Водородная связь. Условия образования. Примеры водородной связи и свойства веществ с таким типом связи.
- •Металлическая связь. Зонная теория.
- •Газовые законы. Константы Авогадро.
- •Типы кристаллических решеток, свойства соединений с атомной, молекулярной, ионной и металлической связью.
- •1.Что такое ангидрид кислоты? Какими свойствами он обладает? Напишите формулы ангидридов кислот:h2so4, hno3, h3po4, hClO3, hMnO4,
- •2. Определите формулу соединения, содержащего 80% углерода и 20% водорода, относительная плотность которогопо водороду равна 15. Какие законы химии вы используете для рассчетов.
- •5. Какую массу железа можно получить из 2 т руды, содержащей 94% Fe2o3. Составьте уравнение реакции. Как называется такой метод? Какие законы химии вы использовали для расчетов?
- •6. Показать валентные возможности атомов. Рассмотреть на примере хлора.
- •7. У какой группы частиц электронные формулы одинаковые. Ответ поясните.
- •11. Какой тип гибридизации и строение молекулы роCl3?
-
Типы кристаллических решеток, свойства соединений с атомной, молекулярной, ионной и металлической связью.
В зависимости от частиц, которые стоят в узлах решетки, различают:
-
металлическую кристаллическую решетку;
-
ионную кристаллическую решетку;
-
молекулярную кристаллическую решетку;
-
макромолекулярную (атомную) кристаллическую решетку.
Металлическая связь в кристаллических решетках.
Атомы расположены максимально близко друг к другу, очень плотно. Промежутки между атомами (шарами) очень малы, поэтому имеет место быть название, плотноупакованная структура. Существует 3 основных типа таких структур: гексагональная плотная упаковка (ГПУ), гранецентрированная кубическая упаковка (ГКУ) и объемно центрированная кубическая упаковка (ОЦКУ). Последняя менее плотная.
Вещества с металлической структурой обладают такими свойствами, как температура плавления, кипения, ковкость, плотность, теплопроводность и электропроводность.
Ионная связь кристаллических решеток.
В узлах кристалла находятся ионы, из-за этого тут превалируют электростатические силы, вследствие чего в структуре должна быть электрическую нейтральность. У каждого типа ионной решетки должно быть свое координационное число. Например, молекула хлорида натрия: Na+, Cl-. Каждый ион Na+ окружен 6-тью ионами Cl-, поэтому координационное число равно 6. И вокруг иона Cl- тоже 6 ионов натрия, поэтому тут в молекуле присутствует координация 6:6.
Вещества с таким типом решетки обладают высокой твердостью, они тугоплавки и малолетучи. Электричество проводят не только растворы, но и расплавы (т.к. ионные соединения диссоциируют в полярных жидкостях (вода).
Ионные кристаллы обладают повышенной хрупкостью, т.к. сдвиг в решетке кристалла (даже незначительный) приводит к тому, что одноименно заряженные ионы начинают отталкиваться друг от друга, и связи рвутся, образуются трещины и расколы.
Молекулярная связь кристаллических решеток.
Основная особенность межмолекулярной связи заключается в ее «слабости» (ван-дер-ваальсовые, водородные).
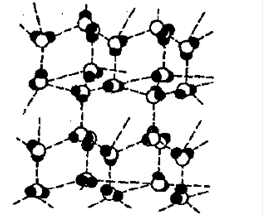
Это структура льда. Каждая молекула воды связана водородными связями с 4-мя окружающими ее молекулами, в результате структура имеет тетраэдрический характер.
Водородная связь объясняет высокую температуру кипения, плавления и малую плотность;
Макромолекулярная связь кристаллических решеток.
В узлах кристаллической решетки находятся атомы. Эти кристаллы разделяются на 3 вида:
каркасные;
цепочечные;
слоистые структуры.
Каркасной структурой обладает алмаз – одно их самых твердых веществ в природе. Атом углерода образует 4 одинаковые ковалентные связи, что говорит о форме правильного тетраэдра (sp3 – гибридизация). Каждый атом имеет неподеленную пару электронов, которые также могут связываться с соседними атомами. В результате чего образуется трехмерная решетка, в узлах которой только атомы углерода.
Энергии для разрушения такой структуры требуется очень много, температура плавления таких соединений высока (у алмаза она составляет 3500°С).
Слоистые структуры говорят о наличии ковалентных связях внутри каждого слоя и слабых ван-дер-ваальсовых - между слоями.
Связи слабые, поэтому их легко разорвать, что можно наблюдать у карандаша – «пишущее свойство» - 4ый слой остается на бумаге.
Графит – отличный проводник электрического тока (электроны способны перемещаться вдоль плоскости слоя).
Цепочечными структурами обладают оксиды (например, SO3), который кристаллизуется в виде блестящих иголок, полимеры, некоторые аморфные вещества, силикаты (асбест).
Практические вопросы на конференц-неделю.
Весна 2015г.
