
- •Основные классы неорганических соединений. Типы оксидов и гидроксидов, их свойства (основные, кислотные, амфотерные) на примере реакций.
- •Понятие эквивалента элемента и закон эквивалентов. Расчет молярной массы эквивалента для элементов и соединений ( кислоты, основания, соли) и в реакциях.
- •Квантовые числа. Атомные орбитали, энергетические уровни и подуровни. Формы s-p-d- орбиталей.
- •Способы выражения концентраций растворов. Перечислить 6 способов.
- •Водородная связь. Условия образования. Примеры водородной связи и свойства веществ с таким типом связи.
- •Металлическая связь. Зонная теория.
- •Газовые законы. Константы Авогадро.
- •Типы кристаллических решеток, свойства соединений с атомной, молекулярной, ионной и металлической связью.
- •1.Что такое ангидрид кислоты? Какими свойствами он обладает? Напишите формулы ангидридов кислот:h2so4, hno3, h3po4, hClO3, hMnO4,
- •2. Определите формулу соединения, содержащего 80% углерода и 20% водорода, относительная плотность которогопо водороду равна 15. Какие законы химии вы используете для рассчетов.
- •5. Какую массу железа можно получить из 2 т руды, содержащей 94% Fe2o3. Составьте уравнение реакции. Как называется такой метод? Какие законы химии вы использовали для расчетов?
- •6. Показать валентные возможности атомов. Рассмотреть на примере хлора.
- •7. У какой группы частиц электронные формулы одинаковые. Ответ поясните.
- •11. Какой тип гибридизации и строение молекулы роCl3?
-
Квантовые числа. Атомные орбитали, энергетические уровни и подуровни. Формы s-p-d- орбиталей.
Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He+, Li2+ и т. д.). В этом случае энергия электрона
В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д.
Орбитальное квантовое число l характеризует форму орбиталей и принимает значения от 0 до n – 1. Кроме числовых l имеет буквенные обозначения
|
l |
= |
0 |
1 |
2 |
3 |
4 |
… |
|
l |
= |
s |
p |
d |
f |
g |
… |
Электроны с одинаковым значением l образуют подуровень.
Квантовое
число l
определяет квантование орбитального
момента количества движения электрона
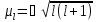 в
сферически симметричном кулоновском
поле ядра.
в
сферически симметричном кулоновском
поле ядра.
Квантовое число ml называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от –l до +l через нуль, то есть 2l + 1 значений.
s-Орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально симметричная форма обусловлена тем, что при l = 0 и μ = 0.
p-Орбитали существуют при n ≥ 2 и l = 1, поэтому возможны три варианта ориентации в пространстве: ml = –1, 0, +1. Все p-орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом 90° друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются px, py, pz.
d-Орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором ml = –2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в пространстве. d-Орбитали, ориентированные лопастями по осям координат, обозначаются dz² и dx²–y², а ориентированные лопастями по биссектрисам координатных углов – dxy, dyz, dxz.
-
Закономерности формирования электронных оболочек атомов:принцип наименьшей энергии, правила Клечковского, принцип Паули, правило Гунда. Полные электронные формулы атомов и электронографические формулы валентных электронов. Валентные возможности атомов.
Принцип наименьшей энергии в общей форме имеет следующую формулировку: электроны в атоме занимают наиболее низкое энергетическое состояние, соответствующее их максимальной устойчивости.
Конкретным выражением принципа наименьшей энергии является правило Клечковского: заполнение атома электронами идет от орбиталей с меньшим значением суммы n + l к орбиталям с большим значением этой суммы, а при одинаковой сумме n + l - от меньших к большим значениям главного квантового числа n.
Порядок заполнения атомных орбиталей по мере увеличения энергии: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈ 6d < 7p < 8s (это правило Клечковского, также правило n + l и правило Маделунга).
Принцип Паули: в атоме не может быть даже двух электронов, имеющих одинаковый набор всех четырех квантовых чисел. Из принципа Паули следует:
1) На одной атомной орбитали, которая характеризуется одинаковыми значениями трех квантовых чисел (n, l и ml), может находиться максимум два электрона, отличающихся спином.
2) На энергетическом уровне может находиться максимум 2n2 электронов: на первом – 2, на втором – 8, на третьем – 18 и т.д.
3) На энергетическом подуровне может находиться максимум 2(2l + 1) электронов: на s-подуровне (одна орбиталь) – 2, на p-подуровне (три орбитали) – 6, на d-подуровне (пять орбиталей) – 10, на f-подуровне (семь орбиталей) – 14.
Правило Гунда описывает закономерности распределения электронов на энергетических подуровнях в тех случаях, когда для полного их заполнения электронов недостаточно: в невозбужденном атоме суммарный спин всех электронов по абсолютной величине максимален, а при равенстве суммарного спина наиболее устойчивым является состояние с наибольшей (по абсолютной величине) суммой магнитного квантового числа.
В соответствии с правилом Гунда, атомные орбитали, принадлежащие к одному подуровню, заполняются каждая вначале одним электроном, а затем происходит их заполнение вторыми электронами.
Существует условное изображение электронных уровней и подуровней, называемое орбитальной диаграммой. На такой диаграмме орбитали условно изображаются квадратиками, а электроны - стрелочками. Если стрелочки направлены в разные стороны, это означает, что электроны различаются между собой особым свойством, которое назывется спином электрона.

На схеме орбитальная диаграмма атома водорода, у которого единственный электрон размещается на самом близком к ядру 1-м уровне. На этом уровне только одна s-орбиталь (на схеме она показана квадратиком).
Теперь рассмотрим атом гелия:
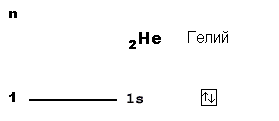
В атоме гелия (2 протона в ядре) уже два электрона, причем оба еще могут поместиться на 1-м уровне. Значит, "адрес" этих электронов такой же, как у водорода: 1s. Но чтобы показать, что здесь находится уже не 1, а 2 электрона, пишут “адрес” с указанием количества “жильцов”-электронов: 1s2. Эта короткая запись описывает электронное строение атома гелия. Поэтому такие записи называют электронными формулами. 1s1 - электронная формула атома водорода. 1s2 - электронная формула атома гелия.
Рассмотрим атом лития:
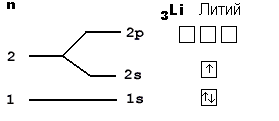
У него три протона в ядре, поэтому литий содержит в своем электронном облаке 3 электрона, для чего занимает электронами сначала весь 1-й уровень (там помещается только 2 электрона), а оставшийся электрон вынужден переместиться на более высокий 2-й уровень, где займет ближайшую к ядру свободную 2s-орбиталь. "Адрес" трех электронов этого элемента таков: 1s22s1.
Валентные возможности атомов определяются числом не спаренных электроном, а также числом не поделённых электронных пар способных переходить на свободные орбитали атома другого элемента (участвовать в образовании ковалентной связи по донорно-акцепторному механизму).
-
Периодический закон и система Д.И.Менделеева. Периоды, группы, подгруппы и семейства. Периодичность в изменении атомных радиусов, электроотрицательности, металлических и неметаллических свойств элементов.
Периодический закон Д.И. Менделеева:
Первоначальная формулировка:
"Свойства элементов, а потому и образуемых ими простых и сложных тел (веществ), стоят в периодической зависимости от их атомного веса".
Современная формулировка:
"Свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов".
Период - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов.
Номер периода обозначает число энергетических уровней в атоме элемента.
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns2 np6).
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические - присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями. Заполнение внешнего s- подуровня указывает на металлические свойства атома, а формирование внешнего p- подуровня - на неметаллические свойства. Увеличение числа электронов на p- подуровне (от 1 до 5) усиливает неметаллические свойства атома. Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns2 np6) химически инертны.
В больших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n - 1) d- подуровня при сохранении внешнего ns2 - слоя. Большие периоды состоят из четных и нечетных рядов.
У элементов четных рядов на внешнем слое ns2 - электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np- подуровень, что объясняет значительное ослабление металлических свойств.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d- подуровне (или (n - 2) f- подуровне).
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III - VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные.
Слева направо усиливаются окислительные свойства, а при движении сверху вниз – восстановительные свойства элементов.
Последняя закономерность распространяется даже на такие необычные элементы, как инертные газы. У "тяжелых" благородных газов криптона и ксенона, которые находятся в нижней части группы, удается "отобрать" электроны и получить их соединения с сильными окислителями (фтором и кислородом), а для "легких" гелия, неона и аргона это осуществить не удается.
В правом верхнем углу таблицы находится самый активный неметалл-окислитель фтор (F), а в левом нижнем углу - самый активный металл-восстановитель цезий (Cs). Цезий настолько активен, что самовозгорается на воздухе (посмотрите опыт из "Единой коллекции цифровых образовательных ресурсов"). Элемент франций (Fr) должен быть еще более активным восстановителем, но его химические свойства изучать крайне трудно из-за быстрого радиоактивного распада.
Электроотрицательность возрастает тоже слева направо, достигая максимума у галогенов. Не последнюю роль в этом играет степень завершенности валентной оболочки, ее близость к октету.
При перемещении сверху вниз по группам электроотрицательность уменьшается. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее.
-
Основные типы и характеристики связи: энергия связи, длина связи, валентный угол. Взаимосвязь длины и энергии связи в однотипных частицах. Механизм образования ковалентной химической связи: обменный и донорно-акцепторный.
Длина
связи ![]() (
(![]() или
нм) - это расстояние между ядрами химически
связанных атомов.
или
нм) - это расстояние между ядрами химически
связанных атомов.
В зависимости от способа образования химической связи различают следующие виды химической связи: ионная (гетеполярная), ковалентная (полярная и неполярная), металлическая, водородная, а также различные виды межмолекулярного взаимодействия (ориентационное, индукционное, дисперсионное и донорно-акцепторное взаимодействия).
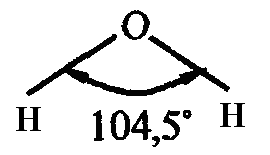
Валентный угол - это угол между воображаемыми линиями, проходящими через ядра химически связанных атомов. В молекуле воды он составляет 104,5°.
Так строение молекулы воды можно выразить структурной формулой:
Энергия связи ядра равна минимальной энергии, которую необходимо затратить для полного расщепления ядра на отдельные частицы. Из закона сохранения энергии следует, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных частиц.
Энергию связи любого ядра можно определить с помощью точного измерения его массы. В настоящее время физики научились измерять массы частиц – электронов, протонов, нейтронов, ядер и др. – с очень высокой точностью. Эти измерения показывают, что масса любого ядра Mя всегда меньше суммы масс входящих в его состав протонов и нейтронов:
Mя < Zmp + Nmn.
Разность масс
ΔM = Zmp + Nmn – Mя.
называется дефектом массы.
По дефекту массы с помощью формулы Эйнштейна E = mc2 можно определить энергию, выделившуюся при образовании данного ядра, т. е. энергию связи ядра Eсв:
Eсв = ΔMc2 = (Zmp + Nmn – Mя)c2.
В ряду однотипных молекул длины связей изменяются закономерно. Например, в ряду HF, HCl, HBr, HI длина связи увеличивается с возрастанием размера атома и соответственно равна(в пм): 91; 127; 141; 161. Энергия связи(Е кДж/моль) в этом ряду закономерно уменьшается: 565,7; 427,8; 362,5; 294,5. На длину связи влияет её кратность. Повышение кратности связи приводит к упрочнению межатомной связи и уменьшению длины связи. Так, длина связи в молекуле фтора (F–F) равна 141 пм ,а энергия связи 159,0 кДж/моль; длина связи в молекуле азота с тройной связью (N≡N) равна 110пм, а энергия связи 941,6 кДж/моль
Образование общих электронных пар ковалентной связи может происходить по двум различным механизмам: обменному и донорно-акцепторному.
В случае обменного механизма каждый из взаимодействующих атомов дает на образование ковалентной связи один или несколько неспаренных электронов внешнего электронного слоя. Схематически образование ковалентной связи можно показать тремя способами:
-
С помощью электронных формул, в которых точками или звездочками символизируются электроны, причем спаренные электроны — это близко расположенные точки (звездочки), а неспаренные — отдельно стоящие:
![]()
-
С помощью структурных формул, в которых каждую общую электронную пару изображают черточкой между атомами; пары валентных электронов, не участвующие в образовании химической связи (неподеленные электронные пары), — черточками вблизи символов атомов, а неспаренные электроны — отдельно стоящей точкой (точками):
![]()
-
с помощью схем перекрывания АО взаимодействующих атомов, при этом АО изображают в виде клеток:
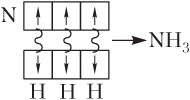
При донорно- акцепторном механизме образования ковалентной связи также формируются общие двухцентровые двухэлектронные связи. Однако в этом случае один из атомов, который называется донором, дает на образование связи готовую пару спаренных электронов, а другой атом — акцептор предоставляет для этой пары электронов вакантную орбиталь.

В качестве доноров выступают молекулы, атомы или ионы, содержащие атомы с неподеленными парами электронов:
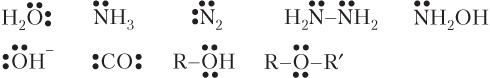
Типичными акцепторами являются: катион H+; соединения В(III) и Al (BH3, BF3, AlCl3), содержащие вакантные АО.
-
Объяснение ковалентной связи методом валентных связей (метод ВС), его основные положения. Свойства ковалентной связи (направленность, насыщаемость, полярность) Кратность связи. Типы перекрывания атомных орбиталей.
Представления о механизме образования молекулы водорода были распространены на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения:
1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
Комбинации двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем. Примеры построения валентных схем:
![]()

В валентных схемах наиболее наглядно воплощены представления Льюиса об образовании химической связи путем обобществления электронов с формированием электронной оболочки благородного газа: для водорода – из двух электронов (оболочка He), для азота – из восьми электронов (оболочка Ne).
Свойства ковалентной связи: насыщаемость, направленность и поляризуемость.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную валентность элемента. Число уже использованных для этого орбиталей определяет валентность элемента в данном соединении.
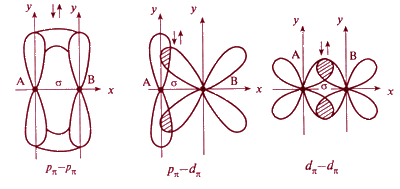
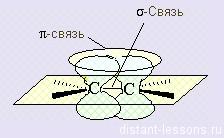
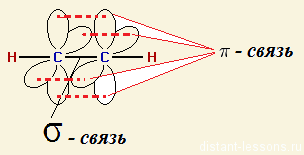
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляют s-электронные облака, поскольку их сферическая форма делает все направления равноценными. Для p- и d-электронных облаков перекрывание осуществляется вдоль оси, по которой они вытянуты, а образующаяся при этом связь называется σ-связью. σ-Связь имеет осевую симметрию, и оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов.
Поляризуемость рассматривают на основе представлений о том, что ковалентная связь может быть неполярной (чисто ковалентной) или полярной.
Кратность (порядок) связи — это число общих электронных пар, участвующих в образовании связи.
Кратная связь может быть двойной, тройной, иметь более высокую кратность и даже дробную кратность. Кратная связь состоит из одной s-связи, p-связи и иногда d-связи.
При
описании электронного строения химической
частицы электроны, в том числе и
обобществленные, относят к отдельным
атомам и их состояния описывают атомными
орбиталями. При решении уравнения
Шредингера приближенную волновую
функцию выбирают так, чтобы она давала
минимальную электронную энергию системы,
то есть наибольшее значение энергии
связи. Это условие достигается при
наибольшем перекрывании орбиталей,
принадлежащей одной связи. Таким образом,
пара электронов, связывающих два атома,
находится в области перекрывания их
атомных орбиталей.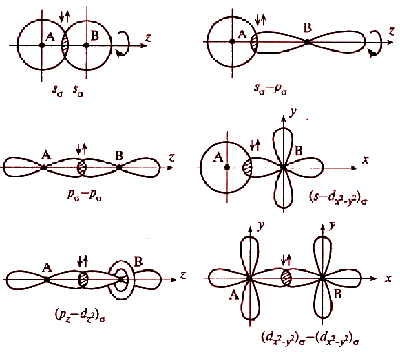
Перекрываемые орбитали должны иметь одинаковую симметрию относительно межъядерной оси.
Перекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. Между двумя атомами в химической частице возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси. Фрагменты химических частиц могут вращаться вокруг межъядерной оси без нарушения степени перекрывания атомных орбиталей, образующих σ-связи. Совокупность направленных, строго ориентированных в пространстве σ-связей создает структуру химической частицы.
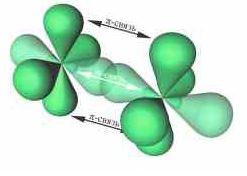
При дополнительном перекрывании атомных орбиталей, перпендикулярных линии связи, образуются π-связи.
-
Гибридизация. Основные типы гибридизации (sp,sp2,sp3,sp2d2). Изменение формы молекул при наличии у центрального атома не связывающих электронных пар, их объяснение методом отталкивания электронных пар валентной оболочки.
Гибридизация атомных орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Гибридизация атомных орбиталей происходит когда образуется ковалентная связь, и образуется она тогда, когда это энергетически более выгодно.
1 пример: смешение s- и двух p-орбиталей (2 другие остаются негибридными): Sp-гибридизация атомных орбиталей: молекула будет иметь линейную форму (180o) (у алкинов)
Примеры неорганических соединений: BeF2 (F-B-F), CO2 (O=C=O), NO2+(O=N+=O)
2 пример: смешение s- и трех p-орбиталей (одна p-орбиталь останется негибридной): Sp2-гибридизация атомных орбиталей: молекула будет иметь треугольную форму (120o) (у алкенов)
Примеры неорганических соединений: BF3, ион NO3—, ион CO32-
3 пример: смешение s- и четырех p-орбиталей: Sp3-гибридизация атомных орбиталей: молекула будет иметь тетраэдрическую форму (109,5o) (у алканов)
Примеры неорганических соединений: CH4, ион ClO4—, ион SO42-, ион NH4+
Неподеленная электронная пара занимает больший объем, чем пара электронов на орбитали, участвующей в образовании одинарной связи. Сила отталкивания электронных пар в данной валентной оболочке понижается в следующем порядке: неподеленная пара — неподеленная пара (Е — Е) > неподеленная пара — связывающая пара (Е—X) > связывающая пара — связывающая пара (X—X).
Это допущение вытекает из таких простых аргументов, как то, что неподеленная электронная пара находится в поле только одного положительного атомного остова и, следовательно, более диффузна, чем связывающая электронная пара, испытывающая сжатие полем зарядов двух атомных остовов. Отсюда следует вывод, что в серии изоэлектронных молекул (то есть содержащих равное число электронных пар в валентной оболочке) неподеленная пара, заменяя связывающую электронную пару, стремится занять больше пространства вокруг атома. Это уменьшает валентные углы между связями, например, в ряду
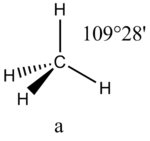
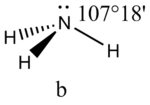
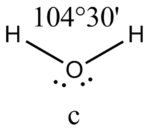
Аналогичное объяснение имеют отклонения от полностью симметричной ориентации связей в молекуле типа АХ5Е, АХ4Е, АХ3Е2. Поскольку отталкивания электронных пар типа Е — X доминируют по сравнению с отталкиваниями X—X, валентные углы ХАХ несколько сжаты: :
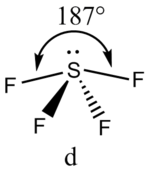
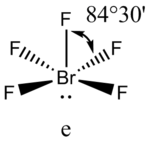
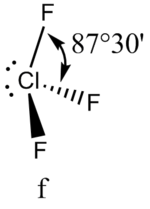
В прямой связи с данными об эффективных объемах связывающих и неподеленных электронных пар находится такое важное следствие, как положение о том, что в молекулах типа АХ4Е, АХ3Е2, АХ2Е3, геометрическая форма которых производится от структуры тригональной бипирамиды, электронные пары всегда занимают экваториальные положения (см. Таблица 2-3)
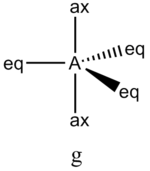
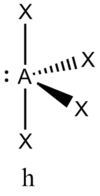
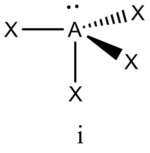
Это объясняется тем, что в структуре h имеются только два невыгодных Е—Х-взаимодействия электронных пар, когда их оси составляют угол 90°. В структуре i (топомерной h) таких невыгодных взаимодействий три.
