
3 курс / 2 семестр / Методы изучения экологии животных и растений / metody_polev_ekol_issl_2014
.pdfПо полученным данным можно также определить избирательность питания. Для большинства видов рыб характерно предпочтение каких либо определенных кормовых объектов. А.А Шорыгиным была предложена следующая формула определения индекса избирания пищи:
Ii=ri/Pi ,
где ri – процентное содержание организма в пище, Pi – процент того же организма в природном сообществе. Последний показатель определяется на основе изучения проб, взятых со дна дночерпателем, из толщи воды планктонной сетью или тралом.
Изучение наполнения кишечника, которое может говорить об интенсивности питания вида в определенное время суток, сезона года и пр. Можно определять вес пищевого комка, либо, при отсутствии технической возможности, визуально определить степень наполнения кишечника по пятибалльной шкале: 0 – пусто, 1 – единичные экземпляры, 2 – малое наполнение, 3 – среднее наполнение, 4 – много пищи (пищеварительный тракт полный), 5 – пищеварительный тракт полный и сильно растянут. В данном случае очень выражена субъективная сторона, поэтому при сравнении результатов наиболее точны они будут, если все измерения и наблюдения будут сделаны одним автором.
При измерении массы пищевого комка можно высчитать индекс наполнения кишечника (Iн). Он определяется как отношение массы пищевого комка к общему весу рыбы (общий индекс наполнения) или отношение массы одного или группы компонентов к общему весу рыбы (частный индекс наполнения). Учитывая малую величину индексов наполнения, их принято увеличивать в 10000 раз и выражать в продецимиллях (0/000).
Еще одной важной характеристикой питания рыб является их рацион – количество пищи, съеденной за определенный промежуток времени. Так, самый доступный способ измерения суточного рациона основан на индексах наполнения кишечника и определяется по формуле:
D=A24/n,
где D – суточное потребление пищи, в %;
A – средний в течение суток индекс наполнения пищеварительного тракта, в %;
n – скорость переваривания пищи (полный пищевой комок за определенное число часов).
Скорость переваривания пищи определяют экспериментально.
8.5. Изучение плодовитости и зрелости
Плодовитость – число нормально развитых икринок, выметываемых самками, а в случае живорождения – число эмбрионов (личинок, мальков), выметываемых самкой.
Различают индивидуальную абсолютную и индивидуальную относитель-
ную плодовитости. Индивидуальная абсолютная плодовитость – общее число
180
икринок, выметываемое одной самкой за сезон. Индивидуальная относительная плодовитость – отношение числа зрелых икринок, выметываемых одной самкой за один нерестовый сезон к общей массе самки (в граммах). Ряд исследователей берет массу самки без внутренностей, ряд – со внутренностями. При сравнении с литературными данными это необходимо учитывать.
Если массу гонад определить с помощью весов не составляет труда, то количество икринок определяют весовым методом. Для этого необходимо определить массу одной икринки. Берут несколько икринок (например, 10 шт.), взвешивают их, после чего полученный результат делят на 10. Затем, чтобы узнать количество икринок, массу зрелой икры делят на полученную массу одной икринки.
При определении плодовитости у порционно нерестующих рыб (напр., густеры) следует различать плодовитость по каждому отдельному вымету, плодовитость по остаточной икре и общую, индивидуальную плодовитость. Последняя может быть определена до начала первого нереста по сумме всех икринок, включая крупные и все мелкие икринки; у особей последующих нерестов, т.е. второго, третьего и т. д. выметов, можно определить лишь остаточную плодовитость по учету крупной и мелкой остаточной икры».
Для оценки состояния гонад используют коэффициент зрелости. Коэффициент зрелости представляет собой отношение массы гонад к массе тела рыбы
(в %).
Существуем множество методик определения стадии зрелости рыб, которые разработаны для определенных групп видов. Однако, в большинстве случаев используют универсальную, предложенную Г.В. Никольским (1974). Определение степени зрелости половых продуктов у рыб проводят по наиболее распространенной для полицикличных рыб (с многократным в течение жизни нерестом) с единовременным икрометанием.
Стадия I. Неполовозрелые особи. Половые железы неразвиты, имеют вид тонких прозрачных тяжей, прилегающих к внутренней стороне стенок тела (по бокам и ниже плавательного пузыря), и представлены длинными узкими шнурами или лентами, по которым нельзя глазом определить пол.
Стадия II. Созревающие особи или особи с развивающимися половыми продуктами после икрометания. На шнурах образуются затемненные утолщения, в которых уже узнаются яичники и семенники. Яичники полупрозрачны. Икринки настолько мелки, что заметны лишь в лупу. Яичники от семенников отличаются тем, что у первых вдоль стороны, обращенной к середине тела, проходит довольно толстый и сразу бросающийся в глаза кровеносный сосуд. На семенниках таких крупных сосудов нет. Они имеют вид более плоских тяжей сероватого или бело-розового цвета. Половые железы малы и далеко не заполняют полости тела.
Стадия III. Созревающие рыбы. Половые железы далеки от зрелости, но сравнительно хорошо развиты. Яичники значительно увеличены в размерах, заполняют от 1/3 до 1/2 всей брюшной полости и содержат мелкие непрозрачные, белесоватые икринки, ясно различимые невооруженным глазом. Если разрезать
181
яичник и поскоблить концом ножниц по обнаженным икринкам, то они с трудом отрываются от стромы (внутренних перегородок) яичника и всегда образуют комки из нескольких штук. Семенники плотные, упругие, розоватого или желтовато-белого цвета, имеют более расширенную переднюю часть, постепенно суживающуюся кзади. При поперечном разрезе семенника края его не оплывают и остаются острыми. При надавливании из семенников нельзя выделить жидкие молоки. В этой стадии рыба находится долго – 8–10 месяцев.
Стадия IV. Зрелые особи. Половые органы достигли или почти достигли максимального развития. Яичники очень велики и заполняют до 2/3 всей брюшной полости. Икринки крупные, прозрачные, легко отделяются от стромы яичника. Цвет яичников у разных видов рыб неодинаков. Обычно он желтоватый, а у осетровых – серый или черный. Семенники белого цвета и наполнены жидкими молоками, которые легко вытекают при надавливании брюшка. При поперечном разрезе семенника его края тотчас округляются, и разрез заливается жидким содержимым. Эта стадия у некоторых рыб непродолжительна и быстро переходит в следующую.
Стадия V. Текучие особи. Икра и молоки свободно вытекают струей из полового отверстия при самом легком надавливании. Если держать рыбу в вертикальном положении за голову и потряхивать ее, то икра и молоки перемещаются в заднюю часть брюшной полости и самостоятельно вытекают.
Стадия VI. Отнерестившиеся особи, выбой. Половые продукты выметаны. Яичники и семенники малы, дряблы, воспалены, темно-красного цвета из-за переполнения их кровью. Нередко в яичнике остается небольшое количество мелких икринок, которые претерпевают жировое перерождение и рассасываются (резорбируют). Через несколько дней воспаление проходит, рассасываются пустые фолликулы и половые продукты переходят во II стадию зрелости,
унекоторых рыб – в III.
Уединовременно нерестующих рыб половые железы вскоре после нереста переходят во II стадию. Таким образом, I стадия зрелости наблюдается у рыб один раз в жизни – при первом половом созревании. Если половые продукты находятся на промежуточной стадии между какими-либо двумя из шести описанных стадий или часть продуктов развита больше, чем другая, стадия зрелости обозначается двумя цифрами через тире, но при этом та стадия, к которой ближе стоят по своему развитию гонады, ставится впереди. Например, степень зрелости II–III свидетельствует о том, что половые продукты находятся преимущественно во второй степени зрелости, но уже имеются элементы III стадии развития.
Урыб с порционным икрометанием стадия зрелости определяется состоянием той порции, которая наиболее развита и раньше других будет выметана.
8.6. Ихтиологический мониторинг
Ихтиологический мониторинг представляет собой долговременные наблюдения за состоянием фауны, а также за определенными биологическими
182
особенностями рыб. Полученные данные должны иметь определенную периодичность и одинаковую методику сбора.
При отловах для мониторинга необходимо пользоваться одними и теми же орудиями отлова. Методики должны выбираться таким образом, чтобы захватить по возможности всю фауну рыб, они не должны иметь избирательности. Именно поэтому желательно пользоваться одинаковым комплектом ставных сетей, одинаковыми бреднями, неводами, тралами. Отловы должны повторяться через определенной время. Например, каждую весну в половодье. Полученные таким образом данные будут объективно отражать картину, происходящую в водоеме на протяжении времени. Например, можно определить колебания численности определенных видов, плодовитости, размер или массу тела рыбы каждого возраста и пр.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Вышегородцев А.А., Скопцова Г.Н., Чупров С.М., Зуев И.В. Практикум по ихтиологии. Красноярск, 2002. 127 с.
Дгебуадзе Ю.Ю. Экологические закономерности изменчивости роста рыб. М.: Наука, 2001. 276 с.
Дгебуадзе Ю.Ю., Чернова О.Ф. Чешуя костистых рыб как диагностическая и регистрирующая структура. М.: Т-во научных изданий КМК. 2009. 315 с.
Дрягин П.А. Половые циклы и нерест рыб // Изв. ВНИИОРХ. 1949. Т. 28. С. 3-113. Зиновьев Е.А., Мандрица С.А. Методы исследования пресноводных рыб: учебное по-
собие по спецкурсу / Пермский ун-т. Пермь, 2003. 113 с.
Иванова Т.С., Лайус Д.Л. Роль ошибок измерения в анализе морфологических признаков, традиционно используемых в ихтиологии // IX научная сессия МБС СПбГУ. Тезисы докладов. СПб., 2008. С. 22-24.
Моисеев П.А., Азизова Н.А., Куранова И.И. Ихтиология. М.: Легкая и пищевая пром-
сть, 1981. 384 с.
Никольский Г.В. Экология рыб. М.: Высшая школа, 1974. 367 с.
Правдин И.Ф. Руководство по изучению рыб. 4-е изд. М.: Пищевая промышленность, 1966. 376 с.
183
ГЛАВА 9. МЕТОДЫ ИССЛЕДОВАНИЙ АМФИБИЙ И РЕПТИЛИЙ
9.1.Наблюдения в природе
Входе наблюдений оказывается наименьшее воздействие на популяцию животных, т.к. при этом особи не изымаются из естественных условий. Этот метод позволяет установить видовую принадлежность животных, исследовать суточную и сезонную активность, площадь индивидуальных участков и другие особенности экологии.
Определение видовой принадлежности исследуемых животных не вызывает особых трудностей как вследствие невысокого видового разнообразия наших земноводных и пресмыкающихся, так и в связи с их меньшей осторожностью по сравнению с птицами и млекопитающими. При наличии бинокля визуальный осмотр достаточен для точного определения вида. Для идентификации видов амфибий и рептилий пользуются различными определителями, список которых дается в конце данной главы.
Определение видов бесхвостых амфибий в период размножения возможно и по голосам. Однако здесь необходимо предварительно прослушать записи голосов амфибий. Эта работа нетрудоемкая и в полевых условиях дает всегда хорошие результаты. Голоса животных несут большую информацию о состоянии популяции, ее суточной активности, контактах между членами популяции (особенно полами), предупреждают членов популяции об опасности и т.д. На основании особенностей голоса можно установить степень родства между видами, физиологическое состояние животных и многое другое. Путем подсчета голосов за единицу времени изучают суточную активность бесхвостых амфибий в зависимости от погодно-климатических условий. При этом регистрируют все голоса изучаемого вида (или видов) в течение суток и отмечают пики их наибольшей активности. Желательно для записи голосов в природе использовать соответствующую аппаратуру. Изучение звуковых сигналов позволяет проводить даже количественный учет земноводных (см. ниже).
При проведении фенологических наблюдений важно знать особенности микроклимата в разных частях исследуемой территории, связанные с экспозицией склонов, затененностью, доступностью ветрам и т.д. Фенология – это изучение закономерностей сезонных явлений в жизни природы. Как правило, фенологические наблюдения – это визуальные наблюдения за животными на постоянных маршрутах, сопряженные с обязательной фиксацией метеоусловий. Однако наиболее полный и точный материал может быть получен при использовании ловчих приспособлений. Регистрируются все основные явления в жизни амфибий и рептилий.
184
9.2. Фиксаторы
Перед фиксацией большую часть добытых животных необходимо умерщвлять. Наиболее гуманный и быстрый способ – усыпление в парах эфира. Хранить эфир необходимо в плотно закрывающихся емкостях. Для усыпления применяются закрывающаяся стеклянная посуда или полиэтиленовые мешки, куда животных можно помещать прямо в холщевых мешочках, которые применяются для временного хранения живых особей.
Фиксация земноводных для научного исследования – это обычно двухэтапный процесс. Сначала экземпляры фиксируют в подходящем фиксаторе, затем их переносят в раствор спирта для хранения. Самый обычный фиксатор для земноводных – формальдегид. При комнатной температуре формальдегид является газом; под давлением он полимеризуется в твердое вещество, называемое параформальдегидом. Лучше использовать водный раствор формальдегида. Как гистологический фиксатор он применяется уже около 100 лет. Формальдегид продается в виде жидкости (37% или 40%-ный раствор), которая готовится путем растворения газообразного формальдегида в воде. Раствор формальдегида этой концентрации эквивалентен 100%-ному формалину. Одна часть этого концентрированного формалина разводится в 9 частях воды для приготовления 10%-ного формалина.
10%-ный раствор – это стандартный фиксатор материала в поле. Фиксированный экземпляр сохраняет то положение, в котором он был помещен в формалин. Стабилизация обусловлена образованием поперечных связей формалина с концевыми группами белков в тканях. Этот процесс останавливает автолиз и предотвращает дальнейшее разложение ткани. Скорость фиксации варьирует в зависимости от размера экземпляра и природы тканей: более мелкие животные фиксируются несколько часов; более крупные экземпляры требуют гораздо больше времени.
Формальдегид – ядовитое вещество, он раздражает глаза, верхние дыхательные пути и кожу. У некоторых людей развивается аллергическая реакция на формалин, и они должны надевать резиновые перчатки, чтобы предотвратить язвы на коже. Формальдегид является потенциальным канцерогеном. Таким образом, его надо использовать только в хорошо вентилируемых помещениях.
Если нельзя достать формалин, в качестве фиксатора можно использовать 70%-ный этиловый спирт. Другие виды спиртов (например, метиловый, изопропиловый) не рекомендуются. Такие фиксаторы, как смесь формалина, уксуса и спирта, глютаральдегид или раствор Буэна (особенно хороший для гистологической работы) готовить труднее, но их также можно использовать. Растворы формалина можно готовить также из параформальдегида.
Самый простой и доступный фиксатор – насыщенный раствор поваренной соли: его обычно используют тогда, когда отсутствуют другие консервирующие жидкости. При этом надо на 1 л воды взять 360 г поваренной соли,
185
раствор слегка подогреть, охладить и профильтровать. Затем к нему добавить 10 г карболовой или салициловой кислоты. Лучше после возвращения из экспедиции животных переложить в другие фиксирующие жидкости.
9.3. Отбор и хранение материала
Обычно сбор земноводных и пресмыкающихся не составляет большого труда. Для этих целей используют 3 основных способа: 1) сбор вручную (например, на суше или в водоеме); 2) отлов с помощью сачков; 3) использование ловчих приспособлений (канавок, траншей, заборчиков или ямок).
Водных амфибий добывают сачком или мелкоячеистыми бреднями. Сачок не отличается по устройству от обычного водного сачка, который используется для гидробиологических экскурсий. Однако он должен иметь более прочный металлический обод и крепкую сетку для мешка. Подобное «укрепление» сачка делается по одной причине: при захвате животного очень часто попутно попадают водные растения, растительные остатки, ил, которые увеличивают массу и повышают вероятность поломки орудия лова. Длина ручки сачка произвольна и зависит от условий водоема, в котором производится отлов.
Весной и в начале лета отлов водных амфибий можно производить как днем, так и ночью. Неоднократно нами отлавливались озерные и прудовые лягушки с помощью сачка и фонарика. Пучок света направляется непосредственно на животное, а сачок подводится таким образом, чтобы он не пересекал световой луч. Некоторые исследователи утверждают, что ночной лов, в особенности с лодки, очень продуктивен и позволяет добыть даже такие экземпляры, которые недоступны в дневное время. Не рекомендуется добывать крупных водных лягушек с помощью оглушения прутом или лова на удочку, поскольку при этом животные могут получить серьезные травмы.
Ночных земноводных, к примеру, жаб, тритонов, чесночниц, днем можно обнаружить под валежником, кучами мусора, брошенными кусками шифера, картоном, пнями, камнями. Для сбора земноводных и некоторых видов рептилий (например, живородящей ящерицы) также можно специально использовать ловчие ямки или канавки (см. ниже). Записи на этикетке удобнее вести простым карандашом, поскольку чернила размываются в фиксирующих жидкостях. Пробы из одного места можно поместить в марлевый мешочек, который укладывается в общую емкость. Предварительно необходимо сделать этикетку и специальную запись в полевой дневник.
Ловчие канавки (или траншеи) должны иметь ширину 20–25 см и глубину 40–50 см (рис. 9.1). Это необходимо, чтобы животные не могли выбраться из канавок обратно. Можно использовать и менее глубокие траншеи (20–25 см), но в этом случае необходимо вкапывать в них цилиндры (из расчета один цилиндр на каждые 10–15 м траншеи) так, чтобы верхний край цилиндра был вровень с дном траншеи. Диаметр цилиндра должен соответствовать ширине ка-
186
навки. Длина траншеи произвольна и зависит от характера местности и цели работы. Стенки канавки должны быть строго вертикальны, аккуратно приглажены и уплотнены лопатой, чтобы животные не могли выбраться наружу, используя неровности почвы. В процессе проведения работ траншеи должны по мере необходимости очищаться от мусора, а их стенки и дно – подправляться. Отлов с помощью ямок был предложен Е.С. Птушенко. Ловчие ямки следует рыть размером 30×30 см и глубиной 20–30 см. Размещать их следует в шахматном порядке в 2, 3, 4 ряда на расстоянии одна от другой в 50, 100 и 200 м (в зависимости от обследуемой территории).
Недостаток траншей – трудоемкость их подготовки и невозможность использования на каменистой и болотистой почвах, на «сильно пересеченной местности». В этих условиях можно применить вариант ловчей канавки – ловчий заборчик. Он изготовляется из фанеры, листового железа, рубероида, линолеума, плотной полиэтиленовой пленки или другого подручного материала. Высота заборчика – 30–50 см. Он закрепляется в субстрате с помощью колышков или штырей. Важно устранить зазор между нижним краем заборчика и субстратом – для этого достаточно присыпать почвой нижний край заборчика. Вплотную к нему с обеих сторон или только с одной (в зависимости от того, откуда ожидается «ход» амфибий) вкапываются ловчие цилиндры высотой 30– 40 см. Расстояние между соседними цилиндрами – 5–10 метров.
Важное условие – регулярный осмотр канавок и ямок, который следует проводить утром. При этом необходимо внимательно осмотреть дно и проверить, не закопались ли животные в землю или не спрятались ли они под упавшую листву. Параллельно с осмотром делают «уборку» траншеи, вытаскивая других животных (обычно это мелкие млекопитающие, насекомые) и различный мусор (ветки, листву и т.п.). При помощи ловчих траншей добываются не только массовые виды, но и редко встречающиеся. В случае канавок можно не использовать фиксирующие жидкости в ловчих цилиндрах, а учитывать животных раз в сутки и отпускать их, предварительно пометив.
Для отлова амфибий и некоторых рептилий можно также использовать модифицированные почвенные ловушки, которыми пользуются для сбора насекомых. Они представляют собой вкопанные вровень с землей банки различного объема. Удобно пользоваться пластиковыми стаканами объемом 0,5 л. В каждом биотопе (а их может быть несколько) устанавливается по 20–30 ловушек, в линию через каждые 10 м. В стаканы обязательно заливается 2%-ный раствор формалина, который в данном случае необходим для сохранности материала, т.к. его выборка проводится раз в две недели. Все названные ловчие приспособления могут быть использованы в достаточно труднодоступных и малопосещаемых местах, чтобы избежать травматизма людей и домашних животных.
По окончании работы необходимо снять заборчики и цилиндры, засыпать землей канавки и ямки. Если работа в данном месте будет продолжаться и в последующие годы (т.е. будет проводиться ежегодный мониторинг численности животных выбранного биотопа), то канавки следует надежно прикрыть сверху.
187
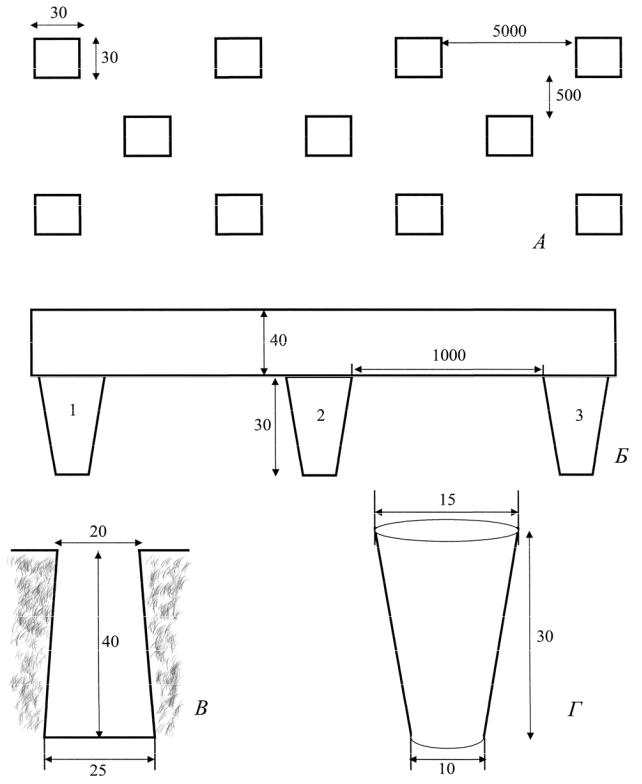
Рисунок 9.1. Ловчие приспособления. А – схема установки ловчих ямок (вид сверху); Б – схема ловчей канавки (продольный разрез); В – схема ловчей канавки (поперечный разрез); Г – ловчий цилиндр. 1–3 – ловчие цилиндры. Размеры в сантиметрах.
Рептилии, в отличие от земноводных, прекрасно видят подвижные объекты, обладают быстрой реакцией и высокой скоростью. Пресмыкающихся ловить значительно труднее, чем земноводных, поскольку они ведут более скрытный образ жизни и многие очень подвижны. Водных черепах (например, бо-
188
лотных черепах) добывают, когда они выползают на сушу, а чаще сачками или мелкими рыболовными сетями в воде. Зная местообитание болотной черепахи, можно отлавливать ее на приманку (кусок мяса), прикрепляемую к небольшому колышку, который, в свою очередь, устанавливается на берегу. За приманкой следует вести постоянное наблюдение.
Ящериц можно ловить руками или капроновой петлей, прикрепленной к палке. Петлю подводят к голове ящерицы и резким движением затягивают вокруг шеи. При этом следят, чтобы тень ловца не падала на животное, иначе оно быстро спрячется. Неядовитых и не кусающихся змей (ужей, медянок), как и других пресмыкающихся, можно поймать руками, в случае необходимости предварительно прижав к земле палкой (удобны в этом отношении палки с развилкой или с широким расщепом на конце). Добывание ядовитых змей требует специальных мер предосторожности. Обычно ядовитых змей отлавливают специальными палками с крючками. При отлове змей главное правило таково: если не знаешь змею, то любую из них следует принимать за ядовитую и вести себя соответствующим образом.
В случае укуса змеи (у нас ядовита только обыкновенная гадюка), после оказания пострадавшему первой помощи, необходимо немедленно обратиться к врачу. Следует осторожно обращаться даже с мертвыми ядовитыми змеями, т.к. их яд очень стоек, и известны случаи отравления при уколе о ядовитые зубы коллекционных экземпляров. Нужно также помнить, что яд действует тем сильнее, чем жарче погода. Во избежание укуса целесообразно не брать живых змей голыми руками, а лучше вначале захватить в расщеп палки (или придавить голову крючком). В этом случае важно, чтобы осталась неповрежденной голова, иначе экземпляр теряет научную ценность.
Количество отлавливаемых животных всегда должно отвечать определенным задачам исследователя; нельзя изымать из популяций много особей. Если отлов проводится с целью выяснения видового состава данного местообитания или пополнения коллекционного фонда, то ограничиваются 2–5 экземплярами, а для других целей (изучения изменчивости, возрастного и полового составов, характера питания и т.п.) достаточно 25–30 особей.
Хранение животных для последующего анализа осуществляется в стеклянных банках разного размера (под размеры животного). Лучше всего хранить материал отдельно по каждому виду из одной выборки. Обязательное условие – этикетирование пробы. На этикетке (плотной бумаге, кальке) записываются все параметры пробы: дата, место (регион, район, ближайшее селение), координаты (если под рукой имеется GPS-навигатор), ФИО добытчика (коллектора). При длительном хранении проб желательно ведение специальных журналов, куда заносятся под специальными обозначениями все параметры сборов.
9.4. Методы количественного учета
Современные экологические исследования невозможны без количественных учетов, позволяющих получить данные об абсолютной и относительной численности популяций амфибий и рептилий, их территориальной, возрастной
189
