
3 курс / 2 семестр / Методы изучения экологии животных и растений / metody_polev_ekol_issl_2014
.pdf
Рисунок 5.1. Схема основных промеров раковины: БД – большой диаметр (ширина раковины); МД – малый диаметр; ВР – высота раковины; ВПО – высота последнего оборота; ВУ – высота устья; ШУ – ширина устья (по: Шилейко, 1984).
Размеры, указанные в описаниях или определительных таблицах, соответствуют половозрелой стадии с определенным количеством оборотов. Если высота раковины не превышает или не очень превышает ее ширину, число оборотов считают, глядя сверху, в противном случае – при прямом положении раковины.
Для измерения под бинокуляром раковину желательно закрепить в прямом положении. У слизней измеряют длину тела во время движения и в сокращенном состоянии после внешнего раздражения. Измерять длину слизней лучше с помощью линейки.
Увеличения ручной лупы в большинстве случаев недостаточно для правильного определения моллюсков, особенно если это определение проводит начинающий. Поверхностную скульптуру (даже для больших раковин!), устьевую арматуру и другие конхиологические признаки, а также морфологические признаки слизней необходимо рассматривать под бинокуляром. Для определения моллюсков часто измеряют также максимальную ширину пупка, иногда – высоту завитка. Часто для определения важны не абсолютные, а относительные размеры некоторых частей раковины: пупка, завитка, последнего оборота и пр. Например, под «высоким завитком» понимают не абсолютную высоту завитка, а его отношение к общей высоте раковины.
Вскрытие моллюсков также проводят под бинокуляром. Тело улиток следует сначала отделить от раковины, осторожно держа пинцетом за ногу. Если это затруднительно, раковину можно разломить на части. Улиток вскрывают с правой стороны (кроме видов с левозакрученной раковиной), слизней – с левой (рис. 5.2). Для вскрытия крупных экземпляров удобно пользоваться маленькими ножницами и глазным скальпелем, а мелких – достаточно остро заточенной
120
иглы, которой можно оттянуть вверх и разорвать ткани (пениальный чехол, стенку пениса и пр.).
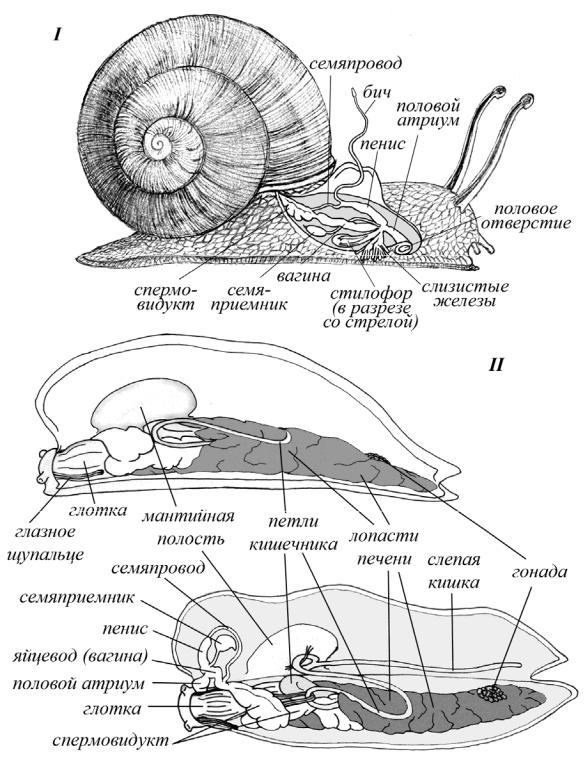
Далее опишем лишь частичное вскрытие, достаточное для ознакомления со строением дистальных отделов половой системы, необходимых для определения вида. ). Вскрытие улитки начинают с разреза над половым отверстием, который продолжают в направлении мантийного валика (рис. 5.2), рассекают последний и делают разрез немного выше. Затем препаровальными иглами отворачивают стенки тела и рассматривают строение дистальных отделов половой системы. Начинать вскрытие слизней удобнее, держа в руках (в отличие от улиток). Оттянув кожу, разрезают или разрывают ее иглой вначале вдоль тела над подошвою (рис. 5.2), затем за щупальцами и у задней части тела. Для осмотра только дистальных отделов половой системы задний разрез можно не делать. Стенку тела аккуратно отворачивают. С правой стороны, приблизительно на уровне передней части мантии, находят дистальные отделы половой системы. Отдельные органы могут быть покрыты пленками, которые следует аккуратно удалить. Полное вскрытие слизней с изучением всех систем органов детально описано в работе И.М. Лихарева и А.И. Виктора (1980Вскрытие улитки начинают с разреза над половым отверстием, который продолжают в направлении мантийного валика (рис. 5.2), рассекают последний и делают разрез немного выше. Затем препаровальными иглами отворачивают стенки тела и рассматривают строение дистальных отделов половой системы.
Очень полезной для малакологических исследований является рабочая сравнительная коллекция раковин. Объекты в ней могут располагаться в систематическом порядке (по семействам и родам). Иногда собирают раковины отдельных видов на разных стадиях развития. Для таксонов с высокой внутривидовой изменчивостью (например, Chondrula tridens) желательно иметь коллекционные материалы с максимально возможной морфологической репрезентативностью (формы, размеров, окраски, степенью развития поверхностной скульптуры или устьевой арматуры) из разных популяций и разместить их в отдельной коробке. Наземных моллюсков можно идентифицировать с использованием ряда известных определителей (Лихарев, Раммельмейер, 1952; Малевич, Старобогатов, 1958; Шилейко, 1978, 1982; Лихарев, 1984; Шилейко, 1984; Шилейко, Лихарев, 1986; Стойко, Булавкина, 2010; Сверлова, Гураль, 2012)
Примечание. Работая с большим объемом почвенных проб, когда выделить всех живых моллюсков затруднительно, на наш взгляд, допустим учет всей совокупности раковин (включая некроценоз). При таком подходе складывается адекватное представление о полном составе населения локального местообитания и отражается полный потенциальный состав сообщества, т.е. общее разнообразие (Бобров, 2003). Эффективность в привлечении «пассивной» части ценоза заключается еще и в том, что можно избежать многочисленных трудоемких сезонных учетов для выявления редких малочисленных видов и получить целостное представление о видовом составе на основе разового отбора проб (Рахлеева, Корганова, 2005). В то же время, есть мнение (Сверлова, Гураль, 2012), что более простой в методическом отношении подсчет пустых ра-
121
ковин вместе с живыми моллюсками может привести не только к завышению реальной плотности популяций, но и к неправильному отображению структуры сообществ. В любом случае, если задача – сравнение сообществ между собой, методика учета должна быть одинаковой (если в одной пробе учитывался некроценоз, то и в сравниваемой также).
Рисунок 5.2. Схема вскрытия и улитки (I) и слизня (II) (рис. Безиной О.В.).
122
Напоминаем о необходимости бережного отношения к природным объектам. Если того не требует цель исследования, лучше собрать и определить пустые раковины.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Бобров А.А. Историческая динамика озерно-болотных экосистем и сукцессии раковинных амеб (Testacea) // Зоол. журн. 2003. Т. 82. № 2. С. 215-223.
Лихарев И.М., Виктор А.Й. Слизни фауны СССР и сопредельных стран (Gastropoda terrestria nuda). Л.: Наука, 1980. 438 с. (Фауна СССР. Моллюски. Т. III. Вып. 5).
Лихарев И.М., Раммельмейер Е.С. Наземные моллюски фауны СССР. М.-Л.: Изд. АН
СССР, 1952. 511 с.
Лихарев И.М. Клаузилииды (Clausiliidae) Л.: Наука, 1984. 317 с. (Фауна СССР. Т. 3. Вып.
4).
Малевич И.Н., Старобогатов Я.И., Наземные моллюски Подмосковья как объект самостоятельных работ студентов на летней практике и в зоологическом кружке // Ученый записки Московского городского педагогического института им. В.П. Потемкина. 1958. Т. LXXXIV. С. 269-316.
Рахлеева А.А., Корганова Г.А. К вопросу об оценке численности и видового разнообразия раковинных амеб (Rhizopoda, Testacea) в таежных почвах // Зоол. журн. 2005. Т. 84. № 12. С. 1427-1436.
Сверлова Н.В., Гураль Р.I. Визначник наземних молюскiв Украïни. Львiв: Державный природознавчий музей НАН Украïни, 2012. 215 с.
Стойко Т.Г., Булавкина О.В. Определитель наземных моллюсков лесостепи Правобережного Поволжья. М.: Товарищество научных изданий КМК, 2010. 96 с.
Шиков Е.В. О расселении наземных моллюсков во время половодий // Зоол. журнал. 1977. Т. 56. № 3. С. 361-367.
Шилейко А.А. Наземные моллюски надсемейства Helicoidea. Л.: Наука, 1978. 384 с. (Фауна СССР. Т. 3. Вып. 6).
Шилейко А.А. Наземные моллюски (Mollusca, Gastropoda) Московской области // Почвенные беспозвоночные Московской области. М.: Наука, 1982. С. 144-169.
Шилейко А.А. Наземные моллюски подотряда Pupillina фауны СССР (Gastropoda, Pulmonata, Geophila). Л.: Наука, 1984. 399 с. (Фауна СССР. Т. 3. Вып. 3).
Шилейко А.А., Лихарев И.М. Наземные моллюски семейства янтарок (Succineidae) фауны СССР // Фауна, систематика и филогения беспозвоночных животных. Исследования по фауне Советского Союза. М.: МГУ, 1986. С. 197-239.
123

ГЛАВА 6. МЕТОДЫ ГИДРОБИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
6.1.Изучение пресноводной альгофлоры
6.1.1.Выбор станций и трансект (разрезов)
Вполне естественно, что обследовать всю водную массу сколько-нибудь
значительного водоема совершенно невозможно. Количество точек для взятия проб и их расположение по акватории, а также частота сборов во времени должны определяться каждый раз в соответствии с целью и задачами комплексного гидробиологического исследования.
1.При первом, общем знакомстве с водоемом необходимо брать максимально возможное число точек, приуроченных к биотопам, имеющим
наибольший удельный вес в водоеме (что определяется по батиметрической карте1). При определении числа точек взятия проб следует учитывать, что фитопланктон пелагиали гораздо более однороден, чем в литорали. В условиях прудов и крупных водохранилищ битопы выделяются с учетом скоростей течения (влияние подпора) и удельного веса зон (речной, переходной, озеровидной), а также изменчивости границ последних во времени (зоны выклинивания подпора смещаются вверх или вниз по течению в зависимости от степени наполнения котловины водохранилища). В соответствии с этим постоянные точки берутся в тех районах, которые при любых условиях входят в одну из трех указанных зон. Точки взятия проб, приуроченные к биотопу с переходным режимом от одной зоны к другой (экотон), не должны фиксироваться пространственно, а выбираются в соответствии с перемещением границ характеризуемого ими биотопа.
2.При продолжающихся многолетних исследованиях с целью оценки состояния кормовой базы водоема (обычно на крупных озерах, рыбоводных прудах и водохранилищах) устанавливаются стационарные станции или разрезы в наиболее характерных и значимых биотопах. Пробы берутся в фиксированные даты не реже трех раз в летний период и одного раза в остальные сезоны.
3.При исследовании влияния того или иного динамического фактора на водоем в целом или какую-то его часть устанавливается минимальное количество стационарных станций, пробы берутся предельно часто:
а) в случае изучения влияния сброса сточных теплых вод на фитопланктон достаточно установить три-четыре станции по их течению (для определения зоны распространения сбросных вод) и одну контрольную станцию в зоне, не подверженной влиянию теплых вод. Последняя должна быть расположена в биотопе, характеризующемся условиями, подобными исходному состоянию зоны сброса теплых вод. Частота взятия проб определяется изменением естественного и искусственного температурного режима;
1 Батиметрические карты – географические карты, отображающие подводный рельеф при помощи изобат, обычно дополняемых отметками глубин. Изобаты – линии, соединяющие равные глубины. Для построения батиметрических карт используется эхолот.
124

б) в случае исследования воздействия ядохимикатов или биогенов устанавливаются две-три станции (одна – в пелагиали и одна-две – в литорали). Берется исходная проба до начала воздействия и через 1, 3, 6, 12 и 24 суток после него. Параллельно желательно брать пробы в те же сроки в контрольном водоеме.
Кроме того, выбор станций отбора проб зависит от морфометрии водоема и преследует цель возможно полнее охватить экологически разнородные участки.
При работе на озерах, водохранилищах и водоемах с похожими экологическими условиями необходимо исследовать впадающие реки и устья наиболее крупных ручьев, основные заливы. На остальной акватории, если она невелика, достаточно наметить 5–7 станций, расположенных равномерно. При любых исследованиях должна облавливаться вся толща воды. Точки взятия проб фитопланктона по вертикали выбирают в соответствии с характеристиками физических факторов, оказывающих влияние на жизнедеятельность водорослей (свет, температура, прозрачность воды). Количество точек взятия проб по глубинам (h), необходимое для учета фитопланктона в слоях, которые могут считаться для него биологическими нишами, в большинстве водоемов (за исключением очень глубоких) может быть ограничено шестью: 1) поверхность – зона максимальной освещенности и прогрева воды и в тоже время наиболее подверженная ветровому воздействия; 2) горизонт, располагающийся на половине глубины прозрачности, – близок по характеристикам к первому, но с более «мягкими» по всем факторам условиями; 3) горизонт на глубине прозрачности – практически совпадает с серединой трофогенного слоя2; 4) горизонт, соответствующий удвоенной глубине прозрачности, – обычно совпадает с границей трофогенной зоны (здесь располагается компенсационная точка, а при установлении летней стратификации – термоклин); 5) горизонт, соответствующий середине трофолитической зоны3, определяется как середина расстояния от дна до удвоенной глубины прозрачности; 6) придонный горизонт – 0,3–0,5 м от дна (проба берется осторожно, чтобы не взмутить ил). При изучении особенностей вертикального распределения фитопланктона пробы с каждого горизонта помещают в отдельную емкость.
Если целью исследования не является определение закономерностей вертикального распределения отдельных видов фитопланктона или его продукционных характеристик, то на каждой станции отбирают батометром серию проб с пропуском по глубине в 1 м до глубины утроенной прозрачности, измеренной по белому диску. Все отобранные на станции пробы сливают в один сосуд (чистое эмалированное ведро), тщательно перемешивают и в зависимости от степени развития фитопланктона заполняют пол-литровые или литровые бутыли и консервируют.
2Трофогенный слой (эпилимнион) – верхний прогреваемый слой воды, в котором происходит продукция органического вещества первичными продуцентами – водорослями и высшими растениями.
3Трофолитическая зона (гиполимнион) – нижний слой водоема, в котором преобладают процессы разложения органики.
125
При обследовании реки, особенно в месте впадения крупных притоков, необходимо закладывать поперечные трансекты, уменьшая число станций на них по мере смешивания двух водных масс – основной и впадающей рек. При закладывании трансекты вдоль реки необходимо учитывать влияние крупных населенных пунктов и промышленных комплексов. Перед населенным пунктом можно отбирать пробу на одной русловой станции, но ниже его необходимо закладывать 2-3 поперечные трансекты. Учитывая, что влияние промышленных и бытовых стоков на фитопланктон может сказаться только через 2–3 суток, по скорости течения реки рассчитывают место заложения поперечных трансект. Так, при скорости реки у исследуемого пункта 0,5 м/сек первую трансекту целесообразно заложить через 43, вторую – через 86, а третью – через 130 км (эти расстояния водная масса пройдет за 1, 2 и 3 суток соответственно). При исследовании влияния сточных вод в малоили беспроточных водоемах трансекты закладываются с учетом ветровых сгонов так как ветровые течения часто превосходят склоновые. Поскольку в реках вертикальное распределение фитопланктона относительно равномерное, отбор проб в них обычно производят с горизонта 0,2–1 м батометром или простым зачерпыванием определенного объема воды (в случае бедных планктоном вод – 1 л, богатых – 0,5 л и менее).
На мелководных водоемах производят тотальный отбор проб от поверхности до дна.
6.1.2. Методы сбора пресноводных водорослей 6.1.2.1. Отбор проб фитопланктона
Для количественного учета фитопланктона отбор проб производится специальными приборами – батометрами разнообразных конструкций (Рутнера, Мейера-Фрацева, Кожевникова, Дьяченко и др.) (рис. 6.1). Батометр опускают в воду и при достижении необходимой глубины сильным встряхиванием троса (или же посредством специального «посыльного груза») закрывают крышки отверстий одного или двух цилиндров (в зависимости от конструкции батометров). Затем батометр в закрытом виде извлекают на поверхность. При изучении фитопланктона поверхностных слоев водоема пробы отбирают, зачерпывая воду в сосуд определенного объема.
Для работы на пресных водоемах чаще всего используются 1–2-литровые батометры, а в морях – 2- и 5-литровые. В водоемах, бедных фитопланктоном, отбирают пробы объемом не менее 1 л. В водоемах, богатых фитопланктоном – 0,5 л, а при «цветении» воды – даже 0,25 л. Отбор проб батометрами позволяет отбирать водоросли всех размерных групп, как для качественного, так и для количественного учетов.
126
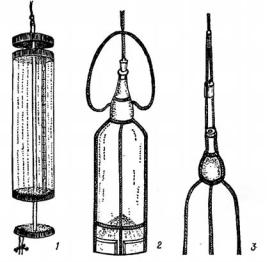
Рисунок 6.1. Приборы для сбора количественных проб фитопланктона: 1 – батометр Рутнера; 2, 3 – сосуд Мейера (опускается в воду в закрытом виде – 2; при достижении определенной глубины открывается рывком за трос, прикрепленный к пробке, и после заполне-
ния его водой поднимается в открытом состоянии – 3).
Для обнаружения малочисленных видов фитопланктона (к примеру, для флористико-систематических целей) проводят качественный лов планктона. Для этих целей используют планктонную сеть. Такая сеть состоит из металлического кольца и пришитого к нему мешка конической формы из мельничного шелкового или капронового сита № 77 (рис. 6.2). Внизу сеть заканчивается стаканчиком, в который собирается планктон при фильтрации воды через сеть. Для количественного учета водорослей планктонная сеть непригодна. При сетном сборе фитопланктона в планктонную сеть попадают только колонии и крупные клетки водорослей, тогда как клетки небольших размеров «проскакивают» через фильтрационную поверхность сита. Поэтому обловы фитопланктона сетью должны сочетаться с пробами, собранными с помощью батометра. Это позволяет более полно исследовать фитопланктон.
6.1.2.2. Отбор проб фитобентоса
Существующие методы отбора проб фитобентоса предусматривают сбор водорослей, обитающих на поверхности донных грунтов и отложений, в их толще (глубиной до 1 см) и придонном слое воды толщиной 2–3 см.
Для изучения видового состава фитобентоса достаточно извлечь на поверхность некоторое количество донного грунта и отложений на нем.
На мелководьях (глубиной до 0,5–1 м) это достигается с помощью опущенной на дно пробирки или сифона – резинового шланга со стеклянными трубками на концах, в который засасывают наилок.
На больших глубинах количественные пробы отбирают с помощью ведерка или стакана, прикрепленного к шесту, а также различными дночерпателями.
Для отбора количественных проб фитобентоса используют микробентометр Владимировой (рис. 6.3). Основная его часть представляет собой латунную трубку длиной 25–30 см с внутренним диаметром 4–5 см. На верхнем кон-
127

це этой трубки находится втулка с конусообразной воронкой, в которую на рычаг герметически входит притертая крышка-клапан.
Рисунок 6.2. Планктонные сети. 1–3 – сеть Апштейна; 4 – сеть Берджи; 5 – стаканчик к ней; 6 – цилиндрическая сеть «цепеллин».
Рисунок 6.3. Микробентометры Владимировой в открытом (I) и закрытом (II) виде и Травянко и Евдокимовой в поперечном (III) и продольном (IV) сечении: 1– железная трубка,
соединяющаяся с разборной штангой; 2 – шнур; 3 – кронштейн; 4 – крышка-клапан; 5 – втулка с конусом; 6 – рычаг; 7 – зажим-пружина; 8 – клапанная коробка;
9 – клапан; 10 – основное тело микробентометра; 11 – лопасти стабилизатора; 12 – свинцовый груз; 13 – штуцер для слива придонного слоя воды; 14 – переходная муфта;
15 – трубчатый нож.
128
Трубку с отрытой крышкой на деревянной штанге опускают на дно и врезают заточенным нижним концом в толщу грунта на несколько сантиметров. Потянув за веревку, закрепленную на свободном конце рычага, закрывают верхнюю втулку трубки крышкой, после чего прибор осторожно извлекают на поверхность.
При выходе трубки из воды нижнее отверстие трубки закрывают ладонью, чтобы не допустить выпадение грунта. Открыв крышку, осторожно сливают верхние слои воды в стеклянную посуду до появления мути (в дальнейшем эту часть воды выливают).
Оставшуюся в трубке воду, ил и грунт легко встряхивают и переносят в приготовленную посуду, предварительно измерив ее объем.
Микробентометр Владимировой удобен при работе на глубинах до 2–2,5 м. Другая модель – микробентометр Травянко и Евдокимовой – позволяет отбирать пробы с любых глубин (рис. 6.3). В данной конструкции верхний клапан закрывается автоматически после удара прибора о грунт. Прибор извлекают на поверхность; при выходе его из воды нижнее отверстие трубки закрывают ладонью. Остальная процедура отбора пробы идентична той, которая используется при работе с прибором Владимировой.
6.1.2.3. Отбор проб перифитона
Отбор проб перифитона с поверхности камней, гидротехнических сооружений, стеблей и листьев растений осуществляется с помощью обычного ножа или специальных скребков или ложек. Однако при этом часть материала гибнет или уносится токами воды; кроем того, нарушается картина распределения компонентов биоценоза. Поэтому лучше всего собирать водоросли перифитона вместе с субстратом, который полностью или частично извлекают из воды и помещают в специально приготовленный для этого сосуд.
Субстрат заливают небольшим количеством фильтрованной воды (взятой из того же водоема) для дальнейшего изучения собранного материала в живом состоянии.
6.1.3.Концентрирование и фиксация проб фитопланктона
Вводоеме концентрация отдельных видов водорослей различается на несколько порядков величин. Кроме того, сама численность водорослей, за исключением отдельных видов во время «цветения», очень низка. Поэтому подавляющее число видов водорослей практически невозможно учесть без их предварительного концентрирования. Рассмотрим несколько общепринятых методов концентрирования.
Осадочный метод концентрации проб (пробы отстаиваются 10 суток, а затем фильтрат очень медленно отсасывается сифоном через двойной слой газа № 76) в целом предпочтительнее метода ультрафильтрации, так как в большей степени способствует сохранению тонких структур водорослей. Уплотнение пробы проводится в два этапа: от 0,5 до 0,1 л, затем после вторичного отстаивания (можно не более 5 суток) раствор отсасывается вновь. Бедные пробы
129
