
3 курс / 2 семестр / Методы изучения экологии животных и растений / metody_polev_ekol_issl_2014
.pdf(например, зимние) доводятся до объема 10 мл, а чаще до 20 мл, очень богатые (например, в период «цветения» сине-зеленых) – до 50–100 мл (в этом случае вторичное отстаивание не производится).
Метод фильтрации проб через мембранные фильтры пригоден для концентрирования живых и фиксированных водорослей. Этот метод широко используется в экспериментах, где нет условий для длительного отстаивания отобранных проб в сосудах. Кроме того, он удобен для концентрирования водорослей с твердыми и жесткими створками и оболочкой (диатомовых, динофитовых и др.). Объем фильтруемой пробы зависит от двух условий: от концентрации водорослей и плотности фильтра. Чаще всего для фильтрации используют мембранные фильтры с порами 1,5 и 2,5 мкм, а если размеры водорослей очень малы, то – 0,2–0,6 мкм.
Метод центрифугирования применяется для концентрирования живого материала, чаще всего густых проб фитопланктона или при работе с культурами водорослей. В таком сконцентрированном материале возможен учет жгутиковых и других мелких и подвижных водорослей.
Концентрирование достигается центрифугированием 20–50 мл пробы (в зависимости от объема центрифужных пробирок и концентрации водорослей в пробе) в течение 20–30 мин. при 1000–2000 об/мин. Супернатант осторожно удаляют сифоном, оставляя 1/10–1/50 часть первоначального объема. Осадок ресуспензируют круговым помешиванием в оставшемся объеме воды и просматривают в счетной камере.
Для концентрирования и предохранения фитопланктона от разрушения при длительном хранении используются разнообразные химические соединения и их смеси. Консервацию осуществляют сразу же после отбора проб добавлением к ним фиксирующего реагента.
Для фиксации проб чаще всего используют формалин (10 мл 40%-ного формалина достаточно для 0,5 л пробы). Большие концентрации указанного фиксатора вызывают деформацию водорослей и изменение цвета их пигмента.
Раствор Люголя является хорошим фиксатором, и его используют, если количественная обработка проб осуществляется не позже трех месяцев с момента фиксации проб. При его употреблении в пробах хорошо сохраняются нежные формы фитопланктона. Кроме того, использование этого фиксатора позволяет обнаруживать пиреноиды, жгутики, слизь и чехлы вокруг клеток. Фиксированные пробы необходимо хранить в темноте. Для приготовления раствора Люголя используют 15 г KI, который растворяют в 50 мл дистиллированной воды, добавляют 10 г кристаллического йода и доводят раствор дистиллированной водой до общего объема 500 мл. Расход фиксатора составляет 2 мл на 100 мл пробы.
Раствор Люголя и ацетата натрия способствует контрастированию просматриваемого под микроскопом препарата, что особенно важно при наличии в пробе мелких жгутиковых водорослей. Фиксированные данным препаратом пробы хранятся не более трех месяцев. Для приготовления фиксатора 10 г KI растворяют в 70 мл дистиллированной воды, затем добавляют 5 г кристал-
130
лического йода и 5 г ацетата натрия (CH3COONa). Для фиксации 100 мл пробы используют 0,2 мл фиксирующего раствора.
Раствор Люголя с уксусной кислотой удлиняет срок сохранности фик-
сируемой пробы до одного года. Однако необходимо иметь в виду, что подкисление проб приводит к разрушению нежных водорослей и растворению оболочек у некоторых жгутиковых. Для приготовления фиксатора используют 20 г KI, который растворяют в 200 мл дистиллированной воды, добавляют 10 г кристаллического йода и 20 г ледяной уксусной кислоты (CH3COOH). Для фиксации 100 мл пробы используют 1 мл фиксатора.
6.1.4.Количественный учет пресноводных водорослей
Количественному учету подвергаются только количественные пробы во-
дорослей.
Данные о численности водорослей являются исходным материалом для вычисления биомассы и для пересчета других количественных показателей (содержание пигментов, белков, интенсивности дыхания, фотосинтеза и др.) на одну клетку или единицу биомассы. Счетный метод наиболее старый и трудоемкий, однако, при биологическом анализе он всегда будет сохранять ценность.
Обычно пробы просчитываются в камере Нажотта (объемом 0,01, реже 0,05 мл). Учитывая, что времени на обработку мало, а проб много, можно рекомендовать дифференцированный подход к объему просчета: бедные пробы считаются во всей сетке. Для того чтобы получить репрезентативные данные, необходимо не менее трех раз менять каплю пробы на камере (т.е. вся сетка просчитывается не из одной капли, а из 3–4, следовательно, при том же объеме работы охватывается больший материал). При просчете обильных проб (обычно они очень однородны по составу) допускается просчет только 10 из 40 полос камеры, причем капли пробы также меняются. Если в пробе встречается много макроколоний, она просчитывается в два приема: сначала мелкие формы, затем вся проба выливается в камеру Богорова и просчитывается число крупных колоний. Макроколонии бывают разной величины. Из них необходимо выбрать в качестве эталона колонию с наиболее часто встречающимся объемом и сосчитать количество клеток в ней. Остальные колонии следует приравнивать к эталонной (как ее долю для меньших или как несколько колоний – для больших). Число клеток в эталонной колонии (а, следовательно, и ее биомасса) подсчитывается в камере Нажотта (колония для подсчета раздавливается покровным стеклом).
При изучении фитопланктона необходимо все встреченные в камере водоросли тщательно замерять, отмечать их жизненное состояние и стадию развития. Можно вывести средние размеры клеток, однако обязательно это надо делать при работе с исследованным материалом, причем для каждого сезона и года необходимы новые измерения. Ни в коем случае нельзя пользоваться средними размерами, полученными на других водоемах.
При исследовании количественных проб фитопланктона просчет численности организмов на 1 л воды проводят по следующей формуле:
131

|
A |
1000 |
|
где |
||
N k n |
|
|
v |
|
, |
|
|
V |
|||||
|
a |
|
|
|
||
N – количество организмов в литре воды исследуемого водоема;
k – коэффициент, показывающий во сколько раз объем счетной камеры меньше 1 см3;
n – количество организмов, обнаруженных на просмотренных дорожках (квадратах);
A – количество дорожек (квадратов) в счетной камере;
a – количество дорожек, на которых производился подсчет водорослей; v – объем концентрата пробы (см3);
V – первоначальный объем отобранной пробы (см3).
Для количественного учета перифитона водоросли смывают с поверхности извлеченного субстрата с помощью воды и щеточки над широким сосудом. Измерив объем смыва, переносят его в приготовленную для пробы посуду. Количественный учет осуществляется в соответствии с методикой учета фитопланктона, описанной выше. Кроме объема смыва необходимо знать размер площади субстрата, с которой были собраны водоросли.
При изучении эпифитных водорослей, собранных со стеблей и листьев водных растений, количественный учет ведется в расчете не только на единицу площади, но и на единицу массы растения-субстрата.
При изучении количественных проб фитобентоса и перифитона, в которой обычно преобладают сравнительно крупные водоросли, пользуются преимущественно штемпель-пипеткой объемом 0,1 см3.
Расчет численности водорослей в пробах бентоса и перифитона ведут на 10 см2 поверхности субстрата по формуле:
n 10 v |
10, где |
|||
N |
|
|
||
S |
||||
|
|
|
||
N – количество водорослей на 10 см2 поверхности субстрата;
n – число водорослей в просчитанной капле воды объемом 0,1 см3; v – объем пробы (см3);
S – площадь сечения трубки в микробентометре (для бентосных проб) или площадь поверхности субстрата, с которого смыты водоросли (см2) (для проб обрастаний).
При изучении эпифитных водорослей их численность, кроме того, рассчитывают на 1 г сырой (или сухой) массы растения-субстрата по следующей формуле:
N n 10 v , где P
N – число водорослей на 1 г массы растения-субстрата;
n – число водорослей в просчитанной капле воды объемом 0,1 см3; v – объем пробы (см3);
P – сырая (или сухая) масса (г) участка растения, с которого были смыты эпифиты.
132
Наряду с количеством и численностью видов биомасса фитопланктона отнесена к важнейшим характеристикам структуры сообщества.
Биомасса выражается массой особей популяции или сообщества, отнесенной к единице площади (м2, га, км2) или к единице объема (см3, л, м3). Биомассу фитопланктона выражают в весовых единицах сырого, сухого, сухого обеззоленного вещества или органического углерода. Реже применяются и другие единицы измерения, такие, например, как калории, содержание азота, АТФ и др.
Наиболее распространенным является метод определения биомассы исходя из вычисления численности и объема клеток каждого вида водорослей, полученные после количественной обработки проб.
Определение объема отдельных клеток осуществляется следующим способом: форма клетки тех или иных водорослей приравнивается к наиболее близкому по форме геометрическому телу, затем измеряют параметры клеток, необходимые для вычисления объема этого геометрического подобия. Поскольку подавляющее большинство видов водорослей имеет форму шара, цилиндра, эллипсоида или двух конусов, то каждый исследователь может составить себе таблицу объемов этих тел и постоянно пользоваться ими. В случае более сложной формы клетки приходится вычислять объем индивидуально.
По результатам массовых измерений величин объемов вычисляют средний объем клетки данного вида. Принимая удельную массу водорослей равной единице, исходя из объема клетки, определяют ее массу. Перемножая численность клеток на их массу, получают биомассу популяции. Суммированием последних находят биомассу всего фитопланктонного сообщества. Биомасса вы-
ражается в миллиграммах на 1 литр (или г/м3) с точностью до 0,1 мг/л или
0,01 г/м3.
Необходимо иметь в виду, что размер клеток отдельных видов водорослей сильно варьирует в зависимости от условий среды, типа водоема, времени года. Поэтому при работе на конкретном водоеме необходимо измерять объемы клеток, по крайней мере, наиболее массовых форм несколько раз в год.
Если была обработана интегрированная проба для всей толщи воды, то полученный показатель биомассы будет отражать среднюю величину для всей глубины. Перемножая ее на показатель глубины станции (м), находят биомассу под 1 м2 поверхности.
Если была отобрана серия проб по вертикали с промежутком в 1 м, то среднюю биомассу находят как среднюю арифметическую; если же промежутки были неодинаковы, то – как взвешенную среднюю арифметическую:
|
V1P1 V2P2 ...Vn Pn |
|
VP |
|||
M |
|
|
|
|
, где |
|
P1 P2 ...Pn |
|
|||||
|
|
P |
||||
V1, V2, Vn – биомасса фитопланктона (г/м3) с разных горизонтов; Р – ½ промежутка (м) между отобранными пробами;
ƩVP – биомасса фитопланктона под м2 поверхности (г/м2); М – взвешенная средняя арифметическая (г/м3).
133
Анализ распределения фитопланктона по акватории водоема необходимо проводить по средневзвешенной биомассе (средней для всего столба воды), а продуктивность – по биомассе под 1 м2 поверхности.
6.2. Методы изучения зоопланктона
6.2.1.Отбор проб
Существует два подхода к отбору проб зоопланктона:
1.Отбор и одновременное отделение планктона от воды (фильтрация) в самой воде. Осуществляется с помощью планктонных сетей (например, Джеди) и планктоночерпателей;
2.Раздельное водозачерпывание и последующее отделение планктона от воды. Осуществляется или с помощью фильтрации доставленной на поверхность воды через сетку (например, Апштейна), или посредством отстаивания.
Метод отбора проб зависит от типа водоема, его глубины, размеров. В крупных и средних водоемах с замедленным водообменом (озерах, водохранилищах) пробы зоопланктона отбирают количественной сетью Джеди фракционно (последовательно облавливают эпи-, мета и гиполимнион) по стандартным горизонтам: поверхность – 0,5 м глубины; поверхность – 2 м; 2–5 м; 5–10 м; 10–25 м; 25–50 м; 50–100 м. В мелких водоемах (прудах, малых лесных озерах, лагунах), глубина которых не превышает 3–4 м, отбор проб осуществляется тотально также количественной сетью Джеди (облавливают весь столб воды от дна до поверхности).
Используются также планктоночерпатели, планктобатометры различных конструкций. В реках для сбора качественных проб используется цилиндрическая сеть Лангганса «Цеппелин», для сбора количественных проб – батометр Жуковского.
Наиболее простым и доступным, не требующим сложного оборудования, является способ отбора проб путем процеживания 50–100 л воды, взятой сосудом определенной вместимости (литровая кружка, полиэтиленовое 5-литровое ведро), через качественную сеть Апштейна (газ № 64–77).
Для взятия пробы с глубины удобны батометры, применяемые для отбора гидрохимических проб, например батометр Руттнера. Вода (от 50 до 100 л) с помощью батометра определенной вместимости (1, 2, 3 л) с нужного горизонта фильтруется через качественную сеть Апштейна.
Кроме описанного метода существует отстойный метод, который обычно применяется для выявления видового состава и количественного распределения мелких коловраток. Вода с поверхности или с определенного горизонта, взятая кружкой, ведром, батометром, выливается в сосуд определенной вместимости, фиксируется и отстаивается 7–10 сут. По истечении указанного времени вода над осадком выливается с помощью сифона (резиновой трубки, затянутой снизу мельничным газом № 77). Осадок просматривается под микроскопом.
Остановимся на более простых, доступных, но достаточно точных орудиях лова и способах отбора проб. Классическим орудием сбора зоопланктона яв-
134
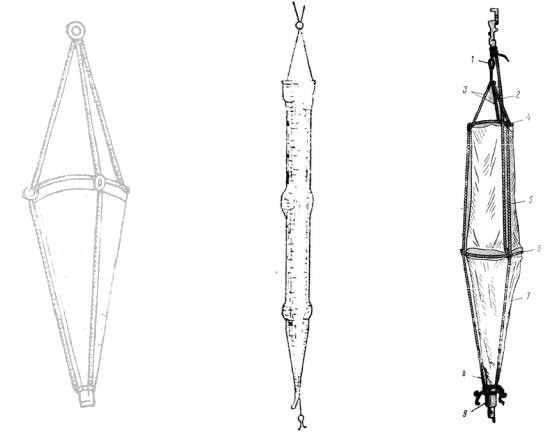
ляется коническая планктонная сеть Апштейна (рис. 6.4), состоящая из шелкового или капронового конуса (усеченного), сверху нашитая на металлическое кольцо, а снизу имеющая стакан, в который собирается планктон. Конус из шелкового или капронового сита пришивается не непосредственно к обручу, а к полосе ткани (из льна, бязи или любой другой хлопчатобумажной), с помощью которой он прикрепляется к обручу. Для изготовления планктонной сети употребляется мельничное шелковое или капроновое сито (газ), отличающееся большой прочностью и равномерностью распределения нитей. Номер сита соответствует числу ячей в 1 см ткани. Наиболее частый газ – № 77, наиболее редкий – № 7. Для улавливания микропланктона применяется газ № 64–77, мезопланктона – № 38–64. Нано- и ультрапланктон сетью не улавливаются.
а) б) в)
Рисунок 6.4. Качественная сеть Апштейна (а), цилиндрическая сеть «Цеппелин» (б), количественная сеть Джеди (в): 1 – петля на шнуре, 2 – шнур, связывающий сетку с замыкателем, 3 – шнуры на верхнем кольце, 4 – верхнее кольцо, 5 – матерчатый конус, 6 – нижнее кольцо, 7 – шелковая сеть, 8 – шнур, удерживающий стаканчик, 9 – стаканчик
При изготовлении конуса необходимо: 1) шелковое или капроновое сито перед шитьем смочить губкой и слегка прогладить негорячим утюгом; 2) плотный хлопчатобумажный или льняной материал перед шитьем вымочить, высушить и прогладить; 3) веревки предварительно намочить и высушить в натянутом виде.
Материал для сетяного конуса раскраивается по выкройке. На выкройке делается прибавка на швы по 1 см сверху и по длинной стороне, а также 3 cм
135
внизу конуса, для нашивки с помощью полоски плотной материи на довольно острый край планктонного стакана. Сеть шьется тонкой иглой и тонкими прочными нитками, лучше натуральными шелковыми. Нижний обшитый плотной материей (шириной не более 10 см) конец конуса прикрепляется к стакану при помощи плоского латунного кольца. К металлическому кольцу на равном расстоянии друг от друга прикрепляются три прочные бечевки (стропы); свободные концы строп над входным отверстием сети привязываются к небольшому кольцу, к которому присоединяется при помощи чекеля петля или кольцо пенькового, льняного или металлического троса, служащего для спуска сети. Пеньковый трос толщиной 3–5 мм или несколько толще предварительно пропитывается олифой, растягивается и в намоченном состоянии размечается на метры и полуметры путем вшивания в трос цветных ниток (например, метры обозначаются красными нитками, полуметры – синими). На зажимном кольце стакана (перпендикулярно боковой поверхности) припаиваются ушки, за которые стакан с помощью трех бечевок прикрепляется к кольцу. Это делается во избежание того, чтобы шелковый газ не порвался под тяжестью плохо фильтрующейся воды, стакана и груза, служащего для утяжеления сети. Размеры качественной сети Апштейна приведены в табл. 6.1. В последнее время промышленность выпускает мельничное сито из капрона. Толщина нитей в капроновых сетях меньше, чем в шелковых, поэтому нумерация разная. Сравнительные номера шелковых (числитель) и капроновых (знаменатель) сит: 7/7; 9/9; 11/11; 15/15; 19/23; 21/27; 23/29; 25/32; 27/35; 29/38; 32/43; 35/46; 38/49; 43/52; 49/58; 52/61; 55/64; 58/67; 61/70; 64/73.
|
Размеры качественной сети Апштейна |
Таблица 6.1. |
||
|
|
|||
Модель |
Образующая боковой по- |
Диаметр, см |
|
|
|
верхности конуса, см |
входного отверстия |
|
стакана |
Малая |
55 |
25 |
|
3,5-4,0 |
Средняя |
100 |
40 |
|
6,0 |
Для планктонных сетей применяются металлические и стеклянные стаканы разной конструкции. Особенно удобны металлические стаканы с краном. Размеры стакана для малой сети: высота 40 мм, диаметр 28 мм, для средней – соответственно 80 и 55 мм. Вместо крана на стакане может быть патрубок, на который насаживается резиновая трубка соответствующего диаметра, запирающаяся зажимом Мора. Такой стакан наиболее удобен для работы в зимний период, когда поворот крана затруднен в связи с низкими температурами воды и воздуха. Не менее удобен металлический стакан с глухим дном без крана, состоящий из двух частей: короткой верхней и более длинной нижней, соединенных друг с другом посредством штыкового затвора или винтовой нарезки. Внутренний диаметр стакана – 3,5 см, высота верхней части – 3 см, нижней –
7 см.
Сеть Апштейна применяется и при количественных сборах в водотоках путем процеживания через сеть 50–100 л воды.
136
Качественный лов зоопланктона производится с целью выявления его видового состава. Установление видового состава зоопланктонного сообщества следует проводить в течение вегетационного периода, когда основная масса организмов присутствует в планктоне и активно размножается.
Качественными сетями работают с лодки, плота, судна. Их опускают в воду по возможности вертикально вручную или с помощью лебедки. Маленькие планктонные сети можно забрасывать с берега, не допуская зачерпывания ими грунта.
Для сбора планктона в реке или при движении судна на озерах и водохранилищах рекомендуется цилиндрическая сеть Лангганса («Цеппелин») (рис. 5.4), состоящая из двух сшитых из шелка или капрона цилиндров и одного шелкового или капронового конуса с планктонным стаканом на конце. Сеть с помощью кусков полотна нашивается на три металлических кольца; к переднему кольцу привязывается уздечка с кольцом для крепления к тросу.
Количественные сети требуют более тщательного изготовления. Они отличаются от качественных наличием в переднем отделе сети «обратного» кону- са-надставки из плотного хлопчатобумажного материала. В связи с этим имеется второе металлическое кольцо, к которому пришивается верхний конец надставки и которое представляет собой отверстие сети. Назначение конусанадставки заключается в ослаблении обратных (вихревых) токов воды и тем самым в предохранении планктона от вымывания при протягивании сети сквозь толщу воды.
Существует целый ряд количественных сетей, самыми распространенными из которых являются сети Джеди, Нансена, Апштейна. Основные различия в их конструкции сводятся к различиям в форме надставки и в механизме замыкания сети при ловах по горизонтам. Наиболее удобна для лова мезопланктона сеть Джеди (рис. 6.4). Она состоит из фильтрующего шелкового или капронового конуса, как и в качественной сети Апштейна, и верхнего обратного усеченного конуса из плотного белого материала. По верхнему и нижнему краю обратного конуса пришиваются металлические обручи (диаметром 0,5–1,0 см), к которым на равном расстоянии друг от друга посредством манжеты из плотной ткани крепятся три боковые стропы сети. Стропы делают из льняного или капронового фала. Свободные концы строп связывают петлей над входным отверстием сети. К нижнему концу фильтрующего конуса, как и в любой качественной сети, пришивается манжета из плотной ткани, с помощью которой к сети прикрепляется стакан с краном для сливания пробы. Стакан также посредством трех строп прикрепляется к большому нижнему кольцу с таким расчетом, чтобы при подвешивании груза фильтрующий конус имел небольшую слабину. Места крепления строп к обоим кольцам, а также ушки стакана необходимо совместить по одной прямой во избежание перекручивания фильтрующего конуса сети.
Количественная сеть Джеди приводится в рабочее положение с помощью специального замыкателя, состоящего из обоймы, внутри которой на оси свободно двигается крючок с противовесом, служащий для закрепления кольца уз-
137
дечки сети. Через верхнюю часть обоймы пропущен винт, за который крепится трос, здесь же укреплен спускной механизм со спиральной пружиной посередине. В головке спускного механизма имеется прорезь для троса. Сеть надвешивается дополнительным шнуром, идущим от большого кольца к нижней части обоймы.
Перед началом работы сеть вывешивается в открытом состоянии: кольцо уздечки зажато крючком замыкателя. Кран для сливания пробы на стакане закрыт. В таком виде сеть опускается в воду, затем поднимается до нужного горизонта, и к этому моменту по спусковому тросу пускается посыльный груз, который, ударяя по головке спускного механизма, освобождает кольцо уздечки
– сеть закрывается и повисает на тросе, прикрепленном к большому кольцу. Закрытая сеть поднимается на поверхность. Сети придается первоначаль-
ное положение, т.е. кольцо уздечки зажимается крючком замыкателя. Кран стакана открывается, и проба переливается в подготовленную заранее чистую посуду. Затем кран стакана закрывают и сеть в расправленном виде погружают в водоем до уровня входного отверстия, для того чтобы смыть со стенок сети оставшиеся организмы. Смытые со стенок остатки пробы сливают в ту же посуду. Нельзя допустить, чтобы при споласкивании сети в нее попала через входное отверстие новая порция воды.
После облова каждого горизонта сеть споласкивают. Для этого кран на стаканчике открывают, сеть 2–3 раза погружают в воду до уровня входного отверстия, а затем поднимают. При проведении работ, в особенности в период «цветения» воды, а также при небольших глубинах водоема происходит забивание ячей сети водорослями и детритом. Это снижает уловистость сети, поэтому по окончании работ необходимо промыть сеть с внешней и внутренней сторон горячей водой с помощью губки.
В озерах и водохранилищах зоопланктон собирается количественной сетью Джеди в эпилимнионе, металимнионе и гиполимнионе или по стандартным горизонтам: поверхность – 0,5 м; поверхность – 2 м; 2–5 м; 5–10 м; 10–25 м; 25– 50 м; 50–100 м. Отбор проб следует начинать с верхних горизонтов. Скорость подъема открытой сети не должна быть меньше 0,25 м/с и больше 0,5 м/с. После замыкания сети скорость подъема увеличивают, а затем перед поверхностью несколько снижают, чтобы сеть плавно вынуть из воды.
Для установления видового состава зоопланктона производится тотальный лов от дна до поверхности. Иногда, в зависимости от целей исследования, возможен отбор так называемых интегральных проб, т.е. пробы отбираются, как обычно, по горизонтам, а затем сливаются в одну склянку.
Отобранные различными способами пробы переливаются из стакана в обычные стеклянные банки, бутылки, хлорвиниловую посуду (100, 150, 200, 300 мл в зависимости от размера стакана). Банки тщательно закрываются завинчивающимися крышками с резиновыми прокладками, бутылки – плотными резиновыми и хлорвиниловыми пробками.
138
6.2.2.Консервация и этикетирование проб
Каждая проба зоопланктона, если она не обрабатывается в живом состоя-
нии, должна быть сразу зафиксирована. Фиксируют зоопланктонную пробу обычно 40%-ным формалином. Формалин приливают в пробу с таким расчетом, чтобы получился его 4%-ный раствор (1 часть формалина на 9 частей воды). Хорошо зафиксированная проба должна иметь устойчивый запах формалина. Применяемый формалин не должен иметь осадка. Кроме того, рекомендуется фиксировать пробы нейтральным формалином, так как в пробах, обладающих кислой реакцией, происходит растворение оболочек некоторых нежных организмов. Для нейтрализации формалина готовят насыщенный раствор бикарбоната натрия (NaHCO3), который затем при постоянном перемешивании добавляют в 40%-ный формалин до появления нейтральной реакции (устанавливают лакмусовой бумажкой).
Если нельзя обеспечить хранение проб в теплом месте (зимний период, полярные условия), пробы зоопланктона фиксируются спиртом. С этой целью объем воды в пробе доводится до возможного минимума, и в банку наливается 96%-ный спирт с таким расчетом, чтобы его концентрацию привести к 70%.
Каждая проба зоопланктона должна быть тщательно этикетирована, информация о ней записывается в специальный журнал или полевой дневник.
Этикетка пишется на пергаментной бумаге и вкладывается под прокладку крышки. Иногда проба снабжается второй этикеткой, которая опускается внутрь сосуда. На пробке или стенке банки ставится номер пробы. Номер на пробе соответствует номеру, записанному в полевом дневнике.
Пробки банок с зафиксированным планктоном и этикетками заливают парафином или смесью воска и парафина. Банки хранят в порядке сборов и записей в защищенном от прямого света помещении.
При транспортировке, пересылке проб рекомендуется банки заполнять 4%-ным раствором формалина доверху, что позволяет сохранить в целости хрупкие части тела ракообразных. Зимой сборы, зафиксированные формалином, пересылать не следует.
6.2.3.Место и периодичность отбора проб
Сбор зоопланктона обычно осуществляется в местах постоянных гидро-
биологических наблюдений и приурочен к стандартным гидрохимическим створам. В ряде случаев места гидробиологических станций на водных объектах выбирают исходя из цели исследования и поставленных задач. Выбор станций наблюдения на водном объекте, т.е. пунктов отбора проб зависит прежде всего от местонахождения источников загрязнения (промышленные предприятия, бытовые стоки, сельскохозяйственные угодья). Необходимо установить биологический фон данного водного объекта, для чего следует выбрать ряд станций в незагрязненных участках, например, выше источника загрязнения или по возможности вне сферы влияния сточных вод на разном расстоянии от источника загрязнения.
139
