
Книги / Аналитическая химия
.pdf
Примеры решения задач
Пример 1. Определите факторы эквивалентности участников и константу равновесия ОВР при титровании раствора перманга-
ната калия раствором Fe2+ в кислой среде. |
|
||
Решение. Уравнение реакции титрования: |
|
||
|
2KMnO4 + 10FeSO4 + 8Н2SO4 = |
|
|
|
= 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O. |
|
|
Способ титрования — прямой. |
|
||
Схема полуреакции для титруемой системы: |
|
||
MnO4– + 8H+ + 5e– Mn2+ |
+ 4H2O (n1 = 5, 1z 1 |
5), |
|
схема полуреакции для сиcтемы титранта: |
|
||
|
Fe2+ – e– Fe3+ |
(n2 = 1, 1z 11). |
|
E0 – |
1,51B и E0 3 |
0,77 B (cм. прил., табл. 5). |
|
MnO4 |
Fe |
|
|
Mn2 |
Fe2 |
|
|
Константа равновесия данной ОВР:
lgK n1 n2 (E10 E20) 5 1 (1,51 0,77) 62,7, 0,059 0,059
K = 1062,7 = 5,01 1062.
Большаяконстанта равновесияговоритотом, чтореакцияидет практически до конца, что является одним из условий титрования.
Ответ: Факторы эквивалентности для перманганата калия и соли железа (II) равны 15 и 11 соответственно; K = 5,01 1062.
Пример 2. Определите способ титрования и предложите формулу для определения массового содержания СаСО3 методом перманганатометрии.
Решение. Пробукарбоната кальция растворяют в соляной кислоте, кальций осаждают оксалатом аммония в виде оксалата кальция и после фильтрации и промывки егорастворяют в серной кислоте. Сульфат кальция выпадает в осадок, а в растворе появляется щавелеваякислота в количестве, эквивалентном содержанию кальция в исходной пробе.
61

CaCO3 + 2HCl= CaCl2 + H2CO3
(растворение CaCO3).
CaCl2 + (NH4)2C2O4 = CaC2O4 + 2NH4Cl
(осаждение CaC2O4 ).
CaC2O4 + H2SO4 = CaSO4 + H2C2O4
(перевод в раствор H2C2O4).
Далее щавелевую кислоту титруют стандартным раствором перманганата калия по уравнению
5H2C2O4 + 2KMnO4 + 3H2SO4 = = 10CO2 + 2MnSO4 + K2SO4 + 8H2O.
Соответствующие схемы полуреакций для ионов перманганата и оксалата:
MnO– + 8H+ + 5e– Mn2+ |
+ 4H O |
(n |
1 |
= 5, |
1 |
1 |
), |
|||||
4 |
|
2 |
|
|
|
|
|
z |
5 |
|
||
С О2– – 2е– 2CO |
2 |
(n |
2 |
= 2, |
1 |
|
1 |
2 |
). |
|
|
|
2 4 |
|
|
|
z |
|
|
|
|
||||
Это титрование позамещению: ионы кальция заместили на ок- салат-ионы в эквивалентном количестве, и далееоксалат-ионы оттитровывают эквивалентным количеством перманганата калия. Массу карбоната кальция (г) вычисляют по формуле
m (C |
V) |
M |
10 3. |
CaCO3 |
1z |
KMnO4 |
1zCaCO3 |
Фактор эквивалентности для CaCO3 равен 12, так как 1 моль
CaCO3 соответствует1молюH2C2O4, факторэквивалентности кото-
рого равен 12.
Пример 3. На титрование навески технического KMnO4 мас-
сой 0,8500 г потребовалось 21,5 см3 раствора Na2C2O4 |
с C1 |
|
z |
= 0,150 моль/дм3. Определите массовую долю KMnO4 в образце.
62

Решение. Уравнениевзаимодействия перманганата калияи оксалата натрия и схемы соответствующих полуреакций приведены в примере 2 этого раздела. Титрование прямое. Формула для вычисления массы (г) перманганата калия:
m |
(C |
1 |
V) |
C |
O |
2 M |
1 |
KMnO |
10 3 |
, |
KMnO4 |
|
z |
4 |
4 |
|
|||||
|
|
|
2 |
|
z |
|
|
M1zKMnO4 15MKMnO4 158 : 5 31,6 г/моль.
Массовая доля перманганата калия в образце:
|
m |
(C1 |
V)C |
O2 M |
1 |
z |
KMnO |
4 |
10 3 |
||
|
KMnO4 |
100% |
z |
2 |
4 |
|
|
|
100%, |
||
|
|
|
mнав |
|
|
|
|
|
|||
|
mнав |
|
|
|
|
|
|
|
|
||
0,150 21,5 31,6 10 3 100 12%. 0,850
Ответ: (KMnO4) = 12 %.
Пример4.Постройтекривуютитрования100,0см3 0,100моль/дм3 раствора дихромата калия 0,100 моль/дм3 раствором сульфата железа (II)в 0,500моль/дм3 растворесерной кислоты. Подберитеподходящий индикатор.
Решение. Уравнение реакции при титровании:
K2Cr2O7 + 6FeSO4 + 7Н2SO4 =
= Cr2(SO4)3 + 3 Fe2(SO4)3 + K2SO4 + 7H2O.
Для титруемой системы схема полуреакции: |
|
|
|
|
|
||||
Cr O2 |
– + 14H+ + 6e– 2Cr3+ |
+ 7H O |
(n |
1 |
= 6, 1 |
z |
1 |
6 |
). |
2 7 |
|
2 |
|
|
|
|
|||
Потенциал данной системы зависит от рН среды, так как в по-
луреакции участвуют ионы водорода. Е0 2 3 1,36В.
Cr2O7 ,14H /2Cr
Для системы титранта схема полуреакции:
Fe2+ – e– Fe3+ |
(n |
2 |
= 1, 1 |
z |
1 |
) |
Е0 |
3 |
/Fe |
2 0,77 В. |
|
|
|
1 |
|
Fe |
|
|
63

ДоТЭ рассчитывают потенциал потитруемой системе (Cr2O72–, 14H+/2Cr3+):
E E0 |
|
0,059 |
lg |
[ок] |
|
1,36 |
0,059 |
lg |
[Cr2O72 ] [H ]14 |
. |
n |
|
|
|
|||||||
1 |
|
[вос] |
6 |
|
[Cr3 ]2 |
|||||
|
1 |
|
|
|
|
|
|
|
|
|
Поусловиюзадачиконцентрациясернойкислоты0,500моль/дм3,
поэтому C(H+) = 1,000 моль/дм3 и [H+]14 = 1.
|
|
|
|
|
|
|
C0V0 C V |
|
|
|
|
C V |
||||
|
[Cr O2 |
|
] |
|
т т |
и [Cr3 |
] |
|
т т |
, |
|
|||||
|
|
|
|
|
||||||||||||
2 |
7 |
|
|
|
Vобщ |
|
|
|
|
|
Vобщ |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
[Cr O2 |
] |
|
|
(С0V0 C V ) V |
(V0 V ) V |
|||||||||||
|
2 7 |
|
|
|
|
т |
т |
общ |
|
|
|
т |
|
общ |
, |
|
[Cr3 ]2 |
|
|
|
C2V2 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
C V2 |
|||||||
|
|
|
|
|
|
|
т |
т |
|
|
|
т |
т |
|||
так как по условию С0 = Ст.
До начала титрования потенциал не рассчитывают, поскольку в системе нет сопряженных О-В-пар.
Добавлено 50,0 см3 титранта:
E 1,36 0,01 lg 50 150 1,36 0,01 1,48 1,38В.
0,1 502
Добавлено 90,0 см3 титранта:
E 1,36 0,01 lg 10 190 1,36 0,01 0,37 1,36 В.
0,1 902
Добавлено 99,0 см3 титранта:
E 1,36 0,01 lg 1 199 1,36 0,01 (–0,7) 1,35В.
0,1 992
Добавлено 99,9 см3 титранта (НСТ, f = 99,9 %):
E 1,36 0,01 lg0,1 199,9 1,36 0,01 (–1,7) 1,34В.
0,1 99,92
В точке эквивалентности:
ЕТЭ 6 1,36 1 0,77 1,28В. 6 1
64

После ТЭ рассчитывают потенциал по системе титранта
(Fe3+/Fe2+):
E E0 |
|
0,059 |
lg |
|
[ок] |
0,77 0,059 lg |
[Fe3 ] |
, |
|||||||||||
|
|
|
|
|
|
|
|||||||||||||
2 |
|
|
n |
|
[вос] |
|
|
|
|
|
[Fe2 ] |
||||||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C0V0 |
|
|
|
|
|
|
C V C0V0 |
|||||||||
[Fe3 |
] |
|
|
|
|
и [Fe2 |
|
] |
|
т т |
|
, |
|
||||||
Vобщ |
|
|
|
|
Vобщ |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
[Fe3 ] |
|
|
|
C0V0 |
|
|
|
|
V0 |
, |
|
|
|
||||
|
|
|
С V С0V0 |
V V0 |
|
|
|
||||||||||||
|
|
[Fe2 ] |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
т т |
|
|
|
|
т |
|
|
|
|
|
так как по условию С0 = Ст.
Добавлено 100,1 см3 титранта (КСТ, f = 100,1 %):
E 0,77 0,059 lg100 0,77 0,177 0,95В.
0,1
Добавлено 101,0 см3 титранта:
E 0,77 0,059 lg100 0,77 0,118 0,89В. 1
Добавлено 110,0 см3 титранта:
E 0,77 0,059 lg100 0,77 0,059 0,83В. 10
Добавлено 150,0 см3 титранта:
E 0,77 0,059 lg100 0,77 0,018 0,79 В. 50
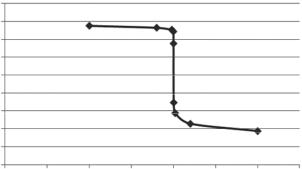
Пополученным значениям потенциалов строят кривую титрования (рис. 3).
Для титрования подходит О-В-индикатор нитро-о-фенантро- лин (прил.,табл. 6), таккакегостандартный О-В-потенциал(1,25 В) наиболее близок к потенциалу в ТЭ (1,28 В).
Пример5.Враствор, содержащий ионыАg+, добавилиNa2S2O3 дляобразованиякомплекса[Ag(S2O3)2]3–. Изменятсяли окислитель-
65
Е, В 1,5
1,4
НСТ
1,3
ТЭ
1,2
1,1
1,0
КСТ
0,9
0,8
0,7
0,6
0 |
25 |
50 |
75 |
100 |
125 |
150 |
175 V, мл (f, %) |
Рис. 3. Кривая титрования 100 см3 0,1 моль/дм3 раствора K2Cr2O7 0,1 моль/дм3 раствором FeSO4 в 0,5 моль/дм3 растворе Н2SO4
ныесвойства серебра в этих условиях?Сделайтенеобходимыерасчеты и дайте объяснения.
Решение. В процессекомплексообразования происходит изменение концентрации свободных ионов сопряженных О-В-пар, что приводит к изменению потенциала системы и сдвигу равновесия. Для полуреакции Ag+ + е– Agтв
Е0Ag+/Ag = 0,799 В и n = 1,
ЕAg+/Ag = 0,799 + 0,059 lg[Ag+].
В присутствии избытка лиганда (тиосульфата натрия) в растворе происходит образование комплексного иона [Ag(S2O3)2]3–:
Ag+ + 2S2O32– [Ag(S2O3)2]3–,
который восстанавливается по уравнению
[Ag(S2O3)2]3– + е– Agтв + 2S2O32–.
При расчете реального О-В-потенциала используют константу нестойкости(илиустойчивости)комплексногосоединения(изсправочника по аналитической химии).
66
Так K |
нест |
|
[Ag ] [S2O32 ]2 |
3,5 10–14, |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
[Ag(S O |
)3 ] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
2 |
3 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
откуда [Ag ] 3,5 10–14 |
[Ag(S O )3 ] |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
2 |
3 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
[S O |
2 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
2 |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–14 |
[Ag(S2O3)32 ] |
||||||||
Тогда Е |
|
|
= Е0 |
+ 0,059 lg |
3,5 |
|
|
10 |
|
|
|
|
|
|
|
= |
|||||||
|
|
|
|
|
|
|
2 |
2 |
|||||||||||||||
|
Ag+/Ag |
Ag+/Ag |
|
|
|
|
|
|
|
|
|
|
|
|
[S2O3 |
|
] |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[Ag(S O )3 |
] |
|
|
|||||
= 0,799 + 0,059 lg(3,5 10–14) + 0,059 lg |
|
2 |
3 |
2 |
|
= |
|
||||||||||||||||
|
|
|
2 |
2 |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[S O ] |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
[Ag(S O )3 ] |
|
|
|
|
|
|
|
||||||||
|
|
|
|
= 0,004 + 0,059 lg |
|
|
|
2 |
3 2 |
. |
|
|
|
|
|
||||||||
|
|
|
|
|
|
[S O |
2 2 |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
] |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
2 |
3 |
|
|
|
|
|
|
|
|
|
|
|
Таким образом, в условиях комплексообразования ион серебра теряет свои окислительныесвойства, егостандартный потенциал уменьшается с 0,799 В до 0,004 В.
Пример6. В кислыхрастворах йодид-ион окисляется нитритионом по реакции 2NO2– + 3I– + 4H+ 2NO + I3– + 2H2O. Докажите, что при рН 6 реакция окисления йодид-иона становится невозможной.
Решение. Если в ОВР участвуют ионы водорода или гидрок- сид-анионы, тоэтоприводит к изменениюО-В-потенциала и сдвигу равновесия. Схема полуреакции восстановления нитрит-ионов с участием H+:
NO– + 2H+ + е– NO + H O (n = 1) |
|
2 |
2 |
Е0 |
, 2H |
|
0,99В. |
|
|
NO2 |
|
/NO |
|
|
|
Потенциалсистемы: Е 0,99 0,059lg |
[NO2 ] [H ]2 |
||||
|
, гдевмес- |
||||
|
|||||
PNO
то концентрации [NO] записывают парциальное давление газообразного оксида азота — PNO.
67

[NO ]
Е = 0,99 + 0,059lg[Н+]2 + 0,059lg 2 .
PNO
При рН = 6 концентрация [Н+] = 10–6 моль/дм3, и реальный потенциал равен:
[NO2 ] |
[NO ] |
||||
Е=0,99+0,059 lg10–12 +0,059 lg |
|
=0,28+0,059 lg |
2 |
. |
|
PNO |
|||||
P |
|||||
|
|
|
NO |
||
Стандартный О-В-потенциализменилсяс0,99до0,28В, вэтих условиях нитрит-ионынесмогутокислятьйодид-ионы сЕ0 = 0,54 В.
Пример 7. Рассчитайте реальный стандартный О-В-потенциал системы Cu2+/Cu+ с учетом образования малорастворимого соединения CuI и определите, окислителем или восстановителем в этих условиях является Cu2+.
Решение. Если один или несколько участников ОВР образуют малорастворимые соединения, то это приводит к изменению О-В- потенциала и сдвигу равновесия ОВР.
Для реакции по уравнению 2Cu2+ + 4I– 2CuI + I2 схема полуреакции для меди Cu2+ + e– Cu+ (n = 1),
E0 |
2 |
0,167 В. |
Cu |
|
Cu |
|
|
Потенциал E |
|
0,167 0,059 lg |
[Cu2 ] |
. |
||
2 |
[Cu |
|
] |
|||
Cu |
|
Cu |
|
|||
|
|
|
|
|||
С учетом того, что восстановленнаяформа меди CuI малорастворима, в расчетахпотенциала используютзначениепроизведения растворимости ПР. При избыточном количестве йодид-ионов:
ПР(CuI) = [Cu+] [I–] = [Cu+] 1 = 1,1 10–12 (прил., табл. 1).
Значениеконцентрации [Cu+]подставляют в уравнениеНернста для расчета реального потенциала:
Е= 0,167 + 0,059 (lg[Cu2+] – lg(1,1 10–12)) =
=0,873 + 0,059lg[Cu2+].
68

Потенциал изменился с 0,167 В до 0,873 В, что сделало возможнымпротеканиеданной реакции с йодид-ионами. Вэтихусловиях Cu2+ является окислителем, а йодид-ион — восстановителем с Е0 = 0,54 В.
Задачи для самостоятельной работы
2.87.Вычислитетитррастворадихромата калияпожелезу, если на титрование навески руды массой 0,200 г, содержащей 30 % железа, затрачено18,2 см3 раствора титранта.
2.88.Вычислитемассунавески железной руды, чтобыпри титровании раствора, полученного после растворения руды и восста-
новления железа до Fe2+, с С1 0,020 моль/дм3 раствором дихро-
z
мата калияобъем K2Cr2O7 (см3), пошедший на титрование, численно равнялся бы массовой доле железа в руде.
2.89.Врастворнитрата серебра была опущена никелеваяпластинка, масса которой увеличилась на 0,730 г. Сколько серебра (г) выделилось на пластинке?
2.90.Вычислите массу йода в пробе, если на ее титрование израсходовано16,0см3 раствора тиосульфата натриясмолярной концентрацией 0,080 моль/дм3.
2.91.Длястандартизации раствора тиосульфата натриянавес-
куKBrO3 массой 0,1510 г растворили в разбавленной НСl, добавили избыток KI и выделившийся I2 оттитровали, затратив 39,7 см3 раствора Na2S2O3. Рассчитайтенормальность раствора тиосульфата натрия.
2.92.Для определения сульфида натрия и тиосульфата натрия навеску полисульфида 1,800 г растворили в мерной колбе вместимостью 200,0 см3. На титрование20,0 см3 полученногораствора
израсходовали 13,7 см3 раствора йода с С1 0,025моль/дм3. Затем
z
50,0 см3 того же раствора обработали сульфатом цинка и разбавили в мерной колбе вместимостью 100,0 см3. Осадок отфильтровали, а натитрование50,0см3 фильтрата израсходовали20,0 см3 раствора
69

йода. Вычислитемассовыедоли Na2S 9H2O и Na2S2O3 5H2O в навеске.
(M |
2.93. Для определения содержания этилмеркаптана в смеси |
|||
|
= 62,13г/моль)пробумассой1,6500гвстряхивалис50,0см3 |
|||
C H SH |
|
|
|
|
2 |
5 |
|
|
|
раствораI с С |
1 |
0,1190моль/дм3 вплотнозакрытойколбе.Приэтом |
||
|
|
2 |
z |
|
|
|
|
|
|
протекала реакция по уравнению: 2C2H5SH + I2 C2H5SSC2H5 + +2H+ + 2I–. На титрованиеизбытка йода затратили 16,7см3 раство-
ра тиосульфата натрия с С1 0,1320 моль/дм3. Рассчитайте про-
z
центное содержание этилмеркаптана в пробе.
2.94. Для стандартизации раствора Na2S2O3 навеску K2Cr2O7
массой 0,1510 г растворили в разбавленной НСl, добавили избыток KIи выделившийсяI2 оттитровали, израсходовав 46,1 см3 раствора тиосульфата натрия. Рассчитайте молярную концентрацию эквивалента Na2S2O3.
2.95.Докакогообъемаследуетразбавить835,0см3 0,1179моль/дм3 раствора сульфата церия (IV) для получения раствора с титромпоже-
лезу (II), равным 4,381 10–3 г/см3?
2.96.К40,0см3 раствора KMnO4 (1,0см3 раствора KMnO4 эквивалентен 0,0050 г железа) добавили избыток раствора KI и выде-
лившийсяйодоттитровали 35,9см3 раствора Na2S2O3. Рассчитайте титр раствора Na2S2O3 по меди.
2.97.К 20,0 см3 раствора K2Cr2O7 (1,0 см3 раствора K2Cr2O7 эквивалентен 0,0050гжелеза)добавили KIв избыткеи выделившийся йод оттитровали 35,0 см3 раствора тиосульфата натрия. Рассчитайте титр раствора Na2S2O3 по меди.
2.98.Какой процентионов железа Fe2+ останетсянеоттитрован-
ным, если при титровании раствором KMnO4 потенциал в конечной точке титрования составит 0,948 В?
2.99.Кнавескев1,500гтехническогосульфитанатрияпослераст-
воренияприбавили 100,0 см3 раствора йода с С1 0,100моль/дм3.
z
На титрованиеизбыткаI2 израсходовали40,0см3 раствора,в200,0см3 которогосодержится2,4820гтиосульфата натрия. Определитепроцентное содержание Na2SO3 в образце.
70
