
Журнал неврологии и психиатрии / 2010 / NEV_2010_02_061
.pdf
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ПРОБЛЕМЫ
Нитроксидергические нейроны бульбарного вазомоторного центра при артериальной гипертензии
А.Е. КОЦЮБА1, В.М. ЧЕРТОК, Е.В. БАБИЧ
Nitricoxideergic neurons of the human bulbar vasomotor center in arterial hypertension
A.E. KOTSUBA, V.M. CHERTOK, E.V. BABICH
Кафедра анатомии человека Владивостокского государственного медицинского университета
Распределение нитроксидергических нейронов и активности в них нейрональной NO-синтазы (nNOS) исследовано в некоторых ядрах продолговатого мозга у людей с диагностированной при жизни артериальной гипертензией I—III степени (АГ I—III). Установлено, что при АГ I в большинстве ядер наблюдается значительное снижение активности nNOS, хотя относительное содержание NO-нейронов существенно не меняется. В ядре солитарного тракта отмечаются более глубокие изменения этих показателей, чем в ядрах ретикулярной формации. При АГ II в ядрах отмечается выраженное сокращение доли NO-нейронов, однако дальнейшего снижения активности nNOS не наблюдается. При АГ III наблюдается усиление активности nNOS и незначительное (по сравнению с АГ II) сокращение доли NO-нейронов. Таким образом, при АГ наблюдается снижение количественных показателей, характеризующих состояние нитроксидергической системы, что является одной из причин гиперактивации симпатической нервной системы и повышения АД. Исключение составляет дорсальное ядро блуждающего нерва, в котором выявлено повышение относительного содержания NO-нейронов и активности nNOS, что, по-видимому, связано с холинергическим механизмом компенсаторной активации нитроксидергической системы.
Ключевые слова: продолговатый мозг, нитроксидергические нейроны, нейрональная NO-синтаза, артериальная
гипертензия.
The distribution of nitricoxideergic neurons and activity of neuronal NO-synthase (nNOS) was studied in some nuclei of the medulla oblongata in patients with the lifetime diagnosis of arterial hypertension, stages I-III (AG I-III). In AG I, the significant decrease of nNOS activity was observed in most nuclei, although the relative content of NO-neurons was not changed. The marked changes of these parameters were noted in the nucleus of solitary tract compared to those of the reticular formation. In AG II, a portion NO-neurons in the nuclei was markedly reduced, however the following decrease of nNOS activity was not found. In AG III, there was the augmentation of nNOS activity and the subtle decrease in the portion of NO-neurons. Therefore, in AG, there is the decrease of quantitative parameters that characterize the state of the oxide-ergic system. This is one of the causes of the hyperactivation of sympathetic nervous system and elevation of arterial pressure. The exception is the dorsal nucleus of the vagus nerve, in which the relatively larger number of NO-neurons and higher nNOS activity were found, that may be related with the cholinergic mechanism of compensatory activation of the nitric oxide-ergic system.
Key words: medulla oblongata, nitricoxideergic neurons, neuronal NO-synthase, arterial hypertension.
Несмотря на повышенный интерес исследователей к нитроксидергическому пути передачи нервного импульса, этот процесс до настоящего времени вызывает противоречивые оценки. Это касается как наличия и количественного распределения фермента синтеза оксида азота (NO) в нервных центрах, его активности в отдельных нейронах, так и неоднозначной физиологической роли этой газообразной молекулы в обеспечении работы ЦНС, в том числе в регуляции артериального давления (АД) [3, 16, 21, 24]. Хотя участие NO в реализации функций вазомоторного центра признается многими исследователями [10, 21], данные о локализации и количественном распределении нитроксидергических нейронов (NO-нейронов) в ядрах продолговатого мозга у здоровых людей и их изменениях в зависимости от степени артериальной гипертензии (АГ)
ограничиваются несколькими противоречивыми сообщениями [10, 20].
Целью данной работы явилось изучение распределения NO-нейронов и активности в них нейрональной NOсинтазы (nNOS) в некоторых ядрах продолговатого мозга людей, страдавших при жизни АГ I—III степени (АГ I— III).
Материал и методы
Для исследования использован материал судебномедицинских вскрытий мужчин в возрасте 18—44 лет, погибших в результате дорожно-транспортных происшествий. Артерии мягкой мозговой оболочки взяты у 8 практически здоровых мужчин (контрольная группа) и
© Коллектив авторов, 2010 |
1e-mail: akotc@mail.ru |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:2:61 |
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2010 |
61 |
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ПРОБЛЕМЫ
19 мужчин с диагностированной при жизни АГ I—III, погибших от травм, не связанных с повреждением головного мозга.
Из продолговатого мозга делали срезы с двух уровней, позволяющих наиболее полно изучать ядра. Препараты исследовали раздельно в двух микроскопах, в окуляры которых помещали одинаковые сетки с равновеликими квадратами. Изучаемое ядро в обоих микроскопах ориентировали по характерным признакам в сагиттальной и фронтальной плоскостях и переносили на миллиметровую бумагу в соответствии с их положением относительно координат сетки. Исследовали дорсомедиальную часть ядра солитарного тракта (ЯСТ), вентральное ретикулярное гигантоклеточное ядро (РГЯ), ретикулярное центральное ядро (РЦЯ), ретикулярное мелкоклеточное ядро (РМЯ), ретикулярное латеральное ядро (ЛРЯ) и дорсальное ядро блуждающего нерва (ДЯБ). NO-нейроны маркировали методом В. Hope и S. Vinsent [17] для выявления NADPH-диафоразы (NADPH-d). Специфичность гистохимической реакции проверяли инкубацией нескольких срезов в растворах, не содержащих нитросиний тетразолий или NADPH, а также в растворе, содержащем NADP вместо NADPH. Поскольку химическая основа реакции заключается в образовании преципитата формазана при восстановлении солей тетразолия в присутствии NADPH-d, то гистохимическая реакция не должна наблюдаться в случае отсутствия в инкубационной среде любого из основных ее компонентов. В проекции среза каждого ядра при помощи автоматизированной системы анализа изображений Allegro MC определяли абсолютное число нейронов, маркированных окраской по Нисслю, и долю среди них, приходящуюся на NO-нейроны. Кроме того, вычисляли средний показатель активности (СПА) фермента (в ед. опт. пл.) в нейронах каждого ядра в отдельности, в соответствии с приведенной ранее методикой [4]. Поскольку количество осадка диформазана, образующегося при реакции на NADPH-d, пропорционально молекулярному содержанию nNOS, то на основании плотности преципитата можно судить об активности последней в нервных клетках [26].
Реакция на NADPH-d позволяет не только идентифицировать nNOS в клетках, но и определить количественное соотношение NO-позитивных нейронов, отличающихся активностью фермента [5, 8, 17]. Среди этих клеток вычисляли долю нейронов с низкой (тип I), средней (тип II), высокой (тип III) и очень высокой (тип IV) активностью фермента.
При статистической обработке результатов для оценки значимости цифровых данных использовали t-крите- рий Стьюдента.
Результаты
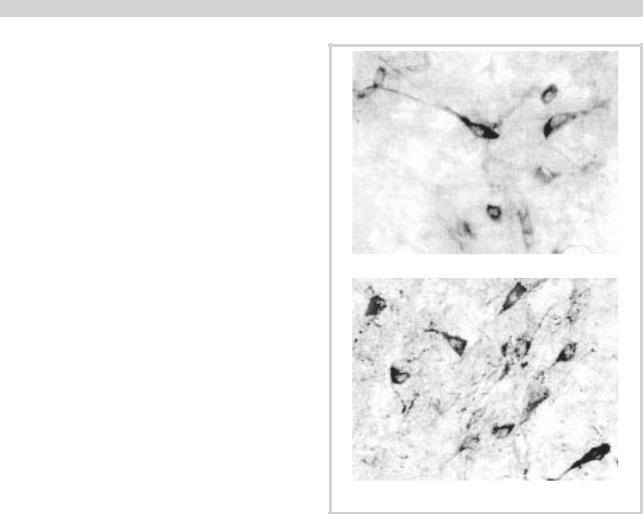
Во всех ядрах у обследованных контрольной группы выявлялись NO-позитивные нейроны, отличающиеся структурой и плотностью выпавшего осадка, в результате чего их цитоплазма окрашивалась в различные оттенки синего цвета — от голубого до фиолетового (рис. 1, а, б). Доля NO-нейронов в исследованных ядрах колебалась от 17,4% (ДЯБ) до 44,9% (РЛЯ) (см. таблицу). Там, где таких нейронов было много, они располагались недалеко друг от друга. Независимо от плотности расположения NOпозитивных клеток маркировались также отростки ней-
а
б
Рис. 1. Нейроны солитарного тракта (а) и ретикулярного латерального ядра (б) с низкой, средней, высокой и очень высокой активностью NADPH-d, у людей контрольной группы. Метод V. Hope и S. Vinsent. Ув. 100.
ронов, капилляры, иногда глиальные клетки. В исследованных ядрах определялись и различия количественного соотношения NO-позитивных нейронов, отличающихся активностью nNOS (см. таблицу). Как видно, в ЯСТ и ДЯБ определялась наибольшая доля клеток типа I, и отсутствовали или встречались в ограниченном количестве клетки типов III и IV. В ретикулярных ядрах, напротив, преобладали нейроны с высокой активностью фермента.
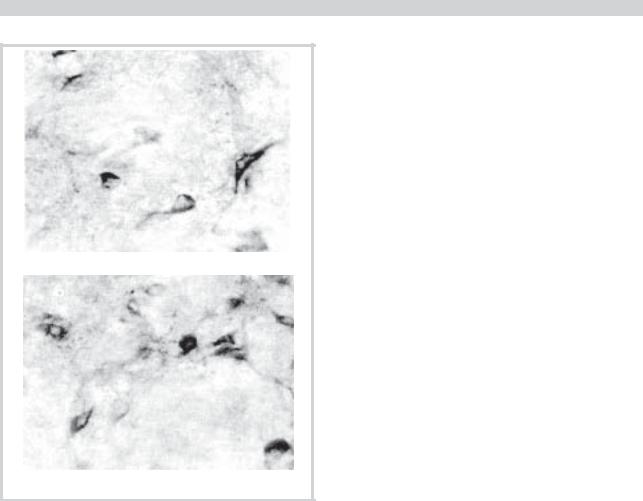
При АГ I в большинстве ядер наблюдалось значительное снижение активности nNOS, хотя доля NO-нейронов существенно не менялась (см. таблицу). Лишь в ЯСТ относительное содержание нейронов, экспрессирующих nNOS, достоверно сокращалось (р<0,05). В этом ядре большинство нейронов было представлено клетками с низкой активностью фермента (рис. 2, а). Доля клеток типа II была снижена, а нейроны с высокой активностью nNOS практически исчезли из поля зрения: на редких срезах можно было встретить 1—2 такие клетки. Перераспределение клеток в ядре в сторону нейронов I типа приводит к тому, что СПА фермента у больных ранней формой АГ сокращается по сравнению с группой практически здоровых людей более чем в 2 раза.
В ретикулярных ядрах последовательность преобразований исследованных показателей во многом повторяла
62 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2010 |
НЕЙРОХИМИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
а
б
Рис. 2. Нейроны ядра солитарного тракта (а) и ретикулярного латерального ядра (б) у людей, страдающих артериальной гипертензией. Метод V. Hope и S. Vinsent. Ув. 100.
отмеченную в ЯСТ, однако изменения были выражены в меньшей степени. Так, численная плотность NOпозитивных нейронов в этих ядрах или незначительно (на 5—8%) снижалась (РЛЯ и РГЯ), или оставалась на уровне контрольных значений, как в РМЯ, РЦЯ (см. таблицу). Среди ретикулярных ядер наибольшие изменения величины показателей были выявлены в РЛЯ. В этом ядре различия СПА фермента и доли клеток типов I—IV между практически здоровыми людьми и при АГ I достигали 25—30%. В РЛЯ постоянно встречались NO-нейроны III и IV типов, хотя самую многочисленную группу составляли клетки со средней активностью фермента (рис. 2, б). В РМЯ и РГЯ также были выявлены достоверные отличия исследованных параметров по сравнению с контрольными цифрами, однако они не столь значительны как в РЛЯ (см. таблицу). В РЦЯ изменения исследуемых параметров являлись минимальными и достоверны лишь в отношении СПА фермента.
При АГ II во всех ядрах наблюдалось выраженное сокращение доли NO-нейронов, однако дальнейшего снижения активности nNOS в большинстве ядер не происходило (см. таблицу). Исключение составляло ДЯБ, в котором величина большинства показателей имела тенденцию к повышению. В ЯСТ относительное содержание NOнейронов сокращалось почти в 2,5 раза по сравнению с контрольными значениями, и более чем на 1/3 — с цифрами, установленными при АГ I (р<0,05). Поскольку в этом
ядре нейроны I—II типа и при АГ II остаются преобладающей группой клеток, то значение СПА остается достоверно ниже контрольных цифр, но существенно не отличаются от величины показателя, установленного при АГ I (р>0,05). Кроме того, в составе ядра появляется небольшая группа клеток с высокой активностью фермента. В ретикулярных ядрах доля NO-нейронов также снижается, хотя и не так существенно, как в ЯСТ. При этом особенно значительное сокращение энзимпозитивных клеток наблюдалось в РЛЯ. По сравнению с контролем их доля снизилась до 40%, а с АГ I — до 62% (р<0,05). Величина СПА фермента оставалась существенно меньше контрольных значений и лишь на 3—4% ниже, чем при АГ I (р>0,05). По-прежнему большинство клеток отличались невысокой активностью nNOS. Меньше других изменения затрагивали РЦЯ, хотя и здесь доля NO-нейронов достоверно снижалась как по сравнению с величиной показателя, установленной у практически здоровых людей, так и при АГ I (см. таблицу).
При АГ III наблюдалось некоторое повышение активности nNOS и незначительное по сравнению с АГ II сокращение доли NO-нейронов (р>0,05). В ДЯБ величина исследованных показателей повышалась в среднем на 14—18%. Увеличение СПА фермента в ядре происходило в основном за счет увеличения доли нейронов III и IV типов. В ЯСТ относительное содержание NO-нейронов оставалось значительно ниже контрольных значений, но практически не менялось по сравнению с цифрами, установленными при АГ II (р>0,05). Наблюдалось некоторое повышение значений СПА за счет увеличения доли нейронов II—III типов. В РЛЯ изменения были наибольшими, хотя по сравнению с АГ II разница значений для большинства показателей не превышала 10—14%. В то же время в РЦЯ эти различия составляли не более 2—3% и достоверны лишь в отношении значений доли NO-нейронов по сравнению с контролем (см. таблицу).
Обсуждение
Экспериментальные работы последних лет свидетельствуют, что молекулярные регуляторы, синтезируемые в нервной ткани, в том числе NO, принимают активное участие в нейрогенных механизмах формирования АГ [1, 3, 19]. NO на центральном уровне оказывает ингибирующее влияние на симпатическую активность и способствует снижению АД [3, 23, 24]. При сокращении синтеза NO наблюдается противоположный эффект — повышение сосудистого тонуса [8, 11]. Реализация симпатоингибиторных влияний происходит в ядрах так называемого бульбарного вазомоторного центра. Участие NO в этом процессе признается многими исследователями [18, 19, 21], но морфологических подтверждений явно недостаточно.
Полученные в настоящем исследовании данные свидетельствуют об особенностях количественного распределения NO-нейронов и активности в них nNOS в некоторых ядрах бульбарного вазомоторного центра у здорового человека и их изменениях при АГ. Как показали наши наблюдения, NO-позитивные нейроны постоянно находятся в исследованных ядрах продолговатого мозга, где их количество в норме колеблется от 17,4 до 44,9%. В некоторых работах [2] приводятся более высокие цифры относительного содержания NO-нейронов в ЯСТ и ДЯБ (68— 72%). По-видимому, это связано с тем, что авторами под-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2010 |
63 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ПРОБЛЕМЫ
Распределение нитроксидергических нейронов в некоторых ядрах продолговатого мозга человека (M±σ)
|
Доля |
СПА NA- |
Доля нейронов с активностью NADPH-d, % |
||||
|
NO-нейронов |
|
|
|
|
||
Объект исследования |
DPH-d, ед. |
низкой |
средней |
высокой |
очень высокой |
||
от их общего |
|||||||
|
опт. пл. |
(тип I) |
(тип II) |
(тип III) |
(тип IV) |
||
|
количества, % |
||||||
|
|
|
|
|
|
||
Контроль |
20,6±4,1 |
24,3±3,3 |
34,8±3,7 |
55,6±5,8 |
9,6±2,0 |
0 |
|
АГ I |
15,3±3,7* |
12,1±2,7* |
63,2±2,0* |
36,8±3,7* |
0 |
0 |
|
ЯСТ |
8,3±2,3* |
12,8±3,1* |
65,7±4,2* |
32,3±4,0* |
2,0±1,2* |
0 |
|
АГ II |
|||||||
АГ III |
8,1±2,8* |
16,3±3,9* |
41,9±4,6* |
52,1±2,9 |
6,0±1,2 |
0 |
|
Контроль |
34,4±5,4 |
44,2±4,3 |
10,2±2,6 |
28,4±3,2 |
50,1±3,3 |
7,8±2,8 |
|
АГ I |
34,7±4,1 |
32,4±3,5* |
28,6±4,4* |
52,4±4,0* |
14,9±3,1* |
4,1±1,2* |
|
РМЯ |
23,5±4,9* |
34,9±3,1* |
25,2±4,1* |
56,9±5,2* |
14,7±2,0* |
2,8±1,1* |
|
АГ II |
|||||||
АГ III |
21,4±5,0* |
39,3±3,1* |
13,5±5,0 |
41,4±3,3 |
39,4±6,1 |
5,7±2,0 |
|
Контроль |
38,2±6,3 |
52,4±3,5 |
14,7±2,3 |
22,4±2,2 |
52,6±5,7 |
10,3±2,8 |
|
АГ I |
36,5±4,8 |
32,4±3,5* |
28,6±4,4* |
52,4±4,0* |
14,9±3,1* |
4,1±1,2* |
|
РГЯ |
24,6±4,7* |
34,3±3,1* |
29,5±4,0* |
52,7±4,5* |
14,6±3,8* |
3,2±1,6* |
|
АГ II |
|||||||
АГ III |
24,5±4,3* |
39,3±3,1* |
20,4±4,2 |
36,0±4,0* |
34,2±4,2 |
9,4±3,2 |
|
Контроль |
39,2±4,4 |
42,7±3,1 |
11,2±2,3 |
30,4±3,6 |
50,1±3,3 |
8,3±2,1 |
|
АГ I |
40,4±3,1 |
38,4±3,5 |
15,8±3,5 |
37,8±5,2 |
42,3±3,7* |
4,1±1,7* |
|
РЦЯ |
32,2±3,6* |
43,3±3,1 |
11,4±4,4 |
33,8±3,9 |
48,6±3,5 |
6,2±0,8 |
|
АГ II |
|||||||
АГ III |
31,8±3,8* |
44,1±3,1 |
10,6±3,8 |
32,0±2,9 |
50,5±3,8 |
6,9±0,9 |
|
Контроль |
44,9±3,2 |
56,9±4,5 |
9,0±2,0 |
31,8±4,1 |
47,9±6,0 |
11,3±3,4 |
|
АГ I |
40,7±4,8 |
39,3±3,4* |
16,9±3,1* |
49,7±4,0* |
27,4±2,1* |
6,0±1,0* |
|
РЛЯ |
26,8±3,0* |
37,8±3,1* |
20,4±4,0* |
51,3±4,6* |
24,2±2,3* |
4,1±1,7* |
|
АГ II |
|||||||
АГ III |
21,7±3,3* |
50,3±3,1 |
9,4±3,6 |
40,4±3,4* |
43,0±3,1 |
7,2±2,1 |
|
Контроль |
17,4±3,1 |
22,4±2,9 |
35,2±4,6 |
58,2±5,5 |
6,6±1,8 |
0 |
|
АГ I |
17,9±3,2 |
29,3±3,5* |
34,7±3,9 |
54,4±4,9 |
8,3±2,2 |
2,6±0,4 |
|
ДЯБ |
23,4±2,6* |
31,3±3,4* |
31,8±3,2 |
54,6±5,0 |
10,4±2,2 |
3,2±0,8 |
|
АГ II |
|||||||
АГ III |
26,5±2,8* |
41,5±3,2* |
17,5±2,6* |
55,7±4,3 |
19,6±2,3* |
7,2±1,6* |
|
Примечание. * — Достоверно по сравнению с контрольной группой, р<0,05.
считывались нейроны, в том числе и с неспецифическим окрашиванием клеток. Иммуноцитохимические методы обычно демонстрируют более низкое содержание таких нейронов в структурах мозга [9]. В физиологических условиях NO, облегчая процессы передачи сенсорной информации внутри ядра солитарного тракта, усиливает барорецепторное торможение симпатической вазомоторной активности, способствуя тем самым снижению АД [14, 24, 27].
При АГ I наблюдается значительное уменьшение активности nNOS в клетках, тогда как относительное содержание NO-нейронов в большинстве ядер существенно не меняется. В отличие от начальной формы заболевания, при АГ II отмечается выраженное сокращение доли NOнейронов, но дальнейшего снижения активности nNOS не наблюдается. При АГ III активность nNOS возрастает при незначительном по сравнению с АГ II сокращении доли NO-нейронов. Однако и у этих больных относительное содержание энзимпозитивных нейронов остается существенно ниже контрольных значений. Исключение составляет ДЯБ, в котором величина большинства показателей повышается.
Таким образом при АГ, во-первых, наблюдается снижение количественных показателей, характеризующих состояние нитроксидергической системы, что является одной из причин гиперактивации симпатической нервной системы и повышения АД [8, 11]. Снижение синтеза NO и сопутствующая гиперактивация симпатической нервной системы провоцируют ремоделирование сосудистой стенки и способствуют закреплению АГ [12]. Во-
вторых, в ЯСТ, являющемся областью вторичных афферентных нейронов барорецепторной дуги [2, 13], отмечаются более ранние и выраженные изменения величины показателей по сравнению с другими ядрами, что может быть связано с более серьезными нарушениями нитроксидергических механизмов (прежде всего, синтез NO) при АГ в афферентном звене рефлекторной дуги. Ранее было показано, что разрушение ЯСТ, где происходит переключение барорецепторного рефлекса с афферентных нервов, идущих от дуги аорты, на эфферентные нейроны ретикулярных ядер, вызывает тяжелую гипертензию [8, 11, 25]. Аналогичный эффект оказывает введение ингибиторов синтеза NO в область ядра [20]. В-третьих, величина этих отклонений существенно отличается в ретикулярных ядрах при различной степени АГ, что предполагает неодинаковое участие каждого из них в активации преганглионарных симпатических нейронов промежуточнолатерального ядра спинного мозга, о чем свидетельствуют и проведенные ранее экспериментальные исследования [11]. В-четвертых, существенное снижение доли NOнейронов наблюдается только при АГ II—III, т.е. при АГ I имеется субстрат для восстановления исходного тонуса сосудов в случае своевременной коррекции функций симпатической нервной системы. В-пятых, при АГ изменения активности nNOS и относительного содержания NOнейронов в ДЯБ, по сравнению с другими исследованными ядрами, носит во многом противонаправленный характер. Это может быть связано с тем, что ДЯБ, в отличие от остальных исследованных нами ядер, является холинергическим, а ацетилхолин — медиатор его аксонов —
64 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2010 |

НЕЙРОХИМИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
агонист nNOS, экспрессия которой осуществляется через никотиновые рецепторы путем стимуляции Са2+- зависимой протеинкиназы С [6, 8]. При холинергическом механизме активации nNOS включается депрессорный контур регуляции сосудистого тонуса, основным элементом которого, безусловно, является NO, провоцирующий снижение АД. При АГ, по-видимому, происходит компенсаторная активация нитроксидергической системы, приводящая в итоге к дисбалансу внутри самой регуляторной системы, способствуя закреплению стабильной АГ. Косвенным подтверждением этому могут служить полученные нами данные о том, что выраженность изменений в ДЯБ нарастает от АГ I к АГ III. Соответствующие сигналы к его нейронам могут поступать из ЯСТ, в котором большинство NO-позитивных афферентов вагусного происхождения [2].
Нарушение синтеза NO, а также сокращение числа клеток, экспрессирующих nNOS, наблюдающееся при АГ II—III, приводит к стойкой гипертензии. В настоящее время известно несколько потенциальных механизмов нарушения синтеза NO и его действия как естественного регулятора сосудистого тонуса [22]: нарушение экспрессии и образование аномальной NOS; нарушение функции NOS; нарушение процесса деградации NO. В последние годы активно изучаются генетически детерминированные нарушения синтеза NO [7]. Одной из возможных причин снижения синтеза NO является повышенное образование эндогенных ингибиторов NOS, в частности N-моно- метиларгинина и ассиметричного диметиларгинина. Известно, что применение этих условиях экзогенного L-аргинина нормализует синтез NO и величину АД [15].
ЛИТЕРАТУРА
1.Адашева Т.В., Задионченко В.С., Сандомирская А.П. Дисфункция эндо14. Bredt D.S. Endogenous nitric oxide synthesis: biological functions and
телия и артериальная гипертония: терапевтические возможности. Рос мед журн 2002; 1: 10: 11—16.
2.Гарцман Т.Ю., Дюйзен И.В. Нитроксидергические нейроны ядра солитарного тракта человека. Сборник статей «Медико-биологические и экологические аспекты здоровья человека на Севере». 2002; 48— 52.
3.Гельцер Б.И., Котельников В.Н., Агафонова И.Г. и др. Особенности вазомоторной функции сосудов церебрального бассейна при артериальной гипертензии. Бюл эксперим биол и мед 2007; 7: 144: 36—38.
4.Дюйзен И.В., Деридович И.И., Курбацкий Р.А., Шорин В.В. NOергические нейроны ядер шва мозга крысы в норме и при системном введении опиатов. Морфология 2003; 123: 2: 24—29.
5.Елисеева Е.В., Романова Н.Е., Баранов В.Ф., Мотавкин П.А. Нитрооксидсинтаза нейронов заднего ядра и узловатого ганглия блуждающего нерва и ее изменения при ингаляциях ацетилхолина в норме и при экспериментальной бронхиальной астме. Морфология 2002; 4: 122: 32—36.
6.Ковалев И.В., Баскаков М.Б., Капилевич Л.В., Медведев М.А. Роль оксида азота в регуляции электрической и сократительной активности гладких мышц. Бюл сиб мед 2004; 1: 1: 7—26.
7.Пшенникова М.Г., Бондаренко Н.А., Шимкович М.В. Оксид азота как фактор генетически детерминированной устойчивости к стрессорным повреждениям и адаптационной защиты. Бюл эксперим биол и мед 2001; 132: 11: 510—513.
8.Сосунов А.А. Оксид азота как межклеточный посредник. Соросовский образовательный журн 2000; 12: 6: 27—34.
9.Хрулев С.В., Дюйзен И.В. Солокализация серотонина и нитроксидсинтазы в нейронах подкоркового белого вещества мозга человека. Тихоокеанский мед журн 2004; 2: 16: 23—26.
10.Цырлин В.А., Хрусталев Р.С. Роль адренергических механизмов мозгового ствола и спинного мозга в центральной регуляции кровообращения. Вестн aритмол 2001; 22: 75—80.
11.Цырлин В.А. Бульбарный вазомоторный центр — морфофункциональная и нейрохимическая организация. Артериальная гипертензия 2003; 3: 9: 77—81.
12.Шляхто Е.В., Моисеева О.М. Клеточные аспекты ремоделирования сосудов при артериальной гипертензии. Артериальная гипертензия 2002; 8: 2: 45—49.
13.Arevalo R., Alonso J.R., Garcia-Ojeda E. et al. NADPH-diaphorase in the central nervous system of the tench (Tinca tinca L., 1758). J Comp Neurol 1995; 352: 398—420.
pathophysiology. Free Radic Res1999; 31: 577—596.
15.Creager M.A., Gallagher S.J., Girerd X.J. et al. L-Arginine improves en- dothelium-dependent vasodilation in hypercholesterolemic humans. J Clin Invest 1992; 90: 1248—1253.
16.Eshima K., Hirooka Y., Shigematsu H. et al. Angiotensin in the nucleus tractus solitarii contributes to neurogenic hypertension caused by chronic nitric oxide synthase inhibition. Hypertension 2000; 36: 259.
17.Hope B.T., Vincent S.R. Histochemical characterization of neuronal NA- DPH-diaphorase. J Neurochem Cytochem 1989; 37: 653—661.
18.Huang С.-C., Chan S.H.H., Hsu K.-S. cGMP/Protein kinase G-dependent potentiation of glutamatergic transmission induced by nitric oxide in immature rat rostral ventrolateral medulla neurons in vitro. Molecular Pharmacol 2003; 64: 521—532.
19.Kadekaro M., Liu H., Terrell M.L. et al. Regulatory, integrative and comparative physiology. Role of NO on vasopressin and oxytocin release and blood pressure responses during osmotic stimulation in rats. Am J Physiol 1997; 273: 1024—1030.
20.Kagiyama S., Tsuchihashi T., Abe I., Fujishima M. Enhanced depressor response to nitric oxide in the rostral ventrolateral medulla of spontaneously hypertensive rats. Hypertension 1998; 31: 1030—1034.
21.Kimura Y., Hirooka Y., Sagara Y. et al. Overexpression of inducible nitric oxide synthase in rostral ventrolateral medulla causes hypertension and sympathoexcitation via an increase in oxidative stress. Circulation Res 2005;
96:252—260.
22.Kiowski W., Linder L., Stoschitzky K. et al. Diminished vascular response to inhibition of endothelium-derived nitric oxide and enhanced vasoconstriction to exogenously administered endothelin-1 in clinically healthy smokers. Circulation 1994; 90: 27—34.
23.Kishi T., Hirooka Y., Sakai K. et al. Overexpression of eNOS in the RVLM causes hypotension and bradycardia via GABA release. Hypertension 2001;
38:896—901.
24.Patel K.P., Li Y.-F., Hirooka Y. Role of nitric oxide in central sympathetic outflow. Experimental Biol and Med 2001; 226; 814—824.
25.Pilowski P.M., Goodchild A.K. Baroreceptor reflex pathways and neurotransmitters: 10 years on. J Hypertension 2002; 20: 1675—1688.
26.Vincent S.R. Nitric oxide: a radical neurotransmitter in the central nervous system. Progr Neurobiol 1994; 42: 129—160.
27.Zanzinger J. Role of nitric oxide in the neural control of cardiovascular function. Cardiovasc Res 1999; 43: 639—649.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2010 |
65 |
