|
Билет № 6 |
Билет № 6 |
Билет № 6 |
|
1. Возбудитель дифтерии. Таксономия. Характеристика. Микробиологическая диагностика. Выявление антитоксического иммунитета. Специфическая профилактика и лечение.
Дифтерия — острая инфекционная болезнь, характеризующаяся фибринозным воспалением в зеве, гортани, реже в других органах и явлениями интоксикации. Возбудителем ее является Corynebacterium diphtheriae. Таксономия. Corynebacterium относится к отделу Firmicutes, роду Corynebacterium. Морфологические и тинкториальные свойства. Возбудитель дифтерии характеризуется полиморфизмом: тонкие, слегка изогнутые палочки (наиб. распространенные) встречаются кокковидные и ветвящиеся формы. Бактерии нередко располагаются под углом друг к другу. Они не образуют спор, не имеют жгутиков, у многих штаммов выявляют микрокапсулу. Характерная особенность - наличие на концах палочки зерен волютина (обусловливает булавовидную форму). Возбудитель дифтерии по Граму окрашивается положительно. Культуральные свойства. Факультативный анаэроб, оптим. температура. Микроб растет на специальных питательных средах, например на среде Клауберга (кровяно-теллуритовый агар), на которой дифтерийная палочка даёт колонии 3 типов: а) крупные, серые, с неровными краями, радиальной исчерченностью, напоминающие маргаритки; б) мелкие, черные, выпуклые, с ровными краями; в) похожие на первые и вторые. В зависимости от культуральных и ферментативных свойств различают 3 биологических варианта C.diphtheriae: gravis, mitis и промежуточный intermedius. Ферментативная активность. Высокая. Ферментируют глк и мальтозу в образованием кислоты, не разлагают сахарозу, лактозу и маннит. Не продуцируют уреазу и не образуют индол. Продуцирует фермент цистиназу, рпсщепляющую цистеин до H2S. Образует каталазу, сукцинатдегидрогеназу. Антигенные свойства. О-антигены – термостабильные полисахаридные, расположены в глубине клеточной стенки. К-антигены – поверхностные, термолабильные, сероватоспецифические. С помошью сывороток к К-антигену С.diph. разделяют на серовары(58). Факторы патогенности. Экзотоксин, нарушающий синтез белка и поражающий в связи с этим клетки миокарда, надпочечников, почек, нервных ганглиев. Способность вырабатывать экзотоксин обусловлена наличием в клетке профага, несущего tох-ген, ответственный за образование токсина. Ферменты агрессии — гиалуронидазу, нейраминидазу. К факторам патогенности относится также микрокапсула. Резистентность. Устойчив к высушиванию, действию низких температур, поэтому в течение нескольких дней может сохраняться на предметах, в воде. Эпидемиология. Источник дифтерии — больные люди Заражение происходит чаще через дыхательные пути. Основной путь передачи воздушно-капельный, возможен и контактный путь — через белье, посуду. Патогенез. Входные ворота инфекции — слизистые оболочки зева, носа, дыхательных путей, глаз, половых органов, раневая поверхность. На месте входных ворот наблюдается фибринозное воспаление, образуется характерная пленка, которая с трудом отделяется от подлежащих тканей. Бактерии выделяют экзотоксин, попадающий в кровь, — развивается токсинемия. Токсин поражает миокард, почки, надпочечники, нервную систему. Клиника. Существуют различные по локализации формы дифтерии: дифтерия зева, которая наблюдается в 85—90 % случаев, дифтерия носа, гортани, глаз, наружных половых органов, кожи, ран. Инкубационный период составляет от 2 до 10 дней. Заболевание начинается с повышения температуры тела, боли при глотании, появления пленки на миндалинах, увеличения лимфатических узлов. Отека гортани, развивается дифтерийный круп, который может привести к асфиксии и смерти. Другими тяжелыми осложнениями, которые также могут явиться причиной смерти, являются токсический миокардит, паралич дыхательных мышц. Иммунитет. После заболевания - стойкий, напряженный антитоксичный иммунитет. Особое значение – образование АТ к фрагменту В. Они нейтрализуют дифтерийный гистотоксин, предупреждая прикрепление последнего к клетке. Антибактериальный иммунитет – ненажняженный, сероватоспецифичен Микробиологическая диагностика. С помощью тампона у больного берут пленку и слизь из зева и носа. Для постановки предварительного диагноза возможно применение бактериоскопического метода. Основной метод диагностики — бактериологический: посев на среду Клаубера II (кровяно-теллуритовый агар), на плотную сывороточную среду для выявления продукции цистиназы, на среды Гисса, на среду для определения токсигенности возбудителя. Внутривидовая идентификация заключается в определении био- и серовара. Для ускоренного обнаружения дифтерийного токсина применяют: РНГА(реакция непрямой геммаглютинации) с антительным эритроцитарным диагностикумом , реакцию нейтрализации антител (о наличии токсина судят по эффекту предотвращения гемаггютинации); РИА (радиоиммунный) и ИФА(имунноферментный анализ). Лечение. Основной метод терапии — немедленное введение специфической антитоксической противодифтерийной лошадиной жидкой сыворотки. Иммуноглобулин человека противодифтерийный для в/в введения. Ассоциированные вакцины: АКДС (абсорбированная коклюшно – столбнячная вакцина), АДС(абсорбированный дифтерийно - столбнячный анатоксин). |
2. Строение генома бактерий. Понятие о генотипе и фенотипе. Виды изменчивости.
Бактериальный геном состоит из генетических элементов, способных к самостоятельной репликации, т. е. репликонов. Репликонами являются бактериальная хромосома и плазмиды. Наследственная информация хранится у бактерий в форме последовательности нуклеотидов ДНК, которые определяют последовательность аминокислот в белке. Каждому белку соответствует свой ген, т. е. дискретный участок на ДНК, отличающийся числом и специфичностью последовательности нуклеотидов. Бактериальная хромосома представлена одной двухцепочечной молекулой ДНК кольцевой формы. Размеры бактериальной хромосомы у различных представителей царства Procaryotae варьируют. Бактериальная хромосома формирует компактный нуклеоид бактериальной клетки. Бактериальная хромосома имеет гаплоидный набор генов. Она кодирует жизненно важные для бактериальной клетки функции. Плазмиды бактерий представляют собой двухцепочечные молекулы ДНК. Они кодируют не основные для жизнедеятельности бактериальной клетки функции, но придающие бактерии преимущества при попадании в неблагоприятные условия существования. Свойства микроорганизмов, как и любых других организмов, определяются их генотипом, т.е. совокупностью генов данной особи. Термин «геном» в отношении микроорганизмов — почти синоним понятия «генотип». Фенотип представляет собой результат взаимодействия между генотипом и окружающей средой, т. е. проявление генотипа в конкретных условиях обитания. Фенотип микроорганизмов хотя и зависит от окружающей среды, но контролируется генотипом, так как характер и степень возможных для данной клетки стенотипических изменений определяются набором генов, каждый из которых представлен определенным участком молекулы ДНК. В основе изменчивости лежит либо изменение реакции генотипа на факторы окружающей среды, либо изменение самого генотипа в результате мутации генов или их рекомбинации. В связи с этим фенотипическую изменчивость подразделяют на наследственную и ненаследственную. Ненаследственная (средовая, модификационная) изменчивость обусловлена влиянием внутри- и внеклеточных факторов на проявление генотипа. При устранении фактора, вызвавшего модификацию, данные изменения исчезают. Наследственная (генотипическая) изменчивость, связанная с мутациями, — мутационная изменчивость. Основу мутации составляют изменения последовательности нуклеотидов в ДНК, полная или частичная их утрата, т. е. происходит структурная перестройка генов, проявляющаяся фенотипически в виде измененного признака. Наследственная изменчивость, связанная с рекомбинациями, называется рекомбинационной изменчивостью. |
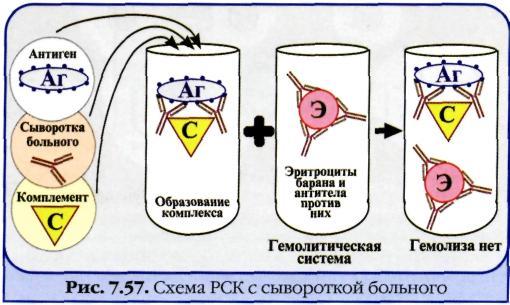
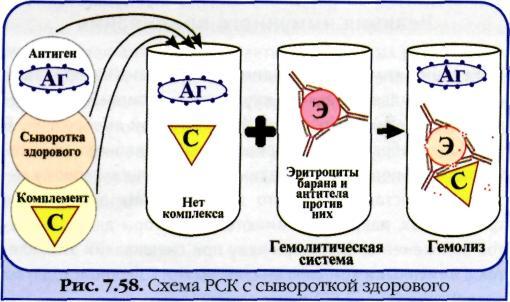
3. Реакция связывания комплемента. Механизм. Компоненты. Применение.
Реакция связывания комплемента (РСК) заключается в том, что при соответствии друг другу антигены и антитела образуют иммунный комплекс, к которому через Fc-фрагмент антител присоединяется комплемент (С), т. е. происходит связывание комплемента комплексом антиген—антитело. Если же комплекс антиген—антитело не образуется, то комплемент остается свободным. Специфическое взаимодействие АГ и AT сопровождается адсорбцией (связыванием) комплемента. Поскольку процесс связывания комплемента не проявляется визуально, Ж. Борде и О.Жангу предложили использовать в качестве индикатора гемолитическую систему (эритроциты барана + гемолитическая сыворотка), которая показывает, фиксирован ли комплемент комплексом АГ-АТ. Если АГ и AT соответствуют друг другу, т. е. образовался иммунный комплекс, то комплемент связывается этим комплексом и гемолиза не происходит. Если AT не соответствует АГ, то комплекс не образуется и комплемент, оставаясь свободным, соединяется со второй системой и вызывает гемолиз. Компоненты. Реакция связывания комплемента (РСК) относится к сложным серологическим реакциям. Для ее проведения необходимы 5 ингредиентов, а именно: АГ, AT и комплемент (первая система), эритроциты барана и гемолитическая сыворотка (вторая система). Антигеном для РСК могут быть культуры различных убитых микроорганизмов, их лизаты, компоненты бактерий, патологически измененных и нормальных органов, тканевых липидов, вирусы и вирусосодержащие материалы. В качестве комплемента используют свежую или сухую сыворотку морской свинки. Механизм. РСК проводят в две фазы: 1-я фаза — инкубация смеси, содержащей три компонента антиген + антитело + комплемент; 2-я фаза (индикаторная) — выявление в смеси свободного комплемента путем добавления к ней гемолитической системы, состоящей из эритроцитов барана, и гемолитической сыворотки, содержащей антитела к ним. В 1-й фазе реакции при образовании комплекса антиген—антитело происходит связывание им комплемента, и тогда во 2-й фазе гемолиз сенсибилизированных антителами эритроцитов не произойдет; реакция положительная. Если антиген и антитело не соответствуют друг другу (в исследуемом образце нет антигена или антитела), комплемент остается свободным и во 2-й фазе присоединится к комплексу эритроцит — ан-тиэритроцитарное антитело, вызывая гемолиз; реакция отрицательная. Применение. РСК применяют для диагностики многих инфекционных болезней, в частности сифилиса (реакция Вассермана).
|
|
Билет № 7 |
Билет № 7 |
Билет № 7 |
|
1. Возбудители анаэробной газовой инфекции. Таксономия и характеристика. Микробиологическая диагностика. Специфическая профилактика и лечение.
Анаэробная инфекция — болезнь, вызываемая облигатными анаэробными бактериями в условиях, благоприятствующих жизнедеятельности этих микробов. Анаэробы могут поражать любые органы и ткани. Облигатные анаэробы разделяются на две группы: 1) бактерии, образующие споры (клостридии) и 2) неспорообразующие или так называемые неклостридиальные анаэробы. Первые вызывают клостридиозы, вторые — гнойно-воспалительные заболевания различной локализации. Представители обеих групп бактерий относятся к условно-патогенным микробам. Газовая гангрена — раневая инфекция, вызываемая бактериями рода Clostridium, характеризуется быстро наступающим некрозом преимущественно мышечной ткани, тяжелой интоксикацией и отсутствием выраженных воспалительных явлений. Таксономия. Возбудители — несколько видов рода Clostridium, отдел Firmicutes. Основными представителями являются C.perfringens, C.novii, C.ramosum, C.septicum и др. Первое место по частоте встречаемости и тяжести вызываемого заболевания занимает C.perfringens. Морфологические и культуральные свойства. Палочковидные, грамположительные бактерии, образующие споры. В пораженных тканях клостридии газовой гангрены формируют капсулы, обладающие антифагоцитарной активностью, при попадании в окружающую среду образуют споры. Биохимические свойства. Обладают высокой ферментативной активностью, расщепляют углеводы с образованием кислоты и газа; проявляют гистолитическую активность. Антигенные свойства и токсинообразование. Каждый вид клостридии разделяется на серовары, продуцирующие экзотоксины и различающиеся по антигенным свойствам. Например, токсин С. perfringens подразделяется на 6 сероваров: А, В, С, D, Е и F. Из них патогенными для человека являются А и F, остальные патогенны для животных. С. novii по антигенным свойствам токсина разделяются на серовары А, В, С и D. Некоторые токсины обладают свойствами ферментов. Факторы патогенности: Клостридии газовой гангрены образуют экзотоксин — а-токсин, являющийся лецитиназой, а также гемолизины, коллагеназу, гиалуронидазу и ДНКазу. Экзотоксины специфичны для каждого вида клостридий. Резистентность. Чувствительны к кислороду, солнечному свету, высокой температуре, дезинфектантам. Возбудители газовой гангрены, являясь нормальными обитателями кишечника животных и человека, с фекалиями попадают в почву, где споры длительное время сохраняются. В некоторых почвах клостридии могут размножаться. Эпидемиология. При тяжелых травмах и несвоевременной хирургической обработке ран. В эпидемиологии газовой гангрены большое значение имеет загрязнение ран почвой. Патогенез. Возникновению газовой гангрены способствует ряд условий: попадание микробов в рану (заболевание обычно вызывается ассоциацией нескольких видов анаэробов и реже одним из них), наличие некротических тканей, снижение резистентности. В некротических тканях анаэробы часто находят условия гипоксии, благоприятные для их размножения. Образуемые ими токсины и ферменты приводят к повреждению здоровых тканей и тяжелой общей интоксикации организма; а-токсин, лецитиназа, расщепляет лецитин — важный компонент клеточных мембран. Выделяемые гиалуронидаза и коллагеназа увеличивают проницаемость тканей, а также способствуют распространению микроба в окружающей ткани. Клиника. Инкубационный период короткий — 1—3 дня. Отеки, газообразованием в ране, выраженной интоксикацией организма. Течение болезни усугубляют сопутствующие бактерии. Иммунитет. Перенесенная инфекция не оставляет иммунитета. Ведущая роль в защите от токсина принадлежит антитоксинам. Микробиологическая диагностика. Материал для исследования (кусочки пораженных тканей, раневое отделяемое) микроскопируют. Диагноз подтверждается при обнаружении грам «+» палочек в материале в отсутствии лейкоцитов. Проводят бактериологическое исследование – обнаружение С.perfringens в факалиях – пищевая токсикоинфекция; Лечение. Хирургическое: удаляют некротические ткани. Вводят антитоксические сыворотки, применяют антибиотики и гипербарическую оксигенацию. Антитоксические сыворотки - в жидком и сухом виде после очистки методом ферментативного гидролиза анатоксических сывороток, полученных при иммунизации лошадей анатоксинами. Применяют для экстренной профилактики и специфич. терапии. Профилактика. Хирургическая обработка ран, соблюдение асептики и антисептики при операциях. Для специфической активной иммунизации применяют анатоксин в составе секстанатоксина, создающий приобретенный, искусственный, активный, антитоксический иммунитет. |
2. Основные принципы классификации микробов. Классификация простейших.
Микробы, или микроорганизмы (бактерии, грибы, простейшие, вирусы), систематизированы по их сходству, различиям и взаимоотношениям между собой. Этим занимается специальная наука — систематика микроорганизмов. Систематика включает три части: классификацию, таксономию и идентификацию. В основу таксономии микроорганизмов положены их морфологические, физиологические, биохимические и молекулярно-биологические свойства. Различают следующие таксономические категории: царство, подцарство, отдел, класс, порядок, семейство, род, вид, подвид и др. В рамках той или иной таксономической категории выделяют таксоны — группы организмов, объединенные по определенным однородным свойствам. Микроорганизмы представлены доклеточными формами (вирусы — царство Vira) и клеточными формами (бактерии, архебактерии, грибы и простейшие). Различают 3 домена (или «империи»): «Bacteria», «Archaea» и «Eukarya»: □ домен «Bacteria» — прокариоты, представленные настоящими бактериями (эубактериями); □ домен «Archaea» — прокариоты, представленные архебактериями; □ домен «Eukarya» — эукариоты, клетки которых имеют ядро с ядерной оболочкой и ядрышком, а цитоплазма состоит из высокоорганизованных органелл — митохондрий, аппарата Гольджи и др. Домен «Eukarya» включает: царство Fungi (грибы); царство животных Animalia (включает прстейшие – подцарство Protozoa); царство растений Plante. Домены включают царства, типы, классы, порядки, семейства, роды, виды. Вид. Одной из основных таксономических категорий является вид (species). Вид — это совокупность особей, объединенных по близким свойствам, но отличающихся от других представителей рода. Чистая культура. Совокупность однородных микроорганизмов, выделенных на питательной среде, характеризующихся сходными морфологическими, тинкториальными (отношение к красителям), культуральными, биохимическими и антигенными свойствами, называется чистой культурой. Штамм. Чистая культура микроорганизмов, выделенных из определенного источника и отличающихся от других представителей вида, называется штаммом. Штамм — более узкое понятие, чем вид или подвид. Клон. Близким к понятию штамма является понятие клона. Клон представляет собой совокупность потомков, выращенных из единственной микробной клетки. Для обозначения некоторых совокупностей микроорганизмов, отличающихся по тем или иным свойствам, употребляется суффикс var (разновидность) вместо ранее применявшегося type. |
3. Живые вакцины, получение, применение. Достоинства и недостатки.
Живые вакцины - препараты, действующим началом в которых являются ослабленные тем или иным способом, потерявшие свою вирулентность, но сохранившие специфическую антигенность штаммы патогенных бактерий. Аттенуация (ослабление) возможна путём воздействия на штамм химических (мутагены) и физических (температура) факторов или посредством длительных пассажей через невосприимчивый организм. Так же в качестве живых вакцин используются дивергентные штаммы (непатогенные для человека), имеющие общие протективные антигены с патогенными для человека микробами. Примером такой вакцины является БЦЖ и вакцина против натуральной оспы. Возможно получение живых вакцин генно-инженерным способом. Принцип получения таких вакцин сводится к созданию непатогенных для человека рекмбинантных штаммов, несущих протективные антигены патогенных микробов и способных при введении в орг. человека размножаться и создавать иммунитет. Такие вакцины называют векторными. Вне зависимости от того, какие штаммы включены в вакцины, бактерии получают путём выращивания на искусственных питательных средах, культурах клеток или куриных эмбрионах. В живую вакцину, как правило, добавляют стабилизатор, после чего подвергают лиофильному высушиванию. В связи с тем, что живые вакцины способны вызывать вакцинную инфекцию (живые аттенуированные микробы размножаются в организме, вызывая воспалительный процесс проходящий без клинических проявлений), они всегда вызывают перестройку иммунобиологического статуса организма и образование специфических антител. Это так же может являться недостатком, т. к. живые вакцины чаще вызывают аллергические реакции. Вакцины данного типа, как правило, вводятся однократно. Примеры: сибиреязвенная вакцина, чумная вакцина, бруцеллёзная вакцина, БЦЖ вакцина, оспенная дермальная вакцина. |
|
Билет № 8 |
Билет № 8 |
Билет № 8 |
|
1. Возбудители лейшманиозов. Таксономия. Характеристика. Микробиологическая диагностика. Специфическое лечение.
Таксономия: тип Sarcomastigophorae, подтип Mastigophora — жгутиковые, класс Zoomastigophora, отряд Kinetoplastida, род Leishmania. Характеристика возбудителей: внутриклеточные паразиты, развивающиеся в макрофагах или клетках ретикулоэндотелиальной системы. Размножаются простым делением, проходят два цикла бесполого развития: жгутиковый и безжгутиковый. В жгутиковом цикле паразиты развиваются на питательных средах или в кишечнике москита, зараженного при сосании крови больных людей или животных. Заглоченные москитом амастиготы превращаются в кишечнике в промастиготы, делятся и на 6е-сутки накапливаются в глотке москита. Возбудитель имеет удлиненную веретенообразную форму. Протоплазма содержит ядро, цитоплазму, зерна волютина и кинетопласт. Жгутик, отходящий от заостренного конца, способствует перемещению лейшманий. Безжгутиковый цикл проходит в ретикулоэндотелиальных клетках печени, селезенки, лимфатических узлов, в макрофагах инфицированного организма. Паразиты имеют округлую форму, без жгутиков; при окраске по Романовскому—Гимзе цитоплазма приобретает серовато-голубой цвет, а ядро и кинетопласт — красновато-фиолетовый. Культивирование: питательная среда NNN, содержащую агар с дефибринированной кровью кролика. Лейшмании также растут на хорион-аллантоисной оболочке куриного эмбриона и в культурах клеток. Эпидемиология: в странах теплого климата. Механизм передачи возбудителей — трансмиссивный, через укус переносчиков — москитов. Основные источники возбудителей: при кожном антропонозном лейшманиозе — люди; при кожном зоонозном лейшманиозе — грызуны; при висцеральных лейшманиозах — люди; при кожно-слизистом лейшманиозе — грызуны, дикие и домашние животные. Патогенез и клиника. Различают два возбудителя кожного лейшманиоза: L. tropica — возбудитель антропонозного лейшманиоза и L. major — возбудитель зоонозного кожного лейшманиоза. Антропонозный кожный лейшманиоз характеризуется длительным инкубационным периодом — несколько месяцев. На месте укуса москитом появляется бугорок, который увеличивается и через 3 месяца изъязвляется. Язвы чаще располагаются на лице и верхних конечностях, рубцуются к концу года. Зоонозный кожный лейшманиоз (рано изъязвляющийся лейшманиоз, пендинская язва, сельская форма) протекает более остро. Инкубационный период составляет 2—4 недели. Мокнущие язвы чаще локализуются на нижних конечностях. Кожно-слизистый лейшманиоз вызывают лейшмании комплекса L. braziliensis; развивается гранулематозное и язвенное поражение кожи носа, слизистых оболочек рта и гортани. Антрапонозный висцеральный лейшманиоз вызывается лейшманиями комплекса L. donovani; у больных поражаются печень, селезенка, лимфоузлы, костный мозг и пищеварительный тракт. Иммунитет: стойкий пожизненный Микробиологическая диагностика. В мазках (из бугорков, содержимого язв, пунктатов из органов), окрашенных по Романовскому— Гимзе, обнаруживают внутриклеточно расположенные мелкие, овальной формы лейшмании (амастиготы). Для выделения чистой культуры возбудителя делают посев на среду NNN: инкубация 3 недели. Серологические методы недостаточно специфичны. Возможно применение РИФ, ИФА. Кожно-аллергический тест на ГЗТ к лейшманину применяют при эпидемиологических исследованиях лейшманиоза. Лечение: При висцеральном лейшманиозе применяют препараты сурьмы и диамидины (пентамидин). При кожном лейшманиозе — акрихин, амфотерицин. Профилактика: уничтожают больных животных, проводят борьбу с грызунами и москитами. Иммунопрофилактику кожного лейшманиоза осуществляют прививкой живой культуры L. major. |
2. Структура и химический состав бактериальной клетки. Особенности строения грамположительных и грамотрицательных бактерий.
Бактериальная клетка состоит из клеточной стенки, цитоплазматической мембраны, цитоплазмы с включениями и ядра, называемого нуклеоидом. Имеются дополнительные структуры: капсула, микрокапсула, слизь, жгутики, пили. Некоторые бактерии в неблагоприятных условиях способны образовывать споры. Клеточная стенка. В клеточной стенке грамположительных бактерий содержится небольшое количество полисахаридов, липидов, белков. Основным компонентом толстой клеточной стенки этих бактерий является многослойный пептидогликан (муреин, мукопептид), составляющий 40-90 % массы клеточной стенки. С пептидогликаном клеточной стенки грамположительных бактерий ковалентно связаны тейхоевые кислоты (от греч. teichos — стенка). В состав клеточной стенки грамотрицательных бактерий входит наружная мембрана, связанная посредством липопротеина с подлежащим слоем пептидогликана. На ультратонких срезах бактерий наружная мембрана имеет вид волнообразной трехслойной структуры, сходной с внутренней мембраной, которую называют цитоплазматической. Основным компонентом этих мембран является бимолекулярный (двойной) слой липидов. Внутренний слой наружной мембраны представлен фосфолипидами, а в наружном слое расположен липополисахарид. Функции клеточной стенки: 1. Обусловливает форму клетки. 2. Защищает клетку от механических повреждений извне и выдерживает значительное внутреннее давление. 3. Обладает свойством полупроницаемости, поэтому через нее избирательно проникают из среды питательные вещества. 4. Несет на своей поверхности рецепторы для бактериофагов и различных химических веществ. Метод выявления клеточной стенки - электронная микроскопия, плазмолиз. L-формы бактерий, их медицинское значение L-формы - это бактерии, полностью или частично лишенные клеточной стенки (протопласт +/- остаток клеточной стенки), поэтому имеют своеобразную морфологию в виде крупных и мелких сферических клеток. Способны к размножению. Цитоплазматическая мембрана располагается под клеточной стенкой (между ними - периплазматическое пространство). По строению является сложным липидобелковым комплексом, таким же, как у клеток эукариот (универсальная мембрана). Функции цитоплазматической мембраны: 1. Является основным осмотическим и онкотическим барьером. 2. Участвует в энергетическом метаболизме и в активном транспорте питательных веществ в клетку, так как является местом локализации пермеаз и ферментов окислительного фосфорилирования. 3. Участвует в процессах дыхания и деления. 4. Участвует в синтезе компонентов клеточной клетки (пептидогликана). 5. Участвует в выделении из клетки токсинов и ферментов. Цитоплазматическая мембрана выявляется только при электронной микроскопии. |
3. Серологические реакции, применяемые при диагностике вирусных инфекций.
Иммунные реакции используют при диагностических и иммунологических исследованиях у больных и здоровых людей. С этой целью применяют серологические методы, т. е. методы изучения антител и антигенов с помощью реакций антиген—антитело, определяемых в сыворотке крови и других жидкостях, а также тканях организма. Обнаружение в сыворотке крови больного антител против антигенов возбудителя позволяет поставить диагноз болезни. Серологические исследования применяют также для идентификации антигенов микробов, различных биологически активных веществ, групп крови, тканевых и опухолевых антигенов, иммунных комплексов, рецепторов клеток и др. При выделении микроба от больного проводят идентификацию возбудителя путем изучения его антигенных свойств с помощью иммунных диагностических сывороток, т. е. сывороток крови гипериммунизированных животных, содержащих специфические антитела. Это так называемая серологическая идентификация микроорганизмов. В микробиологии и иммунологии широко применяются реакции агглютинации, преципитации, нейтрализации, реакции с участием комплемента, с использованием меченых антител и антигенов (радиоиммунологический, иммуноферментный, иммунофлюоресцентный методы). Перечисленные реакции различаются по регистрируемому эффекту и технике постановки, однако, все они основаны на реакции взаимодействия антигена с антителом и применяются для выявления как антител, так и антигенов. Реакции иммунитета характеризуются высокой чувствительностью и специфичностью. Особенности взаимодействия антитела с антигеном являются основой диагностических реакций в лабораториях. Реакция in vitro между антигеном и антителом состоит из специфической и неспецифической фазы. В специфическую фазу происходит быстрое специфическое связывание активного центра антитела с детерминантой антигена. Затем наступает неспецифическая фаза — более медленная, которая проявляется видимыми физическими явлениями, например образованием хлопьев (феномен агглютинации) или преципитата в виде помутнения. Эта фаза требует наличия определенных условий (электролитов, оптимального рН среды). Связывание детерминанты антигена (эпитопа) с активным центром Fab-фрагмента антител обусловлено ван-дер-ваальсовыми силами, водородными связями и гидрофобным взаимодействием. Прочность и количество связавшегося антигена антителами зависят от аффинности, авидности антител и их валентности. |