|
Билет № 30 |
Билет № 30 |
Билет № 30 |
|
1. Возбудители холеры. Таксономия. Характеристика. Микробиологическая диагностика. Специфическая профилактика и лечение.
Возбудитель – Vibrio cholerae, серогрупп О1 и О139, характеризуется токсическим поражением тонкого кишечника, нарушением водно-солевого баланса. Морфологические и культуральные свойства. Вибрион имеет один полярно расположенный жгутик. Под действием пенициллина образуются L-формы. Грамотрицательны, спор не образуют. Факультативный анаэроб. Не требователен к питательным средам. Температурный оптимум 37C. На плотных средах вибрионы образуют мелкие круглые прозрачные S-колонии с ровными краями. На скошенном агаре образуется желтоватый налет. В непрозрачных R-колониях бактерии становятся устойчивыми к действию бактериофагов, антибиотиков и не агглютинируются О-сыворотками. Биохимические свойства. Активны: сбраживают до кислоты глюкозу, мальтозу, сахарозу, маннит, лактозу, крахмал. Все вибрионы делятся на шесть групп по отношению к трем сахарам (манноза, сахароза, арабиноза). Первую группу, к которой относятся истинные возбудители холеры, составляют вибрионы, разлагающие маннозу и сахарозу и не разлагающие арабинозу: разлагают белки до аммиака и индола. H2S не образуют. Антигенная структура. Термостабильный О-антиген и термолабильный Н-антиген. Н-АГ являются общими для большой группы вибрионов. Возбудители классической холеры и холеры Эль-Тор объединяются в серогруппу 01. Антигены серогруппы 01 включают в различных сочетаниях А-, В- и С-субъединицы. Сочетание субъединиц АВ называется сероваром Огава, сочетание АС — сероваром Инаба, сочетание ABC — Гикошима. R-формы колоний утрачивают О-АГ. Резистентность. Вибрионы плохо переносят высушивание. Долго сохраняются в водоемах, пищевых продуктах.. Биовар Эль-Тор более устойчив в окружающей среде, чем классический вибрион. Эпидемиология. Острая кишечная инфекция с фекально-оральным механизмом передачи. Путь передачи - водный, пищевой. Источник инфекции — больной человек или вибрионоситель. Факторы патогенности. Пили адгезии; фермент муциназа, разжижающий слизь и обеспечивающий доступ к эпителию. Эпителиальные клетки выделяют щелочной секрет, который в сочетании с желчью является прекрасной питательной средой для размножения вибрионов. Токсинообразование вибрионов, которые вырабатывают эндо- и экзотоксины. Экзотоксин (энтеротоксин) холероген — термолабильный белок, чувствителен к протеолитическим ферментам. Холероген содержит 2 субъединицы: А и В. А активизирует внутриклеточную аденилатциклазу, происходит повышение выхода жидкости в просвет кишечника. Диарея, рвота. Фермент нейраминидаза усиливает связывание холерного экзотоксина с эпителием слизистой кишечника. Эндотоксин запускает каскад арахидоновой кислоты, которая запускает синтез простагландинов (Е, F). Они вызывают сокращение гладкой мускулатуры тонкого кишечника и подавляют иммунный ответ, чем обусловлены диарея. Клинические проявления. Инкубационный период 2—3 дня. Боль в животе, рвота, диарея. Иммунитет. Гуморально-клеточный. При выздоровлении возникает напряженный непродолжительный иммунитет. Микробиологическая диагностика. Выделение и идентификация возбудителя. Материал для исследования - выделения от больных (кал, рвота), вода. Для экспресс-диагностики используют РИФ, ПЦР. Бактериоскопический метод в настоящее время не используется. Лечение: а)регидратация (восполнение потерь жидкости и электролитов введением изотонических, растворов, а также плазмозаменяющих жидкостей внутривенно;б) антибактериальная терапия (тетрациклины, фторхинолоны). Профилактика. Санит.-гиг. мероприятия. Экстренная профилактика антибиотиками широкого спектра действия, а также вакцинопрофилактика. Современная вакцина представляет собой комплексный препарат, состоящий из холероген-анатоксина и химического О-антигена, обоих биоваров и сероваров Огава и Инаба. Прививка обеспечивает выработку вибриоцидных антител и антитоксинов в высоких титрах. |
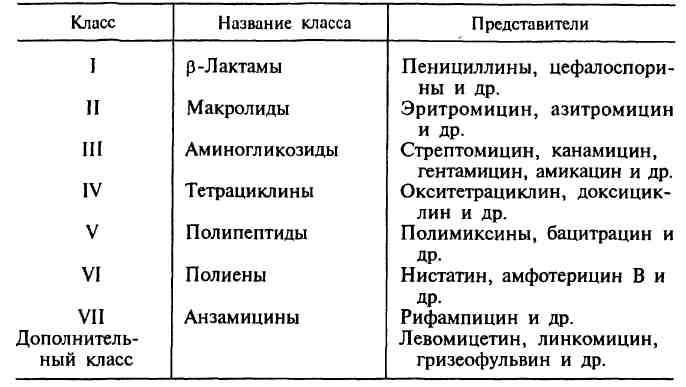
2. Классификация антибиотиков по химической структуре, механизму и спектру действия.
Антибиотики — химиотерапевтические вещества, продуцируемые микроорганизмами, животными клетками, растениями, а также их производные и синтетические продукты, которые обладают избирательной способностью угнетать и задерживать рост микроорганизмов, а также подавлять развитие злокачественных новообразований. В основу главной классификации антибиотиков положено их химическое строение.
Наиболее важными классами синтетических антибиотиков являются хинолоны и фторхинолоны (например, ципрофлоксацин), сульфаниламиды (сульфадиметоксин), имидазолы (метронидазол), нитрофураны (фурадонин, фурагин). По спектру действия антибиотики делят на пять групп в зависимости от того, на какие микроорганизмы они оказывают воздействие. Кроме того, существуют противоопухолевые антибиотики, продуцентами которых также являются актиномицеты. Каждая из этих групп включает две подгруппы: антибиотики широкого и узкого спектра действия. Антибактериальные антибиотики составляют самую многочисленную группу препаратов. Преобладают в ней антибиотики широкого спектра действия, оказывающие влияние на представителей всех трех отделов бактерий. К антибиотикам широкого спектра действия относятся аминогликозиды, тетрациклины и др. Антибиотики узкого спектра действия эффективны в отношении небольшого круга бактерий, например полет-миксины действуют на грациликутные, ванкомицин влияет на грамположительные бактерии. В отдельные группы выделяют противотуберкулезные, противолепрозные, противосифилитические препараты. Противогрибковые антибиотики включают значительно меньшее число препаратов. Широким спектром действия обладает, например, амфотерицин В, эффективный при кандидозах, бластомикозах, аспергиллезах; в то же время нистатин, действующий на грибы рода Candida, является антибиотиком узкого спектра действия. Антипротозойные и антивирусные антибиотики насчитывают небольшое число препаратов. Противоопухолевые антибиотики представлены препаратами, обладающими цитотоксическим действием. Большинство из них применяют при многих видах опухолей, например митоми-цин С. Действие антибиотиков на микроорганизмы связано с их способностью подавлять те или иные биохимические реакции, происходящие в микробной клетке. В зависимости от механизма действия различают пять групп антибиотиков: 1. антибиотики, нарушающие синтез клеточной стенки. К этой группе относятся, например, β-лактамы. Препараты этой группы характеризуются самой высокой избирательностью действия: они убивают бактерии и не оказывают влияния на клетки микроорганизма, так как последние не имеют главного компонента клеточной стенки бактерий — пептидогликана. В связи с этим β -лактамные антибиотики являются наименее токсичными для макроорганизма; 2. антибиотики, нарушающие молекулярную организацию и синтез клеточных мембран. Примерами подобных препаратов являются полимиксины, полиены; 3. антибиотики, нарушающие синтез белка; это наиболее многочисленная группа препаратов. Представителями этой группы являются аминогликозиды, тетрациклины, макроли-ды, левомицетин, вызывающие нарушение синтеза белка на разных уровнях; 4. антибиотики — ингибиторы синтеза нуклеиновых кислот. Например, хинолоны нарушают синтез ДНК, рифампицин — синтез РНК; 5. антибиотики, подавляющие синтез пуринов и аминокислот. К этой группе относятся, например, сульфаниламиды. |
3. Методы экспресс-диагностики инфекционных болезней.
Полимеразная цепная реакция (ПЦР) - основана на амплификации (увеличения кол-ва копий)специфического гена возбудителя. Для этого двухнитевую ДНК вырезают из исследуемого материала, денатурируют и достраивают (при охлаждении) к расплетенным нитям ДНК новые комплиментарные нити. В результате данных операций из одного гена образуется 2. Этот процесс многократно повторяется при заданных температурных режимах до образования нужного количества копий необходимого гена. Иммуноферментный анализ (ИФА). В основе метода лежит выявление антигенов с помощью соответствующих им антител, коньюгированных с ферментом-меткой. Специфический антиген адсорбируют на поверхности лунок в пластинках из полимерного материала, фиксированный на пластинке антиген инкубируют с испытуемыми человеческими сыворотками. После отмывания от несвязавшихся белков связанные иммобилизированными антигенами Ig выявляют с помощью антивидовой иммуноблоттинговой сыворотки, антителам которой прикреплён фермент (пероксидаза). После инкубации с субстратом и индикотором (диаминобензидином) оценивают ферментативную активность по интенсивности окраски. Реакция иммунофлюоресценции (РИФ, метод Кунса) Различают разновидности методов: 1.Прямой – основан на том, что антигены тканей или микробов способны светиться под УФ-излучением после обработки иммунными сыворотками с антителами, меченными флюорохромами. Бактерии в мазке после обработки такой люминесцентной сывороткой, светятся по периферии клетки в виде каймы зелёного цвета. 2.Непрямой метод РИФ заключается в выявлении комплекса антиген-антитело с помощью антиглобулиновой сыворотки, меченной флюорохромом. Для этого мазки из взвеси микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем, антитела, не связавшиеся антигенами микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой сывороткой, меченной флюорохромами. Радиоиммунный анализ (РИА) Высокочувствительный метод, основанный на реакции антиген-антитело с применением антигенов или антител, меченных радионуклидом. После их взаимодействия отделяют образовавшийся радиоактивный иммунный комплекс и определяют его радиоактивность в соответствующем счетчике: интенсивность излучения прямо пропорциональна количеству связавшихся молекул антигена и антител. Иммуноблоттинг – высокочувствительный метод, основанный на сочетании электрофореза и ИФА или РИФ. Используют, как метод диагностики при ВИЧ. Антигены возбудителя разделяют с помощь электрофореза в геле, затем переносят их из геля на активированную бумагу и проявляют с помощью ИФА. Выпускаются такие полоски с «блотами» антигенов. На эту полоску наносят сыворотку больного, затем, после инкубации, отмывают и наносят сыворотку против Ig человека, меченную ферментом. Образовавшийся на полоске комплекс выявляют добавлением хромогенного субстрата, изменяющего окраску под действием фермента. Реакции иммобилизации (трепонем, холерных вибрионов) применяется при диагностике заболеваний, возбудителем которых являются подвижные бактерии. Для этого материал, взятый у больного обрабатывают специфическими сыворотками – если реакция положительнанаблюдается иммобилизация бактерий на стекле. Газожидкостная хроматография (ГЖХ) Этот метод является высокоэффективным методом обнаружения анаэробных бактерий, которые в процессе своей жизнедеятельности выделяют летучие жирные кислоты (изомасляная, масляная, валериановая, изовалериановая, капроновая). Для проведения этого анализа проводят экстракцию ЛЖК летучим органическим растворителем, после чего полученный экстракт вводят в хроматограф. |
|
Билет № 31 |
Билет № 31 |
Билет № 31 |
|
1. Возбудитель токсоплазмоза. Таксономия. Характеристика. Микробиологическая диагностика. Специфическое лечение.
Таксономия: Возбудитель — Toxoplasma gondii, относится к типу Apicomplexa, классу Sporozoa, отряду Eucoccidiida. Характеристика возбудителя. Toxoplasma gondii — облигатный внутриклеточный паразит. В жизненном цикле токсоплазм различают несколько морфологических форм: ооцисты, псевдоцисты, цисты, тахизоиты. Ооцисты формируются в результате полового размножения паразита в клетках слизистой оболочки кишечника кошки— окончательных хозяев токсоплазм: разнополые гаметоциты сливаются с образованием ооцисты. Ооцисты выделяются с фекалиями кошки. Попав в кишечник человека, они освобождают спорозоиты, которые распространяются по лимфатическим сосудам, размножаются внутриклеточно бесполым путем. Размножившиеся паразиты (тахизоиты) внедряются затем в другие клетки. Они обнаруживаются при острой стадии инфекции. Тахизоиты имеют характерную форму апельсиновой дольк, при окраске по Романовскому—Гимзе цитоплазма голубого цвета, а ядро — рубиново-красного. Псевдоцисты не имеют оболочки; они образуются в пораженных клетках, макрофагах. Цисты образуются внутри клеток хозяина. Они имеют плотную оболочку. Культивирование: в куриных эмбрионах и на культурах тканей, а также путем заражения мышей и других животных. Резистентность: Ооцисты могут в течение года сохранять жизнеспособность в окружающей среде. Токсоплазмы быстро погибают при выс. температуре. Эпидемиология. Источники инвазии виды домашних и диких млекопитающих, птицы. Заражение человека происходит алиментарным путем в результате употребления в пищу термически слабо обработанных продуктов, содержащих в псевдоцистах и цистах трофозоиты паразита. Патогенез и клиника. Токсоплазмы, проникшие в организм, достигают с током лимфы регионарных лимфоузлов, размножаются в них (тахизоиты), проникают в кровь, разносятся по организму, попадая в клетки ретикулоэндотелиальной системы всех внутренних органов, где образуют псевдоцисты и цисты. Токсоплазмы поражают нервные клетки, печень, почки, легкие, сердце, мышцы, глаза. Клиническая картина разнообразна: от умеренной лимфоаденопатии до лихорадки, сыпи, гепатоспленомегалии, фарингита, менингоэнцефалита, пневмонии и др. Иммунитет: клеточный и гуморальный иммунитет. Развивается ГЗТ. Микробиологическая диагностика: Проводится микроскопия мазка (из биоптатов крови, ликвора, пунктатов лимфоузлов), окрашенного по Романовскому—Гимзе. Реже применяется биологический метод: мыши погибают через 7—10 дней после парентерального введения им инфицированного материала (крови, ликвора) больных людей. Возможно культивирование токсоплазм на куриных эмбрионах. Основным в диагностике токсоплазмоза является серологический метод: выявление IgM-антител свидетельствует о ранних сроках заболевания. IgG-антитела достигают максимума на 4—8й неделе болезни. Применяются РИФ, РИГА, РСК. Используют также аллергический метод — внутрикожную пробу с токсоплазмином, которая положительна с 4-й недели заболевания и далее в течение многих лет. Лечение: комбинация пириметамина с сульфаниламидами. Профилактика: неспецифическая - гигиенические требования (мытье рук перед едой; термическая обработка мяса. |
2. Понятие об инфекции. Условия возникновения инфекционного процесса. Патогенность и вирулентность бактерий.
Термин инфекция или синоним инфекционный процесс обозначает совокупность физиологических и патологических восстановительно-приспособительных реакций, возникающих в восприимчивом макроорганизме при определенных условиях окружающей внешней среды в результате его взаимодействия с проникшими и размножающимися в нем патогенными или условно-патогенными бактериями, грибами и вирусами и направленных на поддержание постоянства внутренней среды макроорганизма (гомеостаза). Сходный процесс, но вызванный простейшими, гельминтами и насекомыми — представителями царства Animalia, носит название инвазия. В основе инфекционного процесса лежит феномен паразитизма, т. е. такой формы взаимоотношений между двумя организмами разных видов, при которой один из них, называемый паразитом, использует другого, называемого хозяином, в качестве источника питания и как место постоянного или временного обитания, причем оба организма находятся между собой в антагонистических отношениях. В отличие от сапрофитического образа существования паразитизм — это жизнь в живой среде. Неотъемлемым критерием паразитизма является патогенное воздействие паразита на организм хозяина и ответная, защитная реакция со стороны организма хозяина. Паразитизм — свойство, закрепленное за видом и передающееся по наследству. Все возбудители инфекционных и инвазионных болезней человека, животных и растений относятся к паразитам, т. е. способны к паразитической форме существования в живой системе. Возникновение, течение и исход инфекционного процесса определяются тремя группами факторов: 1) количественные и качественные характеристики микроба — возбудителя инфекционного процесса; 2) состояние макроорганизма, степень его восприимчивости к микробу; 3) действие физических, химических и биологических факторов окружающей микроб и макроорганизм внешней среды, которая и обуславливает возможность установления контактов между представителями разных видов, общность территории обитания разных видов, пищевые связи, плотность и численность популяций, особенности передачи генетической информации, особенности миграции и т. д. При этом по отношению к человеку под условиями внешней среды прежде всего следует понимать социальные условия его жизнедеятельности. Первые два биологических фактора являются непосредственными участниками инфекционного процесса, развивающегося в макроорганизме под действием микроба. При этом микроб определяет специфичность инфекционного процесса, а решающий интегральный вклад в форму проявления инфекционного процесса, его длительность, степень тяжести проявлений и исход вносит состояние макроорганизма, прежде всего факторы его неспецифической резистентности, на помощь которым приходят факторы специфического приобретенного иммунитета. Третий, экологический, фактор оказывает на инфекционный процесс опосредованное воздействие, снижая или повышая восприимчивость макроорганизма, либо снижая и повышая инфицирующую дозу и вирулентность возбудителя, активируя механизмы заражения и соответствующие им пути передачи инфекции, и т. д. Патогенность — видовой признак, передающийся по наследству, закрепленный в геноме микроорганизма, в процессе эволюции паразита, т. е. это генотипи-ческий признак, отражающий потенциальную возможность микроорганизма проникать в макроорганизм (инфективность) и размножаться в нем (инвазионность), вызывать комплекс патологических процессов, возникающих при заболевании. Фенотипическим признаком патогенного микроорганизма является его вирулентность, т.е. свойство штамма, которое проявляется в определенных условиях (при изменчивости микроорганизмов, изменении восприимчивости макроорганизма и т.д.). Вирулентность можно повышать, понижать, измерять, т.е. она является мерой патогенности. Количественные показатели вирулентности могут быть выражены в DLM (минимальная летальная доза), DL« (доза, вызывающая гибель 50 % экспериментальных животных). При этом учитывают вид животных, пол, массу тела, способ заражения, срок гибели. |
3. Методы микробиологической диагностики вирусных инфекций.
Используют 3 метода лабораторной диагностики: вирусоскопический, вирусологический (ведущий метод), серологический. Вирусоскопический метод заключается в обнаружении вируса в исследуемом материале под микроскопом. Чаще всего используют электронный микроскоп. Световая микроскопия из-за ничтожно малых размеров вирусов практически не применяется. И лишь для обнаружения крупных вирусов, применяя методы «сверхокраски», можно использовать световой микроскоп. Кроме того, с помощью светового микроскопа можно выявить внутриклеточные включения, которые образуются в пораженных клетках при некоторых инфекциях. Вирусологический метод заключается в заражении исследуемым материалом чувствительной биологической модели (лабораторные животные, куриные эмбрионы или культуры клеток), индикации вируса и его последующей идентификации. В культуре клеток наличие вируса определяют по цитопатическому действию гемадсорбции, феномену бляшкообразования, реакции гемагглютинации, отсутствию изменения окраски индикатора. Идентификация вируса осуществляется с помощью серологических реакций (РПГА, РТГА, РН, РСК, ИФА). Вирусологический метод позволяет точно определить природу возбудителя, но он требует достаточного много времени (5—7 дней и более). Особенностью серологического метода в вирусологии является исследование парных сывороток. Первую сыворотку берут у больного в острый период в начале болезни, а вторую сыворотку берут через 10 дн. Сыворотки исследуют одномоментно. О болезни свидетельствует сероконверсия, т.е. нарастание титра антител во второй сыворотке по отношению к первой. Диагностической является сероконверсия в 4 раза и выше. |
|
Билет № 32 |
Билет № 32 |
Билет № 32 |
|
1. Возбудители сальмонеллёзов. Таксономия. Характеристика. Микробиологическая диагностика сальмонеллёзов. Принципы профилактики и лечения.
Острая кишечная зоонозная инфекция, вызываемая сероварами сальмонелл, характеризующаяся поражением ЖКТ. Морфологические свойства: подвижные, грам «-» палочки, капсулы нет. Хорошо растут на простых питательных и желчесодержащих средах. На плотных – образуют колонии в R-и S-формах, на жидких – помутнение. На лактозособержащих средах образуют бесцветные колонии. Биохимическая активность: ферментация глк. до кислоты и газа, отсутствие ферментации лактозы, продукция сероводорода, отсутствие индолообразования. Антигенная структура: соматический О-антиген, жгутиковый Н-антиген, Некоторые – К-антиген. Род Salmonella состоит из двух видов — вида S. enterica, в который включены все сальмонеллы, являющиеся возбудителями человека и теплокровных животных, и вида S. bongori, который подразделяется на 10 сероваров. Вид S. enterica разделен на 6 подвидов, которые подразделены на серовары. Некоторые серовары сальмонелл, в частности S. Typhi, имеют полисахаридный Vi-антиген, являющийся разновидностью К-антигена. Эпидемиология. Возбудителями сальмонеллеза является большая группа сальмонелл, входящая в подвид enterica. Наиболее часто возбудителями сальмонеллезов у человека являются серовары S. Typhimurium, S. Dublin, S. Choleraesuis. Основные факторы передачи — мясо, молоко, яйца, вода. Патогенез и клиника. Заболевание протекает в локальной форме гастроэнтерита, ведущий синдром - диарейный. Инвазировав слизистую тонкого кишечника через М-клетки и проникнув в подслизистую, сальмонеллы захватываются макрофагами, переносясь ими в пейеровы бляшки, где формируют первичный очаг инфекции. При этом выделяются эндотоксин и белковый энтеротоксин. Энтеротоксин активирует поступление в просвет кишечника большого количества жидкости, К,Na. Понос, рвота. Иммунитет: Ненапряженный, серовароспецифический, опосредован секреторным IgA, который предотвращает процесс пенетрации сальмонеллами слизистой тонкого кишечника. В крови могут определяться антитела. Микробиологическая диагностика. Бактериологическому исследованию подвергают рвотные массы, промывные воды желудка, испражнения, желчь, мочу, кровь. При идентификации выделенных культур необходим широкий набор диагностических О- и Н- сывороток. Для серологического исследования применяют РНГА, ИФА. Важное диагностическое значение имеет нарастание титра антител в динамике заболевания. Лечение. Применяется патогенетическая терапия, направленная на нормализацию водно-солевого обмена. При генерализованных формах — этиотропная антибиотикотерапия. Сальмонеллезные групповые, адсорбированные О- и Н-агглютинирующие сыворотки. Применяются для установления серогрупп и сероваров сальмонелл в реакции агглютинации. Сальмонеллезные О- и Н-монодиагностикумы представляют собой взвеси сальмонелл, убитых нагреванием (О-диагностикумы) или обработкой формалином (Н-диагностикумы). Применяются для серодиагностики брюшного тифа. Профилактика. Специфическая профилактика сальмонеллеза у с/х животных и птиц. Неспецифическая профилактика - проведение ветеринарно-санитарных мероприятий. |
2. Рост и размножение бактерий. Фазы размножения.
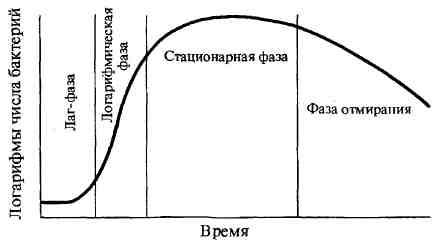
Жизнедеятельность бактерий характеризуется ростом — формированием структурно-функциональных компонентов клетки и увеличением самой бактериальной клетки, а также размножением — самовоспроизведением, приводящим к увеличению количества бактериальных клеток в популяции. Бактерии размножаются путем бинарного деления пополам, реже путем почкования. Актиномицеты, как и грибы, могут размножаться спорами. Актиномицеты, являясь ветвящимися бактериями, размножаются путем фрагментации нитевидных клеток. Грамположительные бактерии делятся путем врастания синтезирующихся перегородок деления внутрь клетки, а грамотрицательные — путем перетяжки, в результате образования гантелевид-ных фигур, из которых образуются две одинаковые клетки. Делению клеток предшествует репликация бактериальной хромосомы по полуконсервативному типу (двуспиральная цепь ДНК раскрывается и каждая нить достраивается комплементарной нитью), приводящая к удвоению молекул ДНК бактериального ядра — нуклеоида. Репликация ДНК происходит в три этапа: инициация, элонгация, или рост цепи, и терминация. Размножение бактерий в жидкой питательной среде. Бактерии, засеянные в определенный, не изменяющийся объем питательной среды, размножаясь, потребляют питательные элементы, что приводит в дальнейшем к истощению питательной среды и прекращению роста бактерий. Культивирование бактерий в такой системе называют периодическим культивированием, а культуру — периодической. Если же условия культивирования поддерживаются путем непрерывной подачи свежей питательной среды и оттока такого же объема культуральной жидкости, то такое культивирование называется непрерывным, а культура — непрерывной. При выращивании бактерий на жидкой питательной среде наблюдается придонный, диффузный или поверхностный (в виде пленки) рост культуры. Рост периодической культуры бактерий, выращиваемых на жидкой питательной среде, подразделяют на несколько фаз, или периодов: 1. лаг-фаза; 2. фаза логарифмического роста; 3. фаза стационарного роста, или максимальной концентрации бактерий; 4. фаза гибели бактерий. Эти фазы можно изобразить графически в виде отрезков кривой размножения бактерий, отражающей зависимость логарифма числа живых клеток от времени их культивирования.
Лаг-фаза — период между посевом бактерий и началом размножения. Продолжительность лаг-фазы в среднем 4—5 ч. Бактерии при этом увеличиваются в размерах и готовятся к делению; нарастает количество нуклеиновых кислот, белка и других компонентов. Фаза логарифмического (экспоненциального) роста является периодом интенсивного деления бактерий. Продолжительность ее около 5— 6 ч. При оптимальных условиях роста бактерии могут делиться каждые 20—40 мин. Во время этой фазы бактерии наиболее ранимы, что объясняется высокой чувствительностью компонентов метаболизма интенсивно растущей клетки к ингибиторам синтеза белка, нуклеиновых кислот и др. Затем наступает фаза стационарного роста, при которой количество жизнеспособных клеток остается без изменений, составляя максимальный уровень (М-концентрация). Ее продолжительность выражается в часах и колеблется в зависимости от вида бактерий, их особенностей и культивирования. Завершает процесс роста бактерий фаза гибели, характеризующаяся отмиранием бактерий в условиях истощения источников питательной среды и накопления в ней продуктов метаболизма бактерий. Продолжительность ее колеблется от 10 ч до нескольких недель. Интенсивность роста и размножения бактерий зависит от многих факторов, в том числе оптимального состава питательной среды, окислительно-восстановительного потенциала, рН, температуры и др. Размножение бактерий на плотной питательной среде. Бактерии, растущие на плотных питательных средах, образуют изолированные колонии округлой формы с ровными или неровными краями (S- и R-формы), различной консистенции и цвета, зависящего от пигмента бактерий. Пигменты, растворимые в воде, диффундируют в питательную среду и окрашивают её. Другая группа пигментов нерастворима в воде, но растворима в органических растворителях. И, наконец, существуют пигменты, не растворимые ни в воде, ни в органических соединениях. Наиболее распространены среди микроорганизмов такие пигменты, как каротины, ксантофиллы и меланины. Меланины являются нерастворимыми пигментами черного, коричневого или красного цвета, синтезирующимися из фенольных соединений. Меланины наряду с каталазой, супероксидцисмутазой и пероксидазами защищают микроорганизмы от воздействия токсичных перекисных радикалов кислорода. Многие пигменты обладают антимикробным, антибиотикоподобным действием. |
3. Понятие об иммуномодуляторах. Принципы действия. Применение.
Иммуномодуляторы – вещества, оказывающие влияние на функцию иммунной системы, изменяющие активность иммунной системы в сторону повешения (иммуностимуляторы) или понижения (иммунодепрессанты) её активности. К экзогенным иммуномодуляторам относится большая группа веществ различной химической природы и происхождения, оказывающих неспецифическое активирующее или супрессивное действие на иммунную систему, но являющихся чужеродными для организма. Антибиотики, левамизол, полисахариды, ЛПС, адъюванты. Эндогенные иммуномодуляторы представляют собой достаточно большую группу олигопептидов, синтезируемых самим организмом, его иммунокомпетентными клетками, и способных активировать иммунную систему путем усиления функции иммунокомпетентных клеток. К ним относятся регуляторные пептиды: интерлейкины, интерфероны, гормоны тимуса. Применение иммуномодуляторов: при первичных и вторичных имму-нодефицитах различного происхождения, при онкологических болезнях, при трансплантации органов и тканей, при лечении иммунопатологических и аллергических болезней, в иммунопрофилактике и лечении инфекционных болезней. Созданы препараты, обладающие иммуномодулирующим действием: интерферон, лейкоферон, виферон. |