|
Билет № 42 |
Билет № 42 |
Билет № 42 |
|
1. Возбудитель сыпного тифа и болезни Брилля-Цинссера. Таксономия. Характеристика. Микробиологическая диагностика. Специфическая профилактика и лечение.
Эпидемический сыпной тиф — острый антропоноз с трансмиссивным механизмом распространения платяными вшами. Клинически характеризуется лихорадкой, тяжелым течением в связи с поражением кровеносных капилляров с нарушением кровоснабжения жизненно важных органов (мозг, сердце, почки), появлением сыпи. Таксономия и общая характеристика: Возбудитель — R. prowazekii, род Rickettsia семейство Rickettsiaceae; паразитирует только в цитоплазме чувствительных клеток. Хорошо культивируется в организме платяных вшей, желточных мешках, обладает гемолитическими свойствами, способен формировать негативные колонии («бляшки») в культуре клеток; при окраске по Здродовскому окрашивается в красный цвет. Устойчив к действию факторов внешней среды; длительно сохраняется в высохших фекалиях инфицированных вшей. Эпидемиология и механизм заражения. Заражение реализуется либо втиранием фекалий инфицированных вшей через расчесы кожи, либо путем вдыхания пылевидного аэрозоля из высохших инфицированных риккетсиями фекалий. Клиника, диагноз, лечение. Инкубационный период 10 дней. Начало заболевания острое, клинические проявления обусловлены генерализованным поражением системы эндотелиальных клеток кровеносных сосудов, что приводит к нарушению каскада тромбо-антитромбообразования. Морфологическую основу болезни составляет генерализованный васкулит с формированием сыпи на кожных покровах. Болезнь протекает с высокой температурой, симптомами поражения сердечно-сосудистой и нервной систем. Иммунитет — непродолжительный, клеточно-гуморальный. Диагностика: осуществляется по клинико-эпидемиологическим данным, подкрепляется лабораторным исследованием на специфические антитела (РСК, РНГА, ИФА и др.). Лечение: Быстрое этиотропное лечение однократным приемом доксициклина, при его отсутствии — препаратами тетрациклинового ряда. Профилактика. Изоляция завшивленных больных, дезинфекция препаратами, содержащими перметрин. Для специфической профилактики разработана живая вакцина из штамма Е, которая применяется в комбинации с растворимым антигеном риккетсии Провачека (живая комбинированная сыпнотифозная вакцина из штамма), а также инактивированная вакцина из растворимого антигена. Болезнь Бриля – рецидив после ранее перенесенного эпидемического сыпного тифа. Возбудитель— R. prowazekii. Клинически протекает как эпидемический тиф легкой и средней тяжести. Патоморфология инфекционного процесса та же, что и при эпидемической форме. Различие заключается в эпидемиологии (нет переносчика, отсутствует сезонность проявления, источник и реализация способа заражения) и патогенезе начальной стадии болезни. Она возникает вследствие активации латентно «дремлющих» риккетсий. Микробиологическая диагностика. Затруднена неопределенностью симптоматики на первой неделе заболевания (до появления сыпи) и ее сходством с симптомами при инфекциях, чаще брюшнотифозной. Диагноз устанавливается на основании клинико-эпидемиологических данных с учетом анамнеза больного и подкрепляется серологическим исследованием со специфическим антигеном. При отсутствии переносчика в очаге лечение может осуществляться без изоляции больного, в зависимости от его состояния. Прогноз благоприятен даже в отсутствии лечения антибиотиками. Профилактика. Меры профилактики те же, что и при эпидемической форме. Специфическая профилактика невозможна. |
2. Лекарственная устойчивость бактерий. Механизмы. Пути преодоления.
Антибиотикорезистентность — это устойчивость микробов к антимикробным химиопрепаратам. Бактерии следует считать резистентными, если они не обезвреживаются такими концентрациями препарата, которые реально создаются в макроорганизме. Резистентность может быть природной и приобретенной. Природная устойчивость. Некоторые виды микробов природно устойчивы к определенным семействам антибиотиков или в результате отсутствия соответствующей мишени (например, микоплазмы не имеют клеточной стенки, поэтому не чувствительны ко всем препаратам, действующим на этом уровне), или в результате бактериальной непроницаемости для данного препарата (например, грамотрицательные микробы менее проницаемы для крупномолекулярных соединений, чем грамположительные бактерии, так как их наружная мембрана имеет «маленькие» поры). Приобретенная устойчивость. Приобретение резистентности — это биологическая закономерность, связанная с адаптацией микроорганизмов к условиям внешней среды. Она, хотя и в разной степени, справедлива для всех бактерий и всех антибиотиков. К химиопрепаратам адаптируются не только бактерии, но и остальные микробы — от эукариотических форм (простейшие, грибы) до вирусов. Проблема формирования и распространения лекарственной резистентности микробов особенно значима для внутрибольничных инфекций, вызываемых так называемыми «госпитальными штаммами», у которых, как правило, наблюдается множественная устойчивость к антибиотикам (так называемая полирезистентность). Генетические основы приобретенной резистентности. Устойчивость к антибиотикам определяется и поддерживается генами резистентности (r-генами) и условиями, способствующими их распространению в микробных популяциях. Приобретенная лекарственная устойчивость может возникать и распространяться в популяции бактерий в результате: • мутаций в хромосоме бактериальной клетки с последующей селекцией (т. е. отбором) мутантов. Особенно легко селекция происходит в присутствии антибиотиков, так как в этих условиях мутанты получают преимущество перед остальными клетками популяции, которые чувствительны к препарату. Мутации возникают независимо от применения антибиотика, т. е. сам препарат не влияет на частоту мутаций и не является их причиной, но служит фактором отбора. Далее резистентные клетки дают потомство и могут передаваться в организм следующего хозяина (человека или животного), формируя и распространяя резистентные штаммы. Мутации могут быть: 1) единичные (если мутация произошла в одной клетке, в результате чего в ней синтезируются измененные белки) и 2) множественные (серия мутаций, в результате чего изменяется не один, а целый набор белков, например пени-циллинсвязывающих белков у пенициллин-резистентного пневмококка); • переноса трансмиссивных плазмид резистентности (R-плазмид). Плазмиды резистентности (трансмиссивные) обычно кодируют перекрестную устойчивость к нескольким семействам антибиотиков. Впервые такая множественная резистентность была описана японскими исследователями в отношении кишечных бактерий. Сейчас показано, что она встречается и у других групп бактерий. Некоторые плазмиды могут передаваться между бактериями разных видов, поэтому один и тот же ген резистентности можно встретить у бактерий, таксономически далеких друг от друга. Например, бета-лактамаза, кодируемая плазмидой ТЕМ-1, широко распространена у грамотрицательных бактерий и встречается у кишечной палочки и других кишечных бактерий, а также у гонококка, резистентного к пенициллину, и гемофильной палочки, резистентной к ампициллину; • переноса транспозонов, несущих r-гены (или мигрирующих генетических последовательностей). Транспозоны могут мигрировать с хромосомы на плазмиду и обратно, а также с плазмиды на другую плазмиду. Таким образом гены резистентности могут передаваться далее дочерним клеткам или при рекомбинации другим бактериям-реципиентам. Реализация приобретенной устойчивости. Изменения в геноме бактерий приводят к тому, что меняются и некоторые свойства бактериальной клетки, в результате чего она становится устойчивой к антибактериальным препаратам. Обычно антимикробный эффект препарата осуществляется таким образом: агент должен связаться с бактерией и пройти сквозь ее оболочку, затем он должен быть доставлен к месту действия, после чего препарат взаимодействует с внутриклеточными мишенями. Реализация приобретенной лекарственной устойчивости возможна на каждом из следующих этапов: • модификация мишени. Фермент-мишень может быть так изменен, что его функции не нарушаются, но способность связываться с химиопрепаратом (аффинность) резко снижается или может быть включен «обходной путь» метаболизма, т. е. в клетке активируется другой фермент, который не подвержен действию данного препарата. • «недоступность» мишени за счет снижения проницаемости клеточной стенки и клеточных мембран или «эффлюко-механизма, когда клетка как бы «выталкивает» из себя антибиотик. • инактивация препарата бактериальными ферментами. Некоторые бактерии способны продуцировать особые ферменты, которые делают препараты неактивными (например, бета-лактамазы, аминогликозид-модифицирующие ферменты, хлорамфениколацетилтрансфераза). Бета-лактамазы — это ферменты, разрушающие бета-лактамное кольцо с образованием неактивных соединений. Гены, кодирующие эти ферменты, широко распространены среди бактерий и могут быть как в составе хромосомы, так и в составе плазмиды. Для борьбы с инактивирующим действием бета-лактамаз используют вещества — ингибиторы (например, клавулановую кислоту, сульбактам, тазобактам). Эти вещества содержат в своем составе бета-лактамное кольцо и способны связываться с бета-лактамазами, предотвращая их разрушительное действие на бета-лактамы. При этом собственная антибактериальная активность таких ингибиторов низкая. Клавулановая кислота ингибирует большинство известныхбета-лактамаз. Ее комбинируют с пеницил-линами: амоксициллином, тикарциллином, пиперациллином. Предупредить развитие антибиотикорезистентности у бактерий практически невозможно, но необходимо использовать антимикробные препараты таким образом, чтобы не способствовать развитию и распространению устойчивости (в частности, применять антибиотики строго по показаниям, избегать их использования с профилактической целью, через 10—15 дней ан-тибиотикотерапии менять препарат, по возможности использовать препараты узкого спектра действия, ограниченно применять антибиотики в ветеринарии и не использовать их как фактор роста). |
3. Химические вакцины. Получение. Достоинства. Применение. Роль адъювантов.
Действующим началом этого типа препаратов являются протективные антигены бактерий, полученные путем воздействия ультразвука на бактериальные клетки. Главным преимуществом данного типа вакцин является их низкая реактогеннность. Адьюванты применяются для усиления иммуногенности вакцин. В качестве адъювантов используют минеральные сорбенты (гели гидрата окиси и фосфата аммония), полимеры, и др. хим. соединения, бактерии и компоненты бактерий, липиды, вещества, вызывающие воспалительную реакцию. Они действуют на антиген и организм в целом. Действие на антиген сводится к укрупнению молекул антигена, т. е. превращению растворимых антигенов в корпускулярные, в результате чего антиген лучше захватывается иммунокомпетентными клетками. При воздействии на организм в месте инъекции адьюванты вызывают воспалительный процесс образование фиброзной капсулы, что способствует более длительному сохранению антигена в «депо» и суммации антигенных раздражений. Адьюванты так же непосредственно активируют пролиферацию В, Т и А систем иммунитета. |
|
Билет № 43 |
Билет № 43 |
Билет № 43 |
|
1. Возбудитель клещевого энцефалита. Таксономия. Характеристика. Микробиологическая диагностика. Специфическая профилактика.
Таксономия: семейство Flaviviridae, род Flavivirus. Морфологические свойства: сложные, +РНК, структурные белки – V2капсид,V3суперкапсид,V1внутри от суперкапсида. Имеет пять генотипов, имеющих некоторые антигенные различия, но только один структурный гликопротеин V-3 индуцирует образование вируснейтрализующих антител. Он обладает четкой антигенной консервативностью. Несмотря на небольшую устойчивость вируса к действию физических и химических факторов, в организме переносчиков он сохраняет свою жизнеспособность от —150С до +30С. Резистентность: Высокая, к действию кислых значений рН, что важно при алиментарном пути заражения. Вирус обладает висцеротропностью и нейротропностью. К вирусу чувствительны белые мыши. Эпидемиология: Переносчиком и основным резервуаром являются иксодовые клещи. У клещей происходит трансовариальная и трансфазовая передача вируса. Поддержание циркуляции осуществляется за счет прокормителей клещей — грызунов, птиц, диких животных. Характерна весенне-летняя сезонность. Патогенез: Человек заражается трансмиссивно при укусе инфицированными клещами, от которых в период кровососания вирус проникает в макроорганизм. Проникновение вируса в организм возможно также контактным путем через мелкие повреждения кожи. Алиментарный путь заражения при употреблении сырого молока коз и овец. Употребление молока ведет к ощелачиванию желудочного сока, что препятствует инактивации вируса. Инкубационный период — от 8 до 23 дн. Клиника: Сначала вирус размножается в месте входных ворот инфекции под кожей, откуда он попадает в кровь. Возникает резорбтивная вирусемия. Вирус проникает в эндотелий кровеносных сосудов, внутренних органов, где активно размножается. При пищевом пути заражения входными воротами является слизистая оболочка глотки и тонкой кишки. В конце инкубационного периода в эндотелии кровеносных сосудов возникает вторичная вирусемия, длящаяся 5 дн. Вирусы гематогенно, периневрально проникают в головной и спинной мозг, поражая мотонейроны (крупные двигательные клетки в сером веществе спинного мозга). Различают три клинические формы клещевого энцефалита: лихорадочную, менингеальную и очаговую. Иммунитет: После перенесенного заболевания остается стойкий иммунитет. Вирус клещевого энцефалита относится к факультативным возбудителям медленных вирусных инфекций. Микробиологическая диагностика: Выделение вируса из крови и цереброспинальной жидкости, внутренних органов и мозга путем интрацеребрального заражения мышей и культур клеток. Идентификацию вируса проводят в РТГА, РН и РСК, а в монослое культур клеток — в РИФ. Обнаружение антител в парных сыворотках и цереброспинальной жидкости проводят с помощью РСК и РТГА, а также других серологических реакций. Экспресс-диагностика основана на обнаружении вирусного антигена в крови с помощью РИГА и ИФА, выявлении IgM антител на первой неделе заболевания в цереброспинальной жидкости и обнаружении РНК-вируса в крови и цереброспинальной жидкости у людей, в клещах и внутренних органах животных с помощью ПЦР. Лечение и профилактика: Для лечения и экстренной профилактики применяют специфический гомологичный донорский иммуноглобулин против клещевого энцефалита, полученный из плазмы доноров, проживающих в природных очагах клещевого энцефалита и содержащий в высоком титре антитела к вирусу клещевого энцефалита. При отсутствии препарата назначают специфический гетерологичный лошадиный иммуноглобулин. При лечении тяжелых форм применяют иммуногемосорбцию и серотерапию иммунной плазмой доноров. Применяют виферон, ридостин, рибонуклеазу. Активная иммунизация – убитые вакцины: 1. Вакцина против клещевого энцефалита культуральная сорбированная инактивированная жидкая; 2. Вакцина против клещевого энцефалита культуральная очищенная концентрированная инактивированная сухая (вакцина клещевого энцефалита концентрированная), предназначенная для вакцинации взрослых; 3. Австрийская вакцина клещевого энцефалита культуральная очищенная концентрированная инактивированная для иммунизации детей; 4. Вакцина против клещевого энцефалита очищенная концентрированная инактивированная «Энцепур К» 5. Культуральная концентрированная инактивированная сухая вакцина для профилактики клещевого энцефалита у детей с 4-летнего возраста Для формирования надежной защиты необходима ревакцинация, так как при вакцинации убитыми вакцинами формируется кратковременный иммунитет. Протективным действием обладает неструктурный белок NS1 вируса - растворимый комплементсвязывающий антиген. Он является компонентом для противовирусных вакцин. |
2. Анафилактический шок и сывороточная болезнь. Причины возникновения, механизмы. Предупреждение анафилактического шока.
Анафилаксия представляет собой реакцию немедленного типа, возникающую при парентеральном повторном введении антигена в ответ на повреждающее действие комплекса антиген — антитело и характеризующуюся стереотипно протекающей клинической и морфологической картиной. Основную роль в анафилаксии играет цитотропный IgE, имеющий сродство к клеткам, в частности базофилам и тучным клеткам. После первого контакта организма с антигеном образуется IgE, который вследствие цитотропности адсорбируется на поверхности названных выше клеток. При повторном попадании в организм этого же антигена IgE связывает антиген с образованием на мембране клеток комплекса IgE — антиген. Комплекс повреждает клетки, которые в ответ на это выделяют медиаторы — гистамин и гистаминоподобные вещества (серотонин, кинин). Эти медиаторы связываются рецепторами, имеющимися на поверхности функциональных мышечных, секреторных, слизистых и других клеток, вызывая их соответствующие реакции. Это ведет к сокращению гладкой мускулатуры бронхов, кишечника, мочевого пузыря, повышению проницаемости сосудов и другим функциональным и морфологическим изменениям, которые сопровождаются клиническим проявлением. Клинически анафилаксия проявляется в виде одышки, удушья, слабости, беспокойства, судорог, непроизвольного мочеиспускания, дефекации и др. Анафилактическая реакция протекает в три фазы: в 1-й фазе происходит сама реакция антиген — антитело; во 2-й фазе выделяются медиаторы анафилактической реакции; в 3-й фазе проявляются функциональные изменения. Анафилактическая реакция возникает спустя несколько минут или часов после повторного введения антигена. Протекает в виде анафилактического шока или как местные проявления. Интенсивность реакции зависит от дозы антигена, количества образующихся антител, вида животного и может закончиться выздоровлением или смертью. Анафилаксию легко можно вызвать в эксперименте на животных. Оптимальной моделью для воспроизведения анафилаксии является морская свинка. Анафилаксия может возникать на введение любого антигена любым способом (подкожно, через дыхательные пути, пищеварительный тракт) при условии, что антиген вызывает образование иммуноглобулинов. Доза антигена, вызывающая сенсибилизацию, т. е. повышенную чувствительность, называется сенсибилизирующей. Она обычно очень мала, так как большие дозы могут вызвать не сенсибилизацию, а развитие иммунной защиты. Доза антигена, введенная уже сенсибилизированному к нему животному и вызывающая проявление анафилаксии, называется разрешающей. Разрешающая доза должна быть значительно больше, чем сенсибилизирующая. Состояние сенсибилизации после встречи с антигеном сохраняется месяцами, иногда годами; интенсивность сенсибилизации можно искусственно уменьшить введением малых разрешающих доз антигена, которые связывают и выводят из циркуляции в организме часть антител. Этот принцип был использован для десенсибилизации (гипосенсибилизации), т.е. предупреждения анафилактического шока при повторных введениях антигена. Впервые способ десенсибилизации предложил русский ученый А. Безредка (1907), поэтому он называется способом Безредки. Способ состоит в том, что человеку, ранее получавшему какой-либо антигенный препарат (вакцину, сыворотку, антибиотики, препараты крови и др.), при повторном введении (при наличии у него повышенной чувствительности к препарату) вначале вводят небольшую дозу (0,01; 0,1 мл), а затем, через 1—1'/2 ч, — основную. Таким приемом пользуются во всех клиниках для избежания развития анафилактического шока; этот прием является обязательным. Возможен пассивный перенос анафилаксии с антителами. Сывороточной болезнью называют реакцию, возникающую при разовом парентеральном введении больших доз сывороточных и других белковых препаратов. Обычно реакция возникает спустя 10—15 сут. Механизм сывороточной болезни связан с образованием антител против введенного чужеродного белка (антигена) и повреждающим действием на клетки комплексов антиген — антитело. Клинически сывороточная болезнь проявляется отеком кожи и слизистых оболочек, повышением температуры тела, при-пуханием суставов, сыпью и зудом кожи; наблюдаются изменения в крови (увеличение СОЭ, лейкоцитоз и др.). Сроки проявления и тяжесть сывороточной болезни зависят от содержания циркулирующих антител и дозы препарата. Это объясняется тем, что ко 2-й неделе после введения белков сыворотки вырабатываются антитела к белкам сыворотки и образуется комплекс антиген — антитело. Профилактика сывороточной болезни осуществляется по способу Безредки. |
3. Внутривидовая идентификация бактерий (эпидемиологическое маркирование).
С целью выявления эпидемической цепочки заболевания, в т. ч. для обнаружения источника инфекции, осуществляют внутривидовую идентификацию бактерий, к-рая заключается в определении фаготипа (фаговара), изучении антигенных и других свойств выделенных бактерий. Определение фаготипа - фаготипирование производят при стафилококковой инфекции, брюшном тифе, паратифе В. Фаготипирование — один из методов эпидемиологического маркирования. Применяется для выявления источника инфекции. Выделение бактерий одного фаговара от разных больных указывает на общий источник их заражения. Предварительно фаготируется. При внутривидовой идентификации бактерий, т. е. при определении фаговара (фаготипа) бактерий с помощью фаготи-пирования, на чашку с плотной питательной средой, засеянную чистой культурой возбудителя в виде «газона», наносят капли различных диагностических типоспецифических фагов. Бактерии, чувствительные к фагу, лизируются (образуется стерильное пятно, «бляшка» или так называемая негативная колония фага). На засеянные «газоном» стафилококки наносятся капли взвеси стафилококковых бактериофагов. Через сутки после инкубации в термостате видны стерильные зоны отсутствия роста бактерий (стерильные «бляшки») в результате размножения бактериофагов, вызывающих лизис этих бактерий. |
|
Билет № 44 |
Билет № 44 |
Билет № 44 |
|
1. Возбудитель лихорадки Ку. Таксономия. Характеристика. Микробиологическая диагностика. Специфическая профилактика и лечение.
Зооантропоноз, с аэрогенным механизмом заражения, характеризуется лихорадкой, поражением дыхательной системы (пневмония). Таксономия и общая характеристика. Возбудитель — Coxiella burnetii. Имеет более мелкие, чем риккетсии, размеры, полиморфен; чаше в форме коккобацилл. Окрашивается в красный цвет при окраске по Здродовскому, по Романовскому. Внутриклеточный паразит. Хорошо размножается в клещах, культурах клеток. По структуре клеточной стенки отличается от риккетсий наличием (1 фаза) или отсутствием (II фаза) в оболочке структурного липополисахарида. Гемолитические свойства не установлены, бляшкообразование выражено. Размножается в фаголизосомах протоплазмы чувствительных клеток. Устойчив к факторам внешней среды, длительно сохраняется на предметах. Эпидемиология. Источник возбудителя - крупный и мелкий рогатый скот. Инфекция неконтагиозна, поддерживается за счет грызунов, с участием клещей. Инфекция у клещей передается потомству трансовариально. Заражение— аэрогенное — в результате вдыхания аэрозолей, содержащих возбудителя, или пероральное — при употреблении в пищу мясных и молочных продуктов больных животных. Клиника: Болезнь протекает в острой, подострой или хронической форме. Инкубационный период при острой форме 12 дней. Заболевание носит характер лихорадки с поражением дыхательной системы (пневмонии) и гепатолиенальным синдромом. Сыпь не характерна. Первичными клетками-мишенями для коксиелл служат гистиоциты и макрофаги, дополнительно — клетки эндотелиальной системы кровеносных сосудов. Микробиологическая диагностика: Особенности коксиелл, связанные с их фазовым состоянием, затрудняют лабораторную диагностику. Последняя осуществляется с применением в серологических реакциях (РСК, РНИФ, ИФА) антигенов I и II фаз коксиелл. Обнаружение у больного IgG антител к антигену 1 фазы в титре 1:800 подтверждает хроническую форму болезни. Лечение: Препаратами тетрациклинового (тетрациклин, доксициклин) и хинолонового ряда. Лечение хронических форм и осложнений требует длительного, комбинированного применения антибиотиков. Профилактика: Существует живая вакцина на основе штамма М-44 коксиелл Бернета, для вакцинации прежде всего с/х животных с целью уменьшения опасности выделения коксиелл в окружающую среду. Неспецифическая профилактика - эпидемиологический надзор за коксиеллезом. |
2. Нормальная микрофлора организма человека и её функции. Дисбиозы. Эубиотики.
Организм человека заселен (колонизирован) более чем 500 видов микроорганизмов, составляющих нормальную микрофлору человека, находящихся в состоянии равновесия (эубиоза) друг с другом и организмом человека. Микрофлора представляет собой стабильное сообщество микроорганизмов, т.е. микробиоценоз. Она колонизирует поверхность тела и полости, сообщающиеся с окружающей средой. Место обитания сообщества микроорганизмов называется биотопом. В норме микроорганизмы отсутствуют в легких и матке. Различают нормальную микрофлору кожи, слизистых оболочек рта, верхних дыхательных путей, пищеварительного тракта и мочеполовой системы. Среди нормальной микрофлоры выделяют резидентную и транзиторную микрофлору. Резидентная (постоянная) облигатная микрофлора представлена микроорганизмами, постоянно присутствующими в организме. Транзиторная (непостоянная) микрофлора не способна к длительному существованию в организме. Микрофлора кожи имеет большое значение в распространении микроорганизмов в воздухе. На коже и в ее более глубоких слоях (волосяные мешочки, просветы сальных и потовых желез) анаэробов в 3—10 раз больше, чем аэробов. Кожу колонизируют пропионибактерии, коринеформные бактерии, стафилококки, стрептококки, дрожжи Pityrosporum, дрож-жеподобные грибы Candida, редко микрококки, Мус. fortuitum. На 1 см2 кожи приходится менее 80 000 микроорганизмов. В норме это количество не увеличивается в результате действия бактерицидных стерилизующих факторов кожи. В верхние дыхательные пути попадают пылевые частицы, нагруженные микроорганизмами, большая часть которых задерживается в носо- и ротоглотке. Здесь растут бактероиды, коринеформные бактерии, гемофильные палочки, пептококки, лактобактерии, стафилококки, стрептококки, непатогенные нейссерии и др. Трахея и бронхи обычно стерильны. Микрофлора пищеварительного тракта является наиболее представительной по своему качественному и количественному составу. При этом микроорганизмы свободно обитают в полости пищеварительного тракта, а также колонизируют слизистые оболочки. В полости рта обитают актиномицеты, бактероиды, бифи-цобактерии, эубактерии, фузобактерии, лактобактерии, гемофильные палочки, лептотрихии, нейссерии, спирохеты, стрептококки, стафилококки, вейлонеллы и др. Обнаруживаются также грибы рода Candida и простейшие. Ассоцианты нормальной микрофлоры и продукты их жизнедеятельности образуют зубной налет. Микрофлора желудка представлена лактобациллами и дрожжами, единичными грамотрицательными бактериями. Она несколько беднее, чем, например, кишечника, так как желудочный сок имеет низкое значение рН, неблагоприятное для жизни многих микроорганизмов. В тонкой кишке микроорганизмов больше, чем в желудке; здесь обнаруживаются бифидобактерии, клостридии, эубактерии, лактобациллы, анаэробные кокки. Наибольшее количество микроорганизмов накапливается в толстой кишке. В 1 г фекалий содержится до 250 млрд микробных клеток. Около 95 % всех видов микроорганизмов составляют анаэробы. Основными представителями микрофлоры толстой кишки являются: грамположительные анаэробные палочки (бифидобактерии, лактобациллы, эубактерии); грамположительные спорообразующие анаэробные палочки (клостридии, перфрингенс и др.); энтерококки; грамотрицательные анаэробные палочки (бактероиды); грамотрицательные факультативно-анаэробные палочки (кишечные палочки и сходные с ними бактерии. Микрофлора толстой кишки — своеобразный экстракорпоральный орган. Она является антагонистом гнилостной микрофлоры, так как продуцирует молочную, уксусную кислоты, антибиотики и др. Известна ее роль в водно-солевом обмене, регуляции газового состава кишечника, обмене белков, углеводов, жирных кислот, холестерина и нуклеиновых кислот, а также продукции биологически активных соединений — антибиотиков, витаминов, токсинов и др. Пристеночная микрофлора кишечника колонизирует слизистую оболочку в виде микроколоний, образуя своеобразную биологическую пленку, состоящую из микробных тел и экзополи-сахаридного матрикса. Экзополисахариды микроорганизмов, называемые гликокаликсом, защищают микробные клетки от разнообразных физико-химических и биологических воздействий. Слизистая оболочка кишечника также находится под защитой биологической пленки. Состояния, развивающиеся в результате утраты нормальных функций микрофлоры, называются дисбактериозом и дисбиозом. Дисбиозы классифицируют по этиологии (грибковый, стафилококковый, протейный и др.) и по локализации (дисбиоз рта, кишки, влагалища и т. д.). Изменения в составе и функциях нормальной микрофлоры сопровождаются различными нарушениями: развитием инфекций, диарей, запоров, синдрома мальабсорбции, гастритов, колитов, язвенной болезни, злокачественных новообразований, аллергий, мочекаменной болезни, гипо- и гиперхолестеринемии, гипо- и гипертензии, кариеса, артрита, поражений печени и др.
|
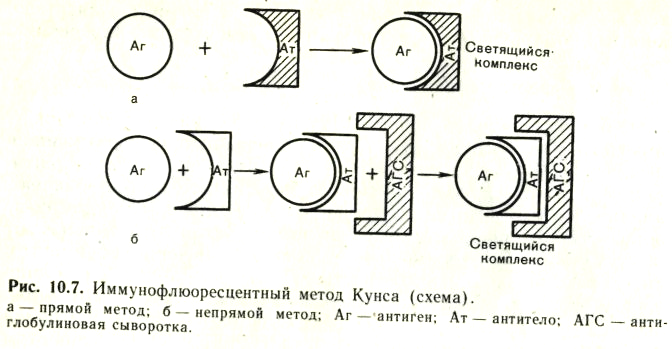
3. Реакция иммунофлюоресценции. Механизм, компоненты, применение.
Иммунофлюоресцентный метод (РИФ, реакция иммунофлюоресценции, реакция Кунса) - метод выявления специфических Аг с помощью Ат, конъюгированных с флюорохромом. Обладает высокой чувствительностью и специфичностью. Применяется для экспресс-диагностики инфекционных заболеваний (идентификация возбудителя в исследуемом материале), а также для определения Ат и поверхностных рецепторов и маркеров лейкоцитов (иммунофенотипирование) и др. клеток. Обнаружение бактериальных и вирусных антигенов в инфекционных материалах, тканях животных и культурах клеток при помощи флюоресцирующих антител (сывороток) получило широкое применение в диагностической практике. Приготовление флюоресцирующих сывороток основано на способности некоторых флюорохромов (например, изотиоцианата флюоресцеина) вступать в химическую связь с сывороточными белками, не нарушая их иммунологической специфичности. Различают три разновидности метода: прямой, непрямой, с комплементом. Прямой метод РИФ основан на том, что антигены тканей или микробы, обработанные иммунными сыворотками с антителами, меченными флюорохромами, способны светиться в УФ-лучах люминесцентного микроскопа. Бактерии в мазке, обработанные такой люминесцирующей сывороткой, светятся по периферии клетки в виде каймы зеленого цвета. Непрямой метод РИФ заключается в выявлении комплекса антиген - антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из взвеси микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс микроб + антимикробные кроличьи антитела + антикроличьи антитела, меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе, как и при прямом методе. Механизм. На предметном стекле готовят мазок из исследуемого материала, фиксируют на пламени и обрабатывают иммунной кроличьей сывороткой, содержащей антитела против антигенов возбудителя. Для образования комплекса антиген — антитело препарат помещают во влажную камеру и инкубируют при 37 °С в течение 15 мин, после чего тщательно промывают изотоническим раствором хлорида натрия для удаления не связавшихся с антигеном антител. Затем на препарат наносят флюоресцирующую антиглобулиновую сыворотку против глобулинов кролика, выдерживают в течение 15 мин при 37 °С, а затем препарат тщательно промывают изотоническим раствором хлорида натрия. В результате связывания флюоресцирующей антиглобулиновой сыворотки с фиксированными на антигене специфическими анти телами образуются светящиеся комплексы антиген — антитело, которые обнаруживаются при люминесцентной микроскопии.
|